AngioJet机械性吸栓术与单纯导管碎栓联合溶栓术治疗中高危急性肺动脉栓塞的疗效对比观察
2023-01-11魏立春苏奕明许太福罗长志韦肖敏叶奕辉蓝宇俭王有福侯培勇
魏立春, 苏奕明, 许太福, 罗长志, 张 科, 韦肖敏, 叶奕辉, 蓝宇俭, 王有福, 侯培勇
急性肺动脉栓塞(acute pulmonary embolism,APE)是临床常见的心血管疾病,其发病率在心脑血管疾病中仅次于脑卒中和心肌梗死,且呈逐年升高趋势,已成为临床上引发患者猝死的主要疾病[1]。APE的主要病理、生理基础是血栓阻塞肺动脉主干及分支后,肺通气-血流比例失调导致低氧血症;肺循环阻力增高、肺动脉高压导致右心衰竭,也是重症APE患者的首要致死原因。因此,如何快速、有效、安全地清除肺动脉血栓,恢复患者循环稳定及肺部气体交换功能,是临床亟待解决的一大难题。目前,国内外多个肺栓塞指南均提出,对于出现血流动力学紊乱的高危APE患者需行抗凝联合各种血栓清除治疗(包括系统溶栓、经皮介入或外科取栓)以快速改善肺血流灌注[2-4],但对于仅存在右心功能损害的中危APE患者是否需行溶栓治疗仍存在争议。目前,导管接触性溶栓(catheter-directed thrombolysis,CDT)治疗中高危APE的疗效和安全性得到了许多学者的肯定,但是对于一些存在溶栓禁忌或溶栓失败的患者,CDT的应用受到很大限制和质疑。AngioJet是一种经皮介入血栓流变抽吸装置,其在多种血栓性疾病治疗中取得了较满意的应用效果[5-7],但其目前在APE的应用研究甚少,且多数是病例报告或病例系列研究。鉴此,本研究旨在对比AngioJet机械性吸栓治疗和单纯导管碎栓联合溶栓治疗中高危APE患者的临床疗效。现报道如下。
1 对象与方法
1.1研究对象 选择2019年1月至2022年6月广西医科大学第四附属医院收治的中高危APE患者36例。根据患者的治疗意愿分为吸栓组(12例,采用AngioJet机械性吸栓治疗)和溶栓组(24例,采用单纯导管碎栓联合溶栓治疗)。两组性别、年龄、病程等基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究获医院医学伦理委员会批准(KY2019247),患者知情同意参与。
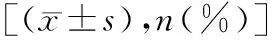
表1 两组基线资料比较
1.2纳入与排除标准 纳入标准:(1)经肺动脉CTA检查明确诊断为APE;(2)APE危险分层为中危或高危[8-9];(3)患者及家属同意行机械性吸栓或单纯导管碎栓联合溶栓治疗,并签署手术知情同意书;(4)患者依从性好,能够规范用药并规律随访。排除标准:(1)术前存在明显的凝血功能障碍,不宜接受抗凝或溶栓治疗者;(2)合并恶性肿瘤或一般情况差者,预期寿命<1年。
1.3治疗方法
1.3.1 基础治疗 术前所有患者均予患肢制动,若存在下肢深静脉血栓形成(deep venous thrombosis,DVT)则抬高患肢。吸氧,心电监测心率、呼吸、血压及经皮动脉血氧饱和度(percutaneous arterial oxygen saturation,SpO2)。适当补液,并控制入量,以避免循环负荷过重。在排除抗凝禁忌后,尽快给予低分子肝素钙(合肥兆科)5 000 IU,12 h/次,皮下注射。同时行扩张血管、改善循环等治疗。
1.3.2 介入治疗 (1)吸栓组予AngioJet机械性吸栓术。患者仰卧位,常规消毒术野皮肤并铺巾后,应用2%利多卡因局部浸润麻醉。肺动脉血栓机械性抽吸:经健侧股静脉穿刺置入6Fr血管鞘,经鞘管推注3 000~5 000 IU肝素(江苏万邦)。在泥鳅导丝引导下将猪尾导管分别送至下腔静脉、主肺动脉,以及左、右肺动脉干造影,明确下腔静脉内有无血栓及肺动脉栓塞的部位、范围和程度,并测定肺动脉内压力。经猪尾导管交换260 cm加硬导丝,经导丝置入AngioJet抽吸导管(Boston Scientific,USA),调控成喷药模式,经抽吸导管向栓塞侧肺动脉血栓内部喷射尿激酶(武汉人福,20万IU+50 ml生理盐水),5~8 s/侧。注意严格控制喷药时间,以防患者肺动脉压力急剧升高。15~20 min后调控成抽吸模式,抽吸导管移动速度控制在2~3 mm/s,可重复操作2~3次。手术中应随时询问患者有无胸闷、心慌、咳嗽等不适感,并密切观察心率和心跳节律变化。如有明显异常(常见症状为胸闷气紧、咳嗽等)时,应立即暂停操作(抽吸导管可暂时不必撤出肺动脉内),一般考虑肺动脉受刺激痉挛所致,可予加强吸氧以及经导管缓慢注射硝酸甘油(河南润弘)200~300 μg或罂粟碱(河南辅仁怀庆堂)30 mg以解除解痉。如心率<50次/min,可注射阿托品(江苏涟水)0.25 mg升高心率。抽吸结束后予造影复查血栓清除情况。如肺动脉内仍残留超过30%血栓,可置换猪尾导管,旋转导管头端进一步捣碎血栓,并向远端肺动脉注入尿激酶10万IU/侧。最后再次测定肺动脉压力。(2)溶栓组予单纯导管碎栓联合溶栓术治疗。操作基本同吸栓治疗,在造影明确肺动脉血栓部位、范围、程度及测定肺动脉压力后,继续使用猪尾导管配合加硬导丝,旋转猪尾导管头端捣碎血栓,并经其向患侧肺动脉注入尿激酶,10~15万IU/侧。
1.3.3 下腔静脉滤器安置 两组患者如存在下肢DVT,则均安置下腔静脉滤器。肺动脉血栓抽吸结束后,撤出导管,留置导丝。经导丝置入腔静脉滤器输送器(Aegisy,深圳先健),造影明确双肾静脉位置,将滤器准确定位并释放于肾静脉下段下腔静脉内,以预防肺动脉栓塞(pulmonary embolism,PE)复发。
1.3.4 术后治疗 延续术前治疗方案,并于出院后改为口服利伐沙班片,15 mg/次,2次/d,抗凝治疗3周。3周后改为利伐沙班片20 mg/d,抗凝治疗3~6个月。所有接受下腔静脉滤器置入术患者均在术后2周内取出滤器。
1.4观察指标 (1)手术相关指标:手术操作时间、尿激酶用量、SpO2。(2)手术相关不良事件发生情况:心律失常(窦性心动过缓或过速,以及室速等)、肺血管损伤(肺动脉夹层或破裂)、肾功能损害(肌酐较术前升高25%以上)、出血。(3)疗效情况:技术成功(即手术操作顺利完成)、治疗成功(即患者术后康复出院)情况。
1.5随访 于术后3、6、12、24个月复查肺动脉CTA或肺动脉造影了解血栓消融情况,通过心脏彩超检查心脏功能及肺动脉压力变化。PE复发定义为患者随访期间再次出现PE。

2 结果
2.1两组手术相关指标比较 与溶栓组相比,吸栓组手术操作时间更长,尿激酶用量更少,手术前后SpO2差更大,差异均有统计学意义(P<0.05)。见表2。
表2 两组手术相关指标比较
2.2两组疗效比较 吸栓组1例技术失败,系高危APE患者因术中突发呼吸心跳骤停而被迫终止手术。溶栓组1例技术失败,系高危APE患者因术中呼吸困难严重,不能配合手术,导管无法达到栓塞靶血管处,从而终止手术。吸栓组治疗失败3例:高龄(79岁)中危APE患者1例,合并严重的肺部感染,经积极救治后因呼吸循环衰竭死亡;高危APE患者2例,术后出现反复心跳呼吸骤停,导致全身多脏器功能衰竭死亡。溶栓组治疗失败5例:因脑出血死亡1例;因消化道出血死亡1例;因合并严重肺部感染死亡2例;因突发心肌梗死死亡1例。两组技术成功率、治疗成功率比较差异无统计学意义(P>0.05)。见表3。
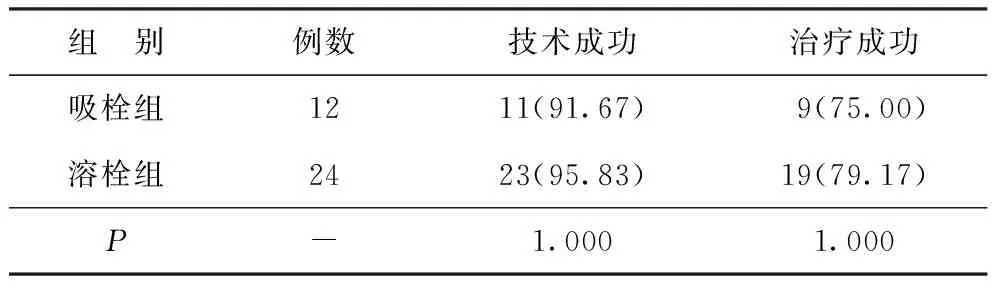
表3 两组疗效比较[n(%)]
2.3两组治疗相关不良事件发生率比较 吸栓组无出血病例。溶栓组发生出血8例,其中轻度咯血1例,脑出血1例,消化道出血1例,血尿3例,穿刺点小血肿2例。两组出血发生率比较差异有统计学意义(P<0.05)。两组肺血管损伤、肾功能损伤、心律失常发生率比较差异均无统计学意义(P>0.05)。见表4。

表4 两组治疗相关不良事件发生率比较[n(%)]
2.4两组PE复发率比较 两组患者随访3~24(12.50±3.25)个月。吸栓组PE复发2例,系因患者抗凝疗程不足(分别术后抗凝2个月和4个月)所致。溶栓组PE复发3例:1例因抗凝疗程不足(术后抗凝5个月)所致;1例考虑为易栓症,术后8个月停药而复发;1例因外伤骨折术后卧床过久而导致血栓复发。两组PE复发率比较差异无统计学意义(16.67% vs 12.50%;P=1.000)。
3 讨论
3.1APE是目前心血管死亡病因的第3位,特别是高危APE,其进展迅速、病死率高,每年全世界超过30万人因APE而死亡[10]。相关临床诊疗指南根据患者临床表现和严重程度对APE进行风险分级[11],对不同危险层级的肺栓塞患者采取分层治疗方式[9]。低危APE患者仅表现为轻度缺氧症状,无血流动力学和右心功能异常表现,予常规抗凝治疗即可。中危APE患者表现为缺血缺氧症状且存在右心功能不全表现,需要在有效抗凝基础上尽快实施手术治疗,疏通堵塞肺动脉,恢复有效循环血流。高危APE患者表现为患者体内明显缺氧,同时存在右心功能不全和血流动力学不稳定,需要充分抗凝并急诊手术,紧急疏通闭塞肺动脉,恢复心肺血流再灌注,挽救患者生命。
3.2APE成功治疗的关键是及时有效开通栓塞肺动脉,恢复正常血流动力学。对于中高危APE患者的救治是临床医师关注的难点[12],其抢救成功率较低,特别是高危APE患者,病死率高达60%[13]。传统开胸肺动脉内膜剥脱术及取栓术疗效确切,但麻醉风险和围手术期风险高,严重影响APE的有效救治,特别是对于存在基础心肺疾病的中老年患者,其应用受到了极大限制。
3.3随着腔内技术的发展和医疗器材的更新,APE的治疗方式向微小创伤发展,介入治疗成为当今的主流模式。CDT、经导管碎栓和吸栓是目前主要的腔内治疗方式。CDT作为传统减容方法,对于新发血栓效果良好,通过溶栓导管使药物与血栓直接接触,可以清除部分或全部血栓,快速开通堵塞血管,较全身系统溶栓治疗提高了溶栓疗效[14]。但是,CDT治疗常需要较大剂量的溶栓药物,对于高危患者增加了出血风险,限制了其临床应用。有研究显示,因溶栓造成大出血的概率高达20%,颅内出血达3%[15]。本研究中溶栓组术后出血发生率为33.33%,而颅内出血发生率为4.17%,与既往报道相似。经导管手动碎栓和吸栓,力度不均匀且较小,血栓清除效果有限。因此,减少或者避免溶栓药物用量,高效、安全地清除血栓是APE腔内治疗研究和发展的方向[16]。
3.4经皮机械性吸栓是一种新兴的介入减容技术,可高效、安全地消除腔内血栓,但其在APE的临床应用报道尚少,近年的一些研究初步验证了该方法的有效性和安全性[17-19]。AngioJet机械性血栓抽吸系统具有两种运行模式[20]:一种是喷射模式,使溶栓药物(一般是20 ml尿激酶溶于100 ml生理盐水)在高压喷射下击碎血栓,并与血栓内部充分接触,发挥最大溶栓效果,利于随后的抽吸。另外一种是抽吸模式,通过伯努利原理从导管前端抽吸走血栓碎块。由于肺动脉较短,相较下肢深静脉血栓负荷量小,喷射药物的时间较短,一般在10 s内。笔者将20 ml尿激酶溶于50 ml生理盐水中,增加局部药物浓度,结果显示效果良好且未发生出血并发症。本研究吸栓组的技术成功率为91.67%,仅1例高危APE患者术前出现低血压休克状态,术中喷药后突发呼吸心跳骤停而被迫终止;治疗成功率达到75.00%,也较为令人满意。可见,机械性吸栓在APE的应用,无论从理论上还是实践操作中均是可行的。
3.5由于机械性吸栓术中在喷射药物后需要静待15~20 min,以使药物充分渗透至血栓内部,达到血栓更加松软易被抽吸的效果。因此本研究吸栓治疗操作时间长于溶栓治疗。另外,吸栓治疗的尿激酶用量显著少于溶栓治疗,这也充分体现了吸栓的优势,有利于降低出血发生率。本研究中吸栓组无出血病例发生,而溶栓组的出血发生率为33.33%,且其中2例(8.33%)为严重的颅内出血和消化道出血。因此,对于术前就存在凝血功能障碍、出血疾病史的患者,机械性吸栓能够快速、高效地清除血栓,减少出血发生的风险,提高了围术期安全性。
3.6本研究结果显示,不管是吸栓治疗还是溶栓治疗,术后SpO2较术前均得到了显著提升,因此对于中高危APE的治疗,腔内介入手术是必要且有效的,这也与近期发表的国内外研究报道[21-22]一致。吸栓组SpO2改善情况较溶栓组更显著,分析原因可能为机械性吸栓血栓清除更彻底,肺动脉血流快速恢复。而导管碎栓及溶栓治疗,虽然可以将大块血栓捣碎并溶解,但是一些细小血栓会随着血流冲刷到肺动脉远端,引起肺动脉分支广泛堵塞,肺泡通气血流比值仍较差。
3.7机械性吸栓治疗APE的主要并发症有心律失常、肺血管损伤、肾功能损害等。其中心律失常是主要并发症,表现为窦性心动过缓或房室传导阻滞、室性心动过速等,发生率为10%~15%[23],其发生与血栓的位置、导管抽吸过久、导管的口径及患者反应强弱等有关[24]。本研究中,吸栓组的心律失常发生率为25.00%(3/12),高于溶栓组的12.50%。其中2例表现为窦性心动过缓(40次/min),经予暂停手术操作及注射阿托品抑制迷走神经反射后心率逐渐恢复;1例术中室性心动过速,停止操作后,心律逐渐转复。笔者的体会是,吸栓治疗与溶栓治疗相比,心律失常风险确实较高,除了上述的处理措施外,有效的预防措施还包括在吸栓操作前加大给氧流量;经置入导管缓慢注入硝酸甘油200~400 μg或罂粟碱30 mg(视血压情况,低于100/60 mmHg者慎用),以抑制抽吸导管高压喷射药物对血管壁造成的强烈刺激所引发的肺动脉痉挛和迷走神经过度兴奋。
3.8本组患者未见肺动脉夹层、破裂等肺血管损伤发生。笔者的经验是术中操作应轻柔、细致,选用8F以下合适导管,控制术中抽吸和喷射药物时间(均控制在5~10 s/次),整个手术尽量控制在20~30 min/次,以避免导管、导丝、长鞘长时间刺激右心室或肺动脉壁内牵张感受器,因此认为机械性血栓清除术是安全可控的。本研究吸栓组术后肾功能未见明显损害。因此,术前需做到充分的风险预估和有效的医患沟通,术中要求规范、细致的手术操作并快速抽吸血栓,以及术后有效足疗程抗凝和精心护理,这有助于进一步提高手术安全性和治疗成功率,改善患者预后。
综上所述,AngioJet机械性血栓抽吸治疗中高危APE具有较好的安全性和有效性,尤其对于有溶栓禁忌的患者具有显著减少出血的优势。对于高危APE患者,本法可作为首选初始治疗方法。但本研究结论尚需进一步加大样本量通过前瞻性研究加以验证。
