淫羊藿苷优化大鼠脂肪干细胞促进超长随意皮瓣存活的实验研究
2023-01-11梁至洁黄东琳朱丹丹易晓林蒋洪棉罗丽凤黎洪棉
梁至洁, 黄东琳, 朱丹丹, 易晓林, 宁 艳, 蒋洪棉, 罗丽凤, 黎洪棉
超长随意皮瓣移植是目前临床上修复急慢性深度创面,特别是重要组织器官外露创面的常用方法之一,其治疗效果通常取决于皮瓣存活率,而其存活率主要由术后早期的血供情况决定。供血不足引起组织坏死是皮瓣移植后的一种常见并发症[1],发生率可达10%~15%[2]。皮瓣坏死通常导致创面迁延不愈,进展为慢性创面或瘢痕形成,严重影响临床疗效。因此,如何改善血供、提高超长随意皮瓣存活率是临床上亟待解决的问题。随着干细胞辅助移植临床应用的推广,已有学者尝试应用脂肪来源干细胞(adipose-derived stem cells,ASCs)提高皮瓣的存活率并取得了良好的效果[3-4]。有研究认为,在促进皮瓣存活的过程中,ASCs的主要作用机制之一是促进了缺血组织血运重建[5-6]。本研究团队的前期研究表明ASCs有强大的旁分泌功能,能够分泌与血管生成相关的细胞因子,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板源性生长因子-BB(platelet-derived growth factor-BB,PDGF-BB)、胰岛素样生长因子-2(insulin-like growth factor-2,IGF-2)等[7-8]。目前已有研究发现,可以通过药物[9]、物理刺激[10-11]、生长因子[12]提高ASCs中血管生成因子的表达水平,进而提高其促进血运重建及再生修复的能力。淫羊藿苷(icariin,ICA)是一种天然类黄酮[13],具有促进骨代谢、调节内分泌、改善心脑血管等功能[14]。既往研究证实ICA可以优化干细胞的再生功能[15],其应用于人体的安全性也已被证实[16],可作为干细胞组织工程的候选佐剂。本研究旨在探讨ICA优化大鼠脂肪来源干细胞(rat adipose-derived stem cells,rASCs)促进大鼠超长随意皮瓣存活的作用及机制,为ICA优化ASCs辅助组织重建修复的临床应用提供更多依据。
1 材料与方法
1.1实验动物 选择6周龄雌性健康无特定病原体(specific-pathogen-free,SPF)级SD大鼠12只,体质量200~220 g,由广西医科大学动物实验中心提供。本研究获广西医科大学动物伦理委员会批准(批号:201912008)。
1.2主要材料 ICA(规格:≥98.0% 1 g,货号:I8760-1g),购自北京索莱宝科技有限公司。水合氯醛购自上海麦克林生化科技有限公司,二甲苯、中性树胶购自国药集团化学试剂有限公司。IgG-PE抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)偶联抗体、CD29-FITC、CD44-FITC、CD45-FITC购自美国BD Biosciences公司。VEGF一抗、成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)一抗、IGF-2一抗购自美国Affinity公司。PDGF-BB一抗、CD31一抗、HRP标记的山羊抗小鼠Ig二抗、免疫组化试剂盒(抗兔二抗)购自武汉赛维尔生物科技有限公司。甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗购自武汉三鹰生物技术有限公司。磷酸缓冲盐溶液(phosphate buffer saline,PBS)冻干粉、苯胺蓝染色液、马松(Masson)三色染色试剂盒购自北京索莱宝科技有限公司。苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒、增强化学发光底物(enhanced chemiluminescence,ECL)化学发光试剂购自北京碧云天生物试剂有限公司。
1.3主要仪器 低速台式离心机购自上海安亭科学仪器厂。台式高速冷冻离心机购自Dynamica公司。生物组织摊片机购自常州市中威医疗仪器有限公司。组织包埋机、生物组织脱水机购自湖北亚光公司。赛默飞轮转切片机购自英国珊顿公司。光学显微镜、倒置显微镜购自日本Olympus公司。垂直电泳槽/电泳仪、半干转膜槽购自北京六一仪器制造公司。凝胶成像系统分析仪购自英国Bio-rad公司。
1.4实验方法
1.4.1 rASCs的分离与培养 取3只大鼠,予15%水合氯醛腹腔内注射麻醉后行颈椎脱臼处死。仰卧位固定大鼠,酒精喷洒消毒后取腹股沟皮下脂肪垫,剔除血管筋膜后用PBS冲洗,剪切成碎片,放入胶原酶充分消化,将混合物倒至200目细胞滤网中吹打过筛,取滤过液进行离心,取下沉细胞即rASCs。将rASCs接种于含10%胎牛血清(fetal bovine serum,FBS)和1%青链双抗的DMEM培养基中,置于培养箱(条件设置:37 ℃、5% CO2)中培养,按1∶3比例传代。
1.4.2 rASCs的鉴定 使用Becton Dickinson FACSm Calibur流式细胞仪分析P3 rASCs。将细胞(1 ml,1×106cells/ml)与FITC孵育30 min。所使用表面标志物抗体包括:CD29-FITC、CD44-FITC、CD45-FITC和IgG-PE(阴性对照),室温黑暗条件下孵育30 min。使用Cell Quest Pro采集软件进行数据分析。为评估细胞分化能力,将P3 rASCs分别在成脂、成骨或成软骨培养基中培养2~3周,然后分别进行油红O染色、茜素红S染色和甲苯胺蓝染色,显微镜下观察染色结果并拍照。
1.4.3 ICA对rASCs的干预及相关因子检测 将rASCs种植于12孔板中培养,密度为2×104cells/孔,加入不同浓度的ICA(0、0.1、1、10 μM),继续培养24 h后收集细胞。提取细胞总蛋白并进行蛋白免疫印迹(Western blot,WB)实验,分析VEGF、PDGF-BB、FGF-2及IGF-2的蛋白表达水平。利用Image lab软件进行图像分析,以GAPDH蛋白为内参计算目标蛋白的相对表达量。
1.4.4 ICA预处理rASCs对超长随意皮瓣血管化及存活的影响观察 选择大鼠9只,适应性喂养1周后将其随机分为空白对照组、rASCs组和ICA+rASCs组,每组3只。大鼠麻醉后于背部设计8 cm×2 cm皮瓣,去毛,切开皮肤、皮下组织、筋膜,在肌膜浅面剥离,掀起皮瓣。根据分组在皮瓣蒂部注射相应细胞悬液:rASCs组予未处理的rASCs;ICA+rASCs组予1 μM ICA预处理的rASCs;空白对照组予等体积PBS。rASCs组和ICA+rASCs组注射的细胞浓度为1×107cells/ml。3个部位注射相隔0.5 cm,每个注射点注射50 μl,丝线缝合皮瓣。在治疗后7、14、28 d拍摄各组皮瓣存活情况,通过肉眼观察大鼠背部皮瓣各分区大体存活情况,具体包括皮瓣颜色、质地、组织弹性、毛发生长情况以及是否发生坏死[17]。对于皮瓣坏死的判定,本研究采用如下标准[18]:皮瓣色泽发黑,质地僵硬,组织皱缩,弹性差,且切割组织后无出血。用笔描绘皮瓣的存活和坏死区域,通过Image J软件测量皮瓣存活面积及总面积。皮瓣存活情况以皮瓣存活面积比来评估,皮瓣存活面积比=(皮瓣存活表面积/皮瓣总表面积)×100%。治疗后28 d将大鼠处死后取其皮瓣进行后续组织学实验。皮瓣标本切片进行常规HE染色[19],在显微镜下观察皮瓣组织形态并拍照。
1.4.5 皮瓣组织的胶原含量计算及微血管密度(mean blood vessel density,MVD)计数 皮瓣组织石蜡切片脱蜡复水后使用Masson丽春红酸性复红染液复染,苯胺蓝显色。在显微镜下进行观察,每组皮瓣切片在100倍镜下随机挑选3个视野拍照。Image J软件分析蓝染面积比例,取均值,计为皮瓣组织的胶原含量。行CD31的免疫组化染色,镜下观察管样形状,以棕色为阳性染色。每组取3张切片,100倍镜下对每张切片随机挑选3个视野,计数CD31阳性血管,取均值,计为皮瓣组织的MVD。
1.4.6 皮瓣组织中血管生成因子的蛋白表达水平检测 从各组部分皮瓣组织中提取组织蛋白,通过WB实验检测组织中VEGF、PDGF-BB、FGF-2及IGF-2的蛋白表达水平。利用Image lab软件进行图像分析,以GAPDH蛋白为内参计算目标蛋白的相对表达量。

2 结果
2.1原代rASCs形态 显微镜下可见大部分rASCs
贴壁生长,状态良好,细胞呈长梭形或多边形,符合间充质干细胞的经典形态。培养6 d后,大量细胞增殖成团生长。见图1。

ⓐ培养48 h(×100);ⓑ培养48 h(×200);ⓒASCs培养48 h后的细胞形态(×400);ⓓ培养6 d(×100);ⓔ培养6 d(×200);ⓕ培养6 d(×400)图1 原代rASCs形态图
2.2rASCs成脂、成骨、成软骨分化能力鉴定及表面标志物表达情况 成脂诱导14 d后,细胞形态发生明显变化,细胞变圆,胞内充满大量脂肪滴,细胞核被挤压到边缘。油红O染色显示细胞内脂肪细胞液滴呈红色,符合脂肪细胞特征(图2ⓐ)。成骨诱导14 d后,细胞由梭形向多边形、不规则形态转变,呈多层生长,细胞表面钙盐沉积,经茜素红染色,显微镜下可见橙色钙沉积结节(图2ⓑ)。在软骨形成诱导21 d后,细胞呈多边形或准圆形,局部形成多个结节状结构。甲苯胺蓝染色后,软骨结节状结构被染成蓝色(图2ⓒ)。流式细胞分析结果显示rASCs中CD29、CD44呈高表达,CD45为低表达(图2ⓓ~ⓕ)。
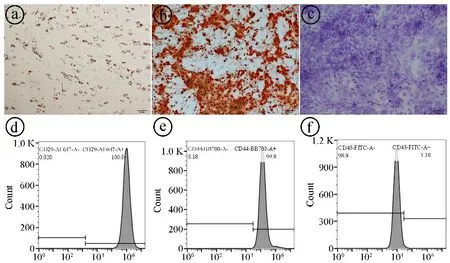
ⓐ成脂诱导,油红O染色,脂滴染红(×100);ⓑ成骨诱导,茜素红染色,钙化结节呈橙红色(×100);ⓒ软骨形成诱导,甲苯胺蓝染色,结节软骨结构呈蓝色(×100);ⓓ~ⓕrASCs表面标志物鉴定的流式细胞学实验结果图2 诱导rASCs多分化结果图
2.3不同浓度ICA预处理rASCs血管生成相关因子蛋白表达水平的情况 WB结果显示,rASCs中VEGF、PDGF-BB、FGF-2、IGF-2的蛋白表达水平随ICA浓度的增加而上升,呈现浓度依赖关系。见图3。
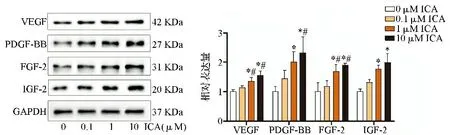
与0 μM组比较,*P<0.05;与1 μM组比较,#P<0.05图3 四组rASCs血管生成相关因子蛋白表达水平比较的WB实验结果图
2.4ICA预处理对rASCs促进超长随意皮瓣存活的影响 在治疗后7 d、14 d,rASCs组和ICA+rASCs组的皮瓣存活面积比均显著高于空白对照组(P<0.05)。在治疗后28 d,ICA+rASCs组的皮瓣存活面积比显著高于空白对照组(P<0.05),但rASCs组与空白对照组比较差异无统计学意义(P>0.05)。见表1,图4。
表1 三组大鼠超长随意皮瓣存活情况比较 [皮瓣存活面积比,
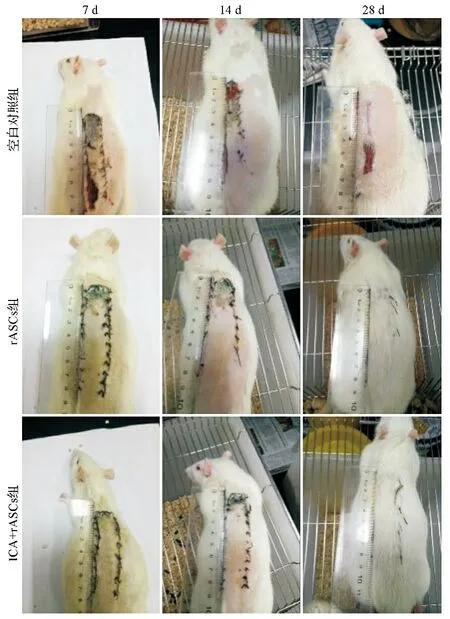
图4 三组大鼠皮瓣存活情况大体图
2.5三组皮瓣组织学检测结果 HE染色及马松染色结果显示,空白对照组的真皮层胶原纤维排列紊乱、稀疏,恢复效果不佳。rASCs组及ICA+rASCs组皮瓣组织中的纤维数量增加,且与空白对照组相比排列更为紧密、整齐有序。见图5。
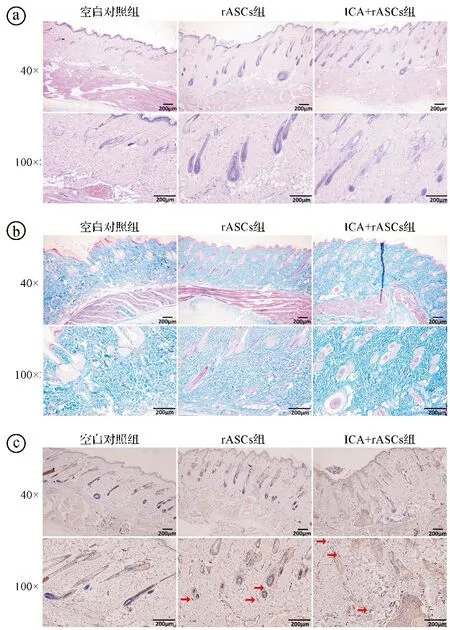
ⓐHE染色;ⓑ马松染色;ⓒCD31免疫组化染色,微血管为红色箭头所指棕色管样形状图5 三组皮瓣组织学检测结果图
2.6三组皮瓣组织胶原含量和MVD比较 三组皮瓣组织的胶原含量和MVD比较差异有统计学意义(F=16.179,P=0.004;F=20.816,P=0.002)。rASCs组及ICA+rASCs组的胶原含量和MVD显著高于空白对照组(P<0.05),且ICA+rASCs组水平较rASCs组更高,差异有统计学意义(P<0.05)。见图6。
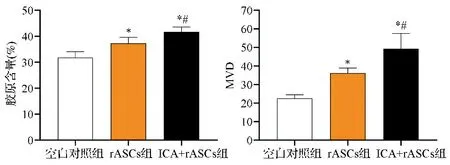
与空白对照组相比,*P<0.05;与rASCs组相比,#P<0.05图6 三组皮瓣组织胶原含量和MVD比较图
2.7三组皮瓣组织血管生成相关因子表达水平比较
WB结果显示,rASCs组和ICA+rASCs组的VEGF、PDGF-BB和FGF-2蛋白表达水平均显著高于空白对照组(P<0.05),且ICA+rASCs组的VEGF、PDGF-BB蛋白表达水平较rASCs组更高,差异有统计学意义(P<0.05)。ICA+rASCs组IGF-2的蛋白表达水平高于空白对照组,差异有统计学意义(P<0.05)。见图7。
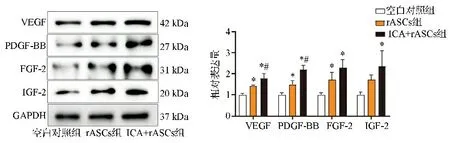
与空白对照组相比,*P<0.05;与rASCs组相比,#P<0.05图7 三组皮瓣组织血管生成相关因子表达水平比较的WB实验结果图
3 讨论
3.1皮瓣的存活取决于术后早期的血供。术后血管栓塞、血管痉挛等因素可引起局部缺血,不利于皮瓣存活。皮瓣缺血性坏死是血管破裂后血管痉挛和循环阻塞导致血流减少的主要后果。目前,提高皮瓣存活率的方法包括术后经验性使用抗痉挛药物和物理治疗,从而缓解血管痉挛,改善血流[20]。然而,由于移植物与周围组织的早期血管生成是降低坏死率的关键,重建微循环对皮瓣的长期存活更为重要。因此,许多学者致力于探索血管生成的机制,并开发候选优化方法来改善再生组织的血管生成。
3.2血管生成是一个复杂的调控过程,涉及内皮细胞增殖、激活、迁移、侵袭,以及基底膜形成和新生血管形成等多种生物学机制。ASCs具有多向分化潜力、获取方便、来源丰富、免疫原性低、生物学性能稳定等优点,是组织工程理想的种子细胞,在临床中广泛应用于血管形成、神经损伤修复、骨和软骨再生重建等方面。近年来,ASCs已被逐渐应用于辅助皮瓣移植治疗并取得良好效果。有研究证实,使用ASCs辅助大鼠皮瓣移植能够显著提高皮瓣毛细血管的密度,促进缺血性损伤的恢复[3,21]。Pak等[22]也发现ASCs能够通过促进组织中血管生成提高皮瓣存活率。本研究发现,与空白对照组相比,使用rASCs注射于大鼠超长随意皮瓣蒂部能够显著改善皮瓣的存活情况,而且,皮瓣中MVD、胶原含量、血管生成相关因子水平显著提高,说明rASCs可能通过提高皮瓣血运重建促进皮瓣存活并提高皮瓣的质量,这与既往的研究结果相符。
3.3ASCs能够分泌多种血管生成因子,包括VEGF、PDGF-BB、IGF-2、FGF-2等[23-25],这些因子已被证实在血管重建中发挥关键作用。虽然ASCs也被发现能够在体内分化成血管内皮细胞[26],但Yuan等[27]的实验发现,大部分移植的ASCs进入活体后很快就会死亡,故推断ASCs在活体内的促组织再生功能主要依赖于其旁分泌功能。本课题组的既往研究表明,通过药物(如人参皂苷Rg1)[7]或自体来源生物材料[如富血小板血浆(platelet-rich plasma,PRP)/富血小板纤维蛋白(platelet-rich fibrin,PRF)等][8]均能够提高ASCs中血管生成相关旁分泌因子的表达水平,进而提高ASCs促进移植物血运建立的能力,提高移植物的存活率。目前已有许多学者报道了优化ASCs生物功能的多种方法[28-29],其中一些优化方法已被应用于临床实践,并取得了良好的疗效[30]。本研究发现使用一定浓度的ICA(1~10 μM)预处理rASCs能够显著提高细胞中血管生成因子VEGF、PDGF-BB、FGF-2、IGF-2的表达水平。VEGF及PDGF可促进血管内皮细胞生长,调节内皮细胞的活动,诱导血管新生[31-32]。FGF及IGF则可与VEGF产生协同效应,促进血管新生[33-34],为缺血性组织修复创造良好的条件,说明ICA可能是优化ASCs促进组织再生修复的潜在佐剂。进一步的动物实验证实,在皮瓣术后第7、14及28天,ICA+rASCs组的皮瓣存活面积比分别为(71.56±6.24)%、(79.17±7.88)%及(84.59±4.89)%,而rASCs组的皮瓣存活率则分别为(71.98±8.71)%、(76.07±8.50)%及(68.73±9.75)%,提示ICA预处理能进一步优化rASCs促进大鼠超长随意皮瓣存活的功能。此外,组织学结果显示ICA+rASCs组的皮瓣组织中胶原含量和MVD显著高于rASCs组;WB实验结果也显示,ICA+rASCs组皮瓣组织中的VEGF和PDGF-BB表达水平较rASCs组显著升高,表明ICA+rASCs组大鼠皮瓣血管重建过程较rASCs组更为活跃,而该组的皮瓣组织修复效果也更好。
综上所述,ICA不仅能够提高rASCs促进大鼠超长随意皮瓣的存活,同时还能促进皮瓣组织中胶原的重塑,提高皮瓣的质量,这可能与ICA能够上调ASCs血管生成相关旁分泌因子的表达水平,并能提高rASCs在组织中的促血管生成能力有关。
