帕金森病步态障碍的诊断与治疗研究进展
2023-01-11汤宏茵廖香连李桂花徐评议
汤宏茵, 廖香连, 张 芮, 李桂花, 徐评议
帕金森病(Parkinson′s disease,PD)是中老年常见的神经系统变性疾病,姿势步态障碍(postural instability and gait disorder dominant,PIGD)是其主要症状之一,在疾病早期即可出现[1]。随疾病进展,步态变异性也会增加,至中晚期则会进展表现为冻结步态(freezing of gait,FOG)、慌张步态[2]。FOG在晚期PD中非常常见,在H-Y(Hoehn and Yahr Scale)分级为4级的患者中其发病率>90%[3]。随着疾病进展,PD患者的PIGD更为严重,会增加跌倒、骨折甚至死亡的风险[4],故需要定期评估并加以干预[5]。本文就不同评估工具及方法的特点、优缺点等进行综述,同时探讨针对PD患者步态障碍的治疗现状。
1 步态障碍的诊断与评估
1.1步态障碍发生机制 在正常情况下,实现步态的发生主要涉及三个过程:周围感观信息的整合过程、步态自动化过程及认知过程[6]。首先,步态自动化过程主要依赖于皮质下结构,包括基底神经节和脑干,PD患者黑质致密部的多巴胺能(dopaminergic,DA)神经元的损伤投射到基底神经节核,使丘脑和脑桥核抑制增加,大脑皮质运动结构兴奋性降低[7],影响步态自动化过程,从而引起PD患者步态改变,如双手摆动幅度减少、步伐细小、步速变慢等。早期PD患者PIGD的原因多由于黑质致密部的DA神经元丢失,导致基底节运动功能异常,从而使步态自动化过程出现障碍。其次,PD患者可伴有丘脑皮质系统、基底神经节核及大脑皮质的不同程度受损,可致PD患者注意力下降、感觉-运动整合过程障碍,导致通过主动运动进行代偿控制步态能力下降,增加步态的变异性[8]。随着病情进展,PD患者的信息整合过程、认知过程开始逐渐减弱,基底节区功能进一步衰退,从而加重PIGD。再者,部分研究表示情感状态也是影响PIGD的原因之一。张婷婷等[9]研究得出H-Y分期与患者的抑郁得分呈显著正相关。Avanzino等[10]指出PD患者PIGD可因情绪状态的不同而表现不同,抑郁状态会影响持续性步态障碍,而焦虑状态则影响阵发性步态障碍。沈柏等[11]通过静息态功能磁共振成像研究,发现在不同类型的PD患者中,基于丘脑底核的功能连接差异的脑区与认知和情绪调控有关。
1.2步态障碍的分型 目前关于PD的PIGD尚无统一分类,临床上常有几种分型方式。根据H-Y分期可将PIGD初步分为早、中、晚期[12]。早期PD患者可出现步速变慢、步幅变小、摆臂幅度降低及双侧肢体不对称性、步态变异性增加。中期PD患者双侧肢体均可出现症状,运动变得更加迟缓,双下肢支撑相增加,手臂摆动的幅度进一步减少。同时伴有姿势的异常改变,如身体前倾姿势。通过干扰步态运动学可导致步态异常进一步加重,出现FOG和慌张步态。FOG的表现是,尽管有前行的意愿,但是迈步的动作短暂性、发作性的缺失或明显减少,患者常描述为双脚如同粘在地面上,难以启动。慌张步态则较为典型,表现为行走时躯干前倾、步伐细小、双足擦地、起步及止步均困难、双上肢协同摆动减少。晚期患者步态障碍加重,运动功能障碍(如FOG)变得频繁,伴随着平衡和姿势控制能力下降,具有严重的跌倒风险,需借助辅助设备(如轮椅)活动,甚至无法独立完成日常生活需要。根据统一帕金森评估量表(Unified Parkinson′s Disease Rating Scale,UPDRS)相关评分,通过计算震颤部分得分的平均值除以姿势步态部分得分的平均值来判断有无PIGD。当平均值≤0.90时患者为PIGD型,当平均值>0.90时患者为非PIGD型[13]。Giladi等[14]将PD的PIGD分为连续性步态障碍和阵发性步态障碍。连续性步态障碍由步频、步速、变异性、不对称性和姿势控制组成[15],而阵发性步态障碍主要包括慌张步态和FOG。近年来,神经影像在PD不同运动障碍亚型的研究越来越受到关注,但直接用于步态障碍的分型却仍然较少提及。
1.3步态障碍定性评估 定性评估主要是指观察性步态评估,其主要依赖于医师临床工作的观察和总结,通过询问患者病史、神经系统专科查体和结合步态观察,分析患者异常步态特征,从而得出相关定性及定位诊断。相对于定量评估,定性评估不需要昂贵的设备,评估过程快速方便。不可否认的是,该方法虽然简便,可操作性强,但其结果与观察者临床经验和技术水平有直接关系,具有一定主观性,且步态评估的内容也较单一,信息量有限,无法评估疾病的严重程度[16]。对于早期的步态异常,难以识别。对于较为明显或者处于中晚期阶段的PIGD患者,亦错过了早期干预、早期治疗的机会。
1.4步态障碍相关量表评估 普适性步态评估工具主要用于测评PD患者的平衡能力、运动功能、步态姿势等,相关量表包括Berg平衡量表(Berg Balance Scale,BBS)、起立-行走计时(Timed Up and Go,TUG)测试、H-Y分级量表等。针对FOG有特异性评估工具,主要用于评估PD患者FOG的发生情况、严重性等,特异性较强,如冻结步态问卷(Freezing of Gait Questionnaire,FOG-Q)、新版冻结步态问卷(New Freezing of Gait Questionnaire,NFOG-Q)、UPDRS。相关量表的评价方法、临床意义及其局限性见表1。还有一些表中未提及的试验,例如后拉试验(pull test)——UPDRS量表的组成部分,是PD患者病情严重程度的重要指标,也是评定患者稳定功能的方法之一。量表评估是临床医师通过对患者行为动作的观察而进行的主观测评,不需要精密的设备,临床可操作性强,可以提供步态障碍的相关信息。其局限性在于容易受患者的依从性、情绪及周围环境的影响,使评估的准确性和客观性受到限制,且没有评估步态模式的空间和时间方面的协调性,难以捕捉到细微运动[17]。
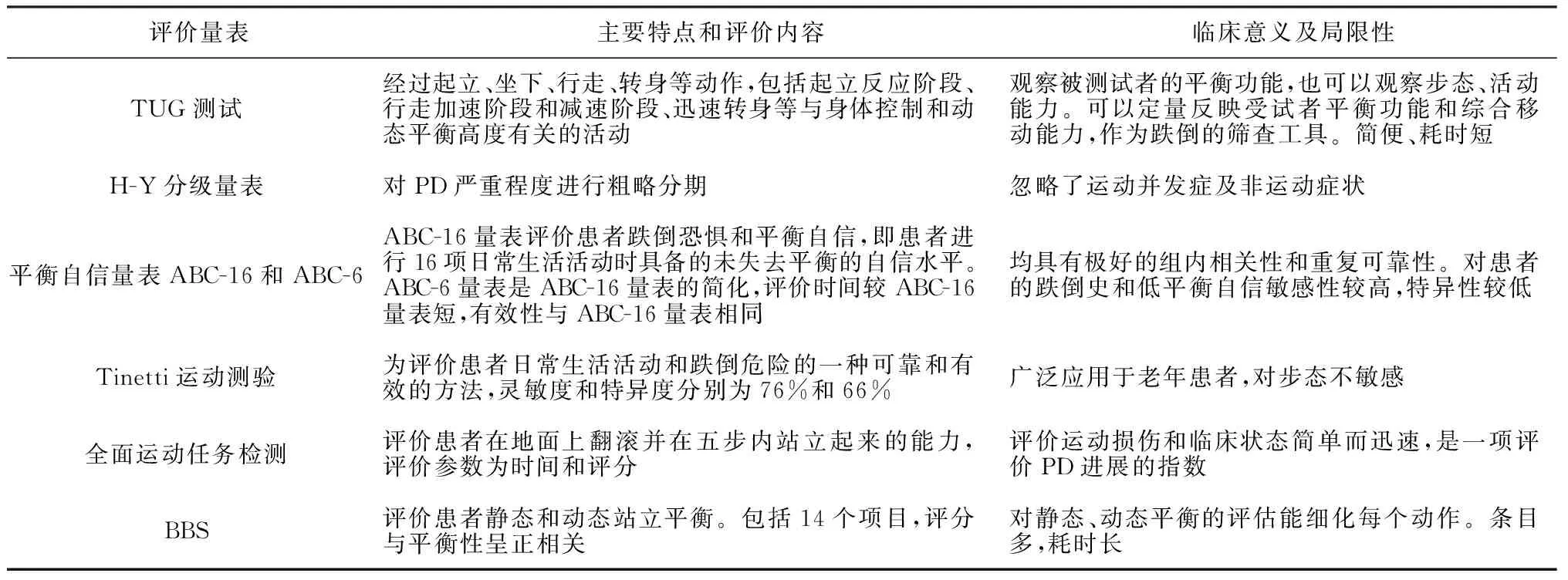
表1 PD患者PIGD量表评估方法
1.5步态障碍智能设备评估 随着国人对健康的重视以及科学技术的不断成熟,智能设备在疾病监测中被广泛应用。智能设备包括智能手机、步态分析仪、可穿戴设备、AI智能等,都在大力发展用于评估PD患者的PIGD。常用的步态分析仪主要分为光学运动捕捉技术和三维步态分析系统,通过定量检测与评估早期PD患者的PIGD。患者以自如的速度在放置感应装置的过道反复行走,检测患者的步速、周期、步幅、单支撑相、双支撑相、步宽等[18]。另外患者可随身佩戴便携式传感器来记录步态数据,记录患者日常的步态特征,目前已有研究在尝试通过便携式传感器来建立PD患者FOG的预测模型[19]。与其相似的是智能手机,有研究通过智能手机软件来捕捉早期PD患者的步态参数,并评估患者的步态与平衡功能,同时加强患者对PD的认识,但目前仍需要对程序进一步完善,并增加试验数据[20]。比较热门的还有利用AI辅助下的可穿戴设备[21],通过AI技术来模拟现实中不同场景,让患者在不同状态下行走,基于深度视觉感知和运动捕获技术,在受试者执行指令动作过程中,对受试者的全身三维姿态与动作进行电子化还原与记录,通过AI深度学习算法定量分析人体运动学特征和参数,对患者PIGD进行客观数据的收集和分析。干静等[22]对PD患者使用可穿戴设备的临床研究发现,PD早期步态损害仅仅体现在节奏时相相关不对称性,并无明显的步态障碍特征,而明显的步态受损往往从H-Y分级2级才开始出现。对于监测FOG中也已被证实具有一定敏感性和特异性。Tripoliti等[23]使用6个加速度计和2个陀螺仪的运动传感设备自动化监测FOG,其准确性可提高至96.11%。Naghavi等[24]研究表示可穿戴设备不仅对于FOG的监测具有较高的准确性,而且可以预测FOG的发生。可穿戴设备步态分析技术可以量化临床检查无法检测到的细微步态特征。就其定量性质和精确度而言,可穿戴设备步态评估方法的优势是毋庸置疑的[25]。其局限性在于PD患者需要长时间佩戴传感器设备,因此要求可穿戴设备功耗低、续航时间长、穿戴简便等。此外,长时间的佩戴可能会引起患者不舒适感[18]。
2 步态障碍的治疗
2.1药物治疗 临床上常根据FOG对左旋多巴(L-DA)治疗的反应,将FOG分为“关期”FOG、“开期”FOG。因此也需根据不同情况制定相应服药方案。较为常见的是“关期”FOG。“关期”FOG经常出现在PD进展期以及低DA期,可通过延长“开期”、缩短“关期”,从而减少FOG发生的频率及时长。此时L-DA为“关期”FOG治疗的一线用药[26]。有研究发现,规律服用1年司来吉兰后,FOG改善情况较L-DA组明显。研究对比雷沙吉兰与恩他卡朋治疗晚期PD患者FOG严重程度的改善情况,结果发现雷沙吉兰对晚期PD患者FOG严重程度的改善更明显[27]。其他抗帕金森药物如金刚烷胺、DA受体激动剂等药物治疗FOG的疗效仍然存在争议,需进一步试验研究。部分抗抑郁药如艾司西酞普兰对步态障碍有改善,这可能与中脑边缘系统通路及5-羟色胺能神经递质有关[28]。疾病修饰治疗是一种改变自然病程的干预措施,可以影响神经元变性的诱发因素,并促使神经元代偿反应或延缓病理进展[29]。PD的发病机制常与α-突触核蛋白(α-synuclein,α-Syn)、LRRK2基因、线粒体功能障碍等相关。目前,基因修饰已然成为治疗的热点,也是治疗新思路。Anle138b是抑制α-Syn聚集的新型寡聚体调节剂[30],其动物实验显示具有阻止PD模型小鼠DA神经元死亡,并改善步态障碍的疗效[31]。胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂可通过减少神经炎症和α-Syn聚集发挥神经保护作用[32]。艾塞那肽是较为常用的GLP-1受体激动剂,一项Ⅱ期临床试验表示经该药(2 mg/周)治疗48周的PD患者“关期”UPDRS运动评分更低,且停药12周后组间仍有差异[33]。尽管目前涌现出大量潜在的疾病修饰治疗药物,但仍需要经过大量临床试验加以支持。
2.2重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)治疗 rTMS技术已广泛应用在临床中实现对神经、精神类疾病的治疗,是一种安全、简便、副作用小及适应证较广的神经调控治疗新方法。近年来越来越多的研究将其应用于PD的辅助、康复治疗[34]。国外相关研究中,Kim等[35]应用频率为10 Hz的rTMS,以优势半球的小腿初级运动皮质为靶点,结果显示,与假性刺激相比,rTMS治疗的步态异常有显著改善。Mi等[36]研究发现,在以10 Hz高频rTMS辅助运动区部位的刺激条件下,FOG问卷评分和UPDRS第三部分均有显著改善。近年来,也有研究评估低频rTMS对PD患者FOG的治疗效果。Khedr等[37]比较了20 Hz与1 Hz的rTMS对PD患者步态的治疗效果,结果发现两组受试者的运动评分量表均有显著改善。但低频刺激改善效果弱于高频刺激。对于PD患者PIGD的治疗,其有争议点在于rTMS刺激的频率、靶点、治疗时长、疗程等治疗参数的选择暂无固定,针对不同症状,是否需要不同靶点及频率尚未明确。另外,经颅直流电刺激(transcranial direct current stimulation,tDCS)启动的rTMS也在临床上被用于治疗PD的运动功能障碍。von Papen等[38]研究经tDCS预处理后对PD患者给予1 Hz rTMS治疗并观察对步态障碍的改善情况,结果表明PD患者运动减退步态双侧均有改善。Wong等[39]表明,tDCS治疗对于PD患者,无论是初级运动皮层M1区、背外侧前额叶皮层(dorsal lateral prefrontal cortex,DLPFC)还是小脑靶点均对步态障碍有所改善,而DLPFC上的tDCS增加了皮层抑制,对改善PD患者的任务行走发挥了最有益的作用。
2.3手术治疗 目前手术治疗主要包括神经核毁损术和脑深部电极置入术(deep brain stimulation,DBS)。DBS是通过在PD患者脑部植入电刺激器,在电场作用下刺激脑部基底核区域,缓解运动障碍等症状,同时配合药物治疗减少用量及副作用,达到长期治疗的目的,现广泛用于药物难治性中晚期PD患者的治疗[40]。丘脑底核(subthalamic nucleus,STN)是DBS的重要靶点。研究显示,STN的低频刺激(low frequency stimulation,LFS)可能使患者术后出现震颤、僵硬和运动迟缓,症状的严重程度往往超过了为治疗FOG的最初效益[41]。近年亦出现脚桥核(pedunculopontine nucleus,PPN)-DBS,但治疗行单侧或是双侧、高频或是低频尚不明确,需要进一步临床研究[42]。由此可见,DBS在PD患者中的PIGD治疗中存在局限性,仍需更多证据验证疗效。脊髓电刺激术(spinal cord stimulation,SCS)作为治疗PIGD的新方法,Samotus等[43]研究表示,经SCS术后6个月,PD患者的步长、步速增加,FOG发作频率减少,FOG问卷评分降低。SCS技术目前尚未得出统一有效的刺激方案[44],对药物疗效不佳及患者无法植入DBS时的FOG,或DBS仍难以控制的FOG,可考虑该方法。
2.4康复治疗 康复治疗是在药物治疗的基础上,加强自我管理和参与,最大限度地延缓PIGD进展,提高功能独立性和整体适应性,尽可能减少各种并发症和危险的发生。目前康复运动训练包括放松训练、肌力训练、姿势训练、平衡训练、步态训练、运动策略等[45]。Giardini等[46]研究表示仅通过平衡训练康复可改善PD患者的运动能力。研究显示,无论是常规康复,包括主动和被动关节活动训练、步态训练等,还是下肢康复训练,如自行车脚踏循环运动方式,均有效改善PD患者运动功能,但联合下肢康复训练改善效果尤为显著[47-49]。PD患者PIGD表现形式各不相同,一个患者可能合并多种步态参数的变异,这要求临床医师遵循个体化和针对性原则,对每位PD患者制定适当强度的训练方案。
2.5其他治疗 孟茜等[50]对有PIGD的PD患者行绿色激光线辅助行走的视觉干预训练以及听觉干预训练,发现听视觉干预训练对PD患者的FOG、PD严重程度及生活质量起到了有效的改善作用,且便携式激光器可置于拐杖内、其他助行器上或直接佩戴于受试者身上,携带方便。Feng等[51]以虚拟现实(virtual reality,VR)康复技术与传统康复方法相比,结果显示,VR技术提高了PD患者的BBS、TUG测试、UPDRS3和功能性步态评价(functional gait assessment,FGA)评分。
3 总结与展望
PIGD是PD主要症状之一,早期识别与早期干预十分重要。PIGD的严重程度可影响患者的生活质量,所以其可作为PD发展的监测指标之一。然而PIGD在早期症状并不明显,需要临床医师经验、量表甚至可穿戴设备的评估及分析加以识别。在早期诊断后需及时给予相应药物治疗、物理治疗以及康复训练等治疗手段,改善PD患者临床症状及生活质量。除了PD的运动症状需要治疗,亦不可忽视该疾病所带来的非运动症状,如便秘、疼痛、睡眠障碍、焦虑抑郁等。这些非运动症状对于PD患者PIGD可能均有一定的影响。此外,PD患者步态障碍的发生机制、评价方法及有效治疗手段仍有待进一步的研究,不同的评价方法均有其优缺点,不少治疗手段也依然存在争议,如何选择评价方法以及治疗方案,需要因人而异,因症而异。
