大肠杆菌脂多糖体外诱导羔羊外周血单个核细胞炎症模型的建立
2023-01-11郭洪冉王志超杨雨鑫
董 宁,郭洪冉,王志超,杨雨鑫
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
大肠杆菌学名是大肠埃希氏菌(Escherichiacoli,E.coli),是革兰氏阴性菌中最为熟知的菌种,尽管在健康的肠道中低丰度,却在动物肠道内普遍存在。大多数大肠杆菌菌株不会造成疾病,但是感染致病性大肠杆菌则会导致腹泻、出血性肠炎,严重的时候会造成组织坏死和肠道穿孔,进而引发溶血性尿毒症综合征、腹膜炎、革兰氏阴性肺炎和败血症等疾病[1]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁中的主要成分,是一种可以引起机体免疫细胞炎症反应的内毒素,在大肠杆菌感染性疾病中起到重要的调节作用。LPS可以与细胞膜表面Toll样受体(Toll like receptor,TLR)结合,通过NF-κB和MAP激酶相关信号通路途径,诱导多种促炎症因子(IL-1、IL-6和TNF-α等)的表达和分泌,引起炎症反应,清除病原体[2]。
在动物营养免疫学中,研究者通常采用LPS构建动物体内和体外急性应激模型来研究动物机体免疫功能,检测药物或天然植物提取物质的抗炎症治疗效果。通过腹腔或静脉注射LPS溶液构建小鼠全身炎症模型可以有效地研究药物对败血症[3]、过敏性肺部损伤[4]、感染性急性肾衰竭[5]以及类风湿性关节炎[6]等伴随着机体炎症疾病的治疗效果。LPS在体外细胞炎症模型建立试验中应用也十分广泛。Soares等[7]使用LPS构建体外牙髓细胞炎症模型探讨辛伐他汀与纳米纤维聚l-乳酸复合支架对牙髓细胞(DPCs)的抗炎、牙源性和促血管生成作用。Zhao等[8]采用LPS构建体外RAW264.7巨噬细胞炎症模型探究鸡腿菇和羊肚菌发酵液中总黄酮的抗炎作用。申静[9]采用LPS构建鸡外周血单个核细胞探究蛋氨酸和叶酸对炎性细胞因子转录表观遗传机制的调控作用。
外周血单个核细胞由于来源简单易行,含有单核细胞和淋巴细胞多种免疫细胞,是一类重要的免疫细胞,担负着炎症介导和病原体清楚的重要工作,因此被广泛应用于疾病治疗方面的研究。陈瀚文[10]研究表明,外周血单个核细胞中的miRNA可以作为验证性肠病诊断和活动度监测的生物标记物。蒋俊艳等[11]通过研究炎症性肠病患者外周血单个核细胞LncRNA表达谱,发现明显上调与炎症指标、病情活动度密切相关的表达物,有助于炎症性肠病的早期诊断。在槲皮素抗炎效果[12]、壳寡糖抗氧化应激[13]、多种中草药对免疫细胞的增殖[14]等研究中,外周血单个核细胞构建的体外模型发挥着重要的作用。
本试验探究了不同作用时间和浓度的大肠杆菌LPS溶液对羔羊外周血单个核细胞活力和炎症因子表达量的影响,筛选出最适的LPS作用浓度和时间建立体外羔羊外周血单个核细胞炎症模型,为后续天然植物型饲料抗炎症效果的探究奠定细胞试验基础。
1 材料与方法
1.1 试剂与主要溶液配制
脂多糖、羊外周血单个核细胞分离试剂盒、RPMI 1640培养基、10×PBS、100×青霉素链霉素混合液、标准胎牛血清、0.4%台盼蓝染色液、Trizol细胞裂解液(Solarbio,中国北京);MTT细胞增殖及细胞毒性检测试剂盒(碧云天,中国上海);反转录试剂盒(艾科瑞生物,中国湖南);荧光定量PCR预混Mix(全式金,中国北京)。
1×PBS:用高温灭菌后的超纯水将10×PBS稀释10倍,每100 mL的PBS加入1 mL的100×青霉素链霉素混合液,4 ℃封口备用。
LPS处理液:用1×PBS将LPS配制成1 mg/mL的母液,于-20 ℃分装保存。用不加胎牛血清的RPMI 1640培养基将LPS母液稀释为不同浓度的处理液,用于后续试验。
RPMI 1640完全培养基:向90 mL的RPMI 1640培养基中加入10 mL胎牛血清,配制含10%FBS的RPMI 1640完全培养基,4 ℃封口备用。
1.2 细胞分离及培养
1.2.1 细胞来源 试验选取5只常规方法饲养的6~8月龄健康陕北白绒山羊,静脉采血置于肝素抗凝采血管中,并于采血后1~2 h内带回实验室细胞间进行绒山羊外周血单个核细胞分离试验。
1.2.2 细胞分离方法 用等体积的全血及组织稀释液稀释抗凝血,用移液枪轻柔吹打混匀得到稀释全血;向15 mL离心管中加入5 mL绒山羊外周血单个核细胞分离液,取等体积的稀释全血加于分离液面上,保持分离液和稀释全血之间界限分明,两者总体积不超过离心管体积的1/3;2 500 r/min室温水平离心25 min,液体出现明显的分层,吸取云雾状外周血单个核细胞层的细胞(不超过2 mL)于高温灭菌的10 mL离心管中,加入5 mL细胞洗涤液,轻柔吹打混匀,1 200 r/min室温水平离心10 min;弃上清液,保留细胞沉淀,再向离心管中加入5 mL的细胞洗涤液,轻柔吹散细胞沉淀,1 200 r/min室温水平离心7 min;弃上清液,加入1 mL的RPMI完全培养基重悬细胞沉淀,0.4%台盼蓝染液染色后,用牛鲍计数板计数,计算细胞悬液密度,调整密度为5×106个/mL,用于后续培养及试验。
1.3 MTT检测脂多糖对PBMC活力的影响
将刚分离出来的外周血单个核细胞悬液调整密度为1×106个/mL,向96孔细胞培养板每孔加入100 μL细胞悬液,最外围一圈培养孔用PBS填充,37 ℃、5%CO2培养25 h,在终止培养前3 h、6 h、12 h每孔加入20 μL不同浓度的LPS处理液,使得LPS在培养基中的终浓度为0、0.016、0.08、0.2、0.4、1、2、4、6、8、10、50 μg/mL,每个浓度设置5个复孔,2个空白对照孔(将100 μL细胞悬液换为不添加血清的RPMI 1640培养基)。终止培养后每孔加入10 μL MTT溶液,37 ℃、5%CO2孵育4 h,之后每孔加入Formazan溶解液100 μL继续在培养箱中孵育3 h,在光学显微镜下观察紫色结晶全部溶解后,用酶标仪在570 nm波长下测定吸光度值。
1.4 荧光定量PCR检测炎症因子
将密度为5×106个/mL的羊外周血单个核细胞悬液接种于6孔板中,每孔1.6 个/mL,37 ℃、5%CO2培养26 h,在终止培养前3 h、6 h、12 h、24 h分别向每孔加入0.4 mL不同浓度的LPS处理液(终浓度为0、0.4、1、2、4、6、8、10 μg/mL),每个处理设置6个重复。结束培养后1 000 r/min收集细胞,采用Trizol法提取细胞总RNA,使用核酸定量仪检测RNA质量和浓度,每个样本吸取含量为1 μg的RNA溶解液按照反转录试剂盒说明书进行反转录,采用20 μL的荧光定量PCR反应体系:cDNA模板1.5 μL、上下游引物各0.4 μL、Green qPCR SuperMix 10 μL、无酶水补足体系。采用两步法进行荧光信号采集:94 ℃预变性30 s;94 ℃变性5 s、60 ℃退火30 s,40个循环。选取β-actin作为内参基因,检测各处理组中炎症因子IL-1β、IL-6、IL-10和TNF-α基因相对表达量,引物序列如表1所示。

表1 引物序列Table 1 Primer sequences
1.5 统计学分析
所有数据经过Excel 2016软件初步处理整合后,使用SPSS 25.0统计软件进行方差分析,使用绘图软件Graphpad 9进行绘图。
2 结果与分析
2.1 PBMCs形态学观察
新分离出的原代羊外周血单个核细胞在培养基中悬浮生长,少量巨噬细胞贴壁生长。在光学显微镜下观察呈球形,折光率较强。随着培养时间的增加,外周血单个核细胞出现抱团生长的现象,细胞折光率降低,细胞形态开始出现不规则变化,甚至有细胞出现凋亡和破裂(图1)。

图1 羔羊外周血单个细胞体外培养Fig.1 In vitro culture of lamb PBMC
2.2 LPS对羊外周血单个核细胞活力的影响
如图2所示,在相同时间内,随着LPS处理浓度的升高,外周血单个核细胞的相对活性呈现先升高后降低的趋势,但是与对照组相比均差异不显著。在处理3 h时,浓度为0.4、2 μg/mL时细胞相对活性达到峰值;在处理6 h时,浓度为0.2 μg/mL时细胞相对活性达到峰值;在处理12 h时,浓度为0.4 μg/mL时细胞相对活性达到峰值。
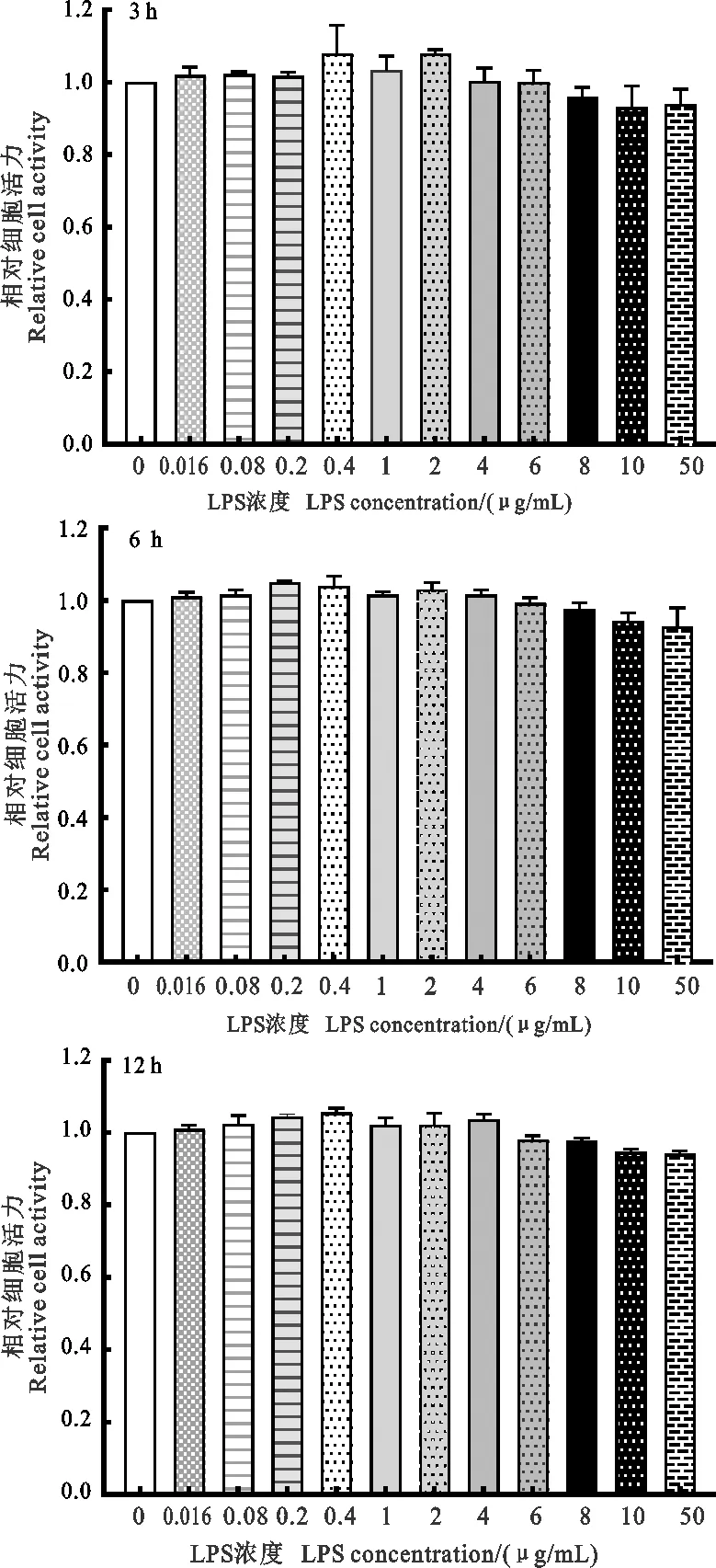
图2 不同LPS处理时间外周血单个核细胞相对活性柱上标相同字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下同Fig.2 Relative activity of PBMCs at different timestreated with LPSThe same or the absence of letters above columns indicateinsignificant difference(P>0.05),different lowercase lettersindicate significant difference(P<0.05),different capitalletters indicate highly significant difference(P<0.01).The same below
2.3 LPS对羊外周血单个核细胞炎症因子表达量的影响
LPS处理后羊外周血单个核细胞炎症因子表达量见图3。
由图3A可见,IL-1β处理3 h,各处理组之间IL-1β基因相对表达含量差异不显著(P>0.05);处理6 h时,2、4、6、8、10 μg/mL浓度处理组IL-1β基因相对表达量较对照组均极显著升高(P<0.01),1 μg/mL浓度处理组IL-1β基因相对表达量较对照组显著升高(P<0.05),除0.4 μg/mL以外其他浓度处理组IL-1β基因相对表达量较3 h和12 h均有所升高;处理12 h,浓度为2 μg/mL时相对表达量显著高于对照组(P<0.05)。处理6 h、处理浓度为10 μg/mL时,IL-1β的相对表达量达到峰值。
IL-6的表达量如图3B所示,LPS处理3 h,浓度为6、10 μg/mL相对表达量极显著高于对照组(P<0.01);LPS处理6 h,浓度为6、8、10 μg/mL处理组的IL-6相对表达量极显著高于其他各组(P<0.01),并且在8 μg/mL时达到峰值;处理12 h,浓度为6 μg/mL处理组相对表达量极显著高于其他各组(P<0.01)。当处理时间为3 h、处理浓度为6 μg/mL时,IL-6的相对表达量达到峰值。
如图3C所示,LPS处理3 h,浓度为1、2、4、6、8 μg/mL时IL-10基因相对表达量与对照组之间存在极显著性差异(P<0.01);处理6 h,浓度4 μg/mL组相对表达量极显著高于对照组(P<0.01),浓度2、6 μg/mL组显著高于对照组(P<0.05);处理12 h,浓度1、4 μg/mL组相对表达量显著高于对照组(P<0.05)。处理6 h、处理浓度为4 μg/mL时,IL-10的相对表达量达到峰值。
如图3D所示,LPS处理3 h,浓度为4、6 μg/mL处理组TNF-α基因相对表达量极显著高于对照组(P<0.01);处理6 h,1、4 μg/mL处理组与对照组差异显著(P<0.05);处理12 h,2、4、6 μg/mL处理组与对照组差异极显著(P<0.01)。处理6 h、浓度为1 μg/mL时,TNF-α的相对表达量达到峰值。
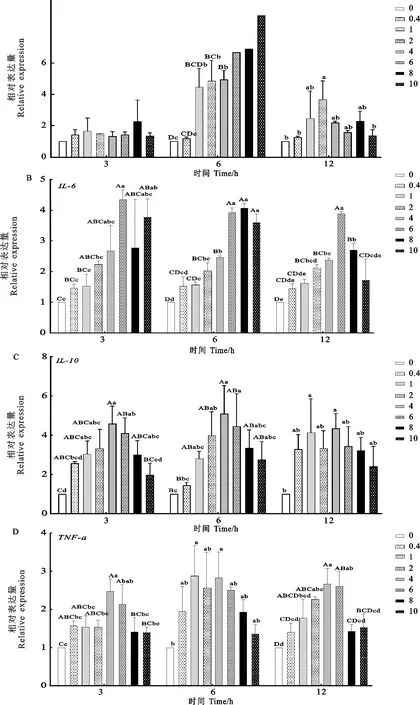
图3 LPS对外周血单个核细胞炎症因子相对表达量的影响Fig.3 Effects of LPS on the relative expression of inflammatory factors in PBMC
综上所述,LPS处理时间为6 h时,各细胞炎症因子表达量普遍达到峰值。结合细胞相对活力结果,应选取浓度为4 μg/mL、处理时间为6 h建立LPS体外诱导的羔羊外周血单个核细胞炎症模型,用于后续试验。
3 讨 论
本试验采用LPS构建羔羊外周血单个核细胞炎症模型,探究了不同作用浓度和时间,羔羊外周血单个核细胞相对细胞活力、IL-1β、IL-6、IL-10和TNF-α炎症因子的表达量,研究发现当LPS浓度高于6 μg/mL时,细胞活性低于对照组。在相同处理时间条件下,随着处理浓度的升高,细胞相对活性呈现先升高后降低的趋势,各处理组之间差异不显著。在处理浓度小于6 μg/mL,处理时间在12 h之内细胞活性没有显著性变化。LPS对羔羊外周血单个核细胞活力变化趋势的影响与吴华[15]研究中细胞活性的变化趋势一致,但是不同动物的外周血单个核细胞对LPS溶液具有不同的耐受程度,本试验中建立的外周血单个核细胞炎症模型,LPS的处理浓度应小于6 μg/mL。羔羊外周血单个核细胞在体外未加刺激时存活时间较短,在培养24 h后出现大量细胞团,细胞活性逐渐受到抑制,因此本试验选取3 h、6 h和12 h 3个时间节点检测LPS对细胞活性和炎症因子表达量的影响。
外周血单个核细胞体外疾病模型被广泛运用于各种药物作用效果的研究中。Du等[16]采用LPS构建人外周血单个核细胞体外炎症模型探究异佛司可林和佛司可林对炎症的抑制作用;Yu等[17]通过外周血单个核细胞体外模型探究人绒毛膜促性腺激素对细胞因子分泌的影响;Garcia-Campos等[18]通过转录组学的方法探究绵羊和牛感染肝片吸虫后外周血单个核细胞中基因表达的差异变化,以求寻找新的预防和治疗方法,包括新的活性化合物和疫苗。因此探究羔羊外周血单个核细胞体外培养条件,构建LPS诱导的羔羊外周血单个核细胞炎症模型,可为新型植物提取物的抗炎作用的探究提供便利和细胞学基础。
IL-1β、IL-6和TNF-α是内源性致热源,可引起机体发热以及组织细胞、上皮细胞以及其他免疫细胞的炎症反应,释放一系列炎性介质,引发组织损伤。IL-1β和IL-6最初被发现作用于白细胞之间因此被称为白细胞介素[19]。IL-1β出现各种能够引起炎症反应的疾病中,可以促进Th1对疾病的应答,同时可促进NLRP3炎症小体的产生,进而加重疾病造成的炎症反应[20]。IL-6可由多种免疫细胞分泌,既可以促炎又可以抗炎,可以刺激Th17细胞的产生,分泌IL-17和IL-10细胞因子,抑制Th17细胞的致病功能[21]。TNF-α主要由巨噬细胞和单核细胞产生,在调节免疫应答和诱导细胞凋亡等过程中发挥重要作用[22]。IL-10可拮抗炎症介质,通过控制炎症反应,避免组织过度损伤[23]。本试验中,IL-1β、IL-6、TNF-α和IL-10的表达量随着LPS处理浓度的升高呈现先升高后降低的趋势,这可能是由于LPS浓度过高抑制了外周血单个核细胞的活性,从而降低了炎症因子的分泌量。随着处理时间的增加,炎症因子表达量也呈现先升高后降低的趋势,但是IL-1β的相对表达量在处理时间为6 h时,除了0.4 μg/mL处理组外其余各浓度处理组均高于3 h和12 h,其他炎症因子在时间维度的变化趋势并不显著。整体来说,处理时间为6 h时,各炎症因子表达量达到峰值。因处理浓度高于6 μg/mL时细胞活性低于对照组,所以选取处理浓度为4 μg/mL建立体外炎症模型。
4 结 论
本试验中,LPS处理浓度和处理时间对细胞相对活性没有显著影响。IL-1β的相对表达量在LPS处理6 h、处理浓度为10 μg/mL时达到峰值,且除0.4 μg/mL以外,其余各浓度处理组均显著高于对照组。IL-6的相对表达量在处理3 h、处理浓度为6 μg/mL时达到峰值。IL-10的相对表达量在处理6 h、处理浓度为4 μg/mL时达到峰值。TNF-α的相对表达量在处理6 h、处理浓度为1 μg/mL时达到峰值。建议以处理时间为6 h、处理浓度为4 μg/mL建立LPS体外诱导的羔羊外周血单个核细胞炎症模型,可以在保证细胞相对活力不受影响的同时提高炎症因子表达量。
