补气养阴祛瘀泄浊汤联合厄贝沙坦片治疗气阴两虚兼痰阻血瘀型糖尿病肾病的临床研究※
2023-01-11郑映丹饶克瑯
郑映丹 饶克瑯
(广州中医药大学附属宝安中医院肾病科,广东 深圳 518101)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病慢性发展过程中的重要并发症,在病程10年以上的2型糖尿病(T2DM)患者中,约20%的患者可发展为DKD[1]。近年来,我国糖尿病患病率从1980年大致估计的1%[2],攀升至2010年统计的11.6%[3],随之而来DKD患者的数量也快速增加。DKD早期以白蛋白尿、肾功能受损为主要表现,随着病情进展,肾功能进行性恶化,最终发展为终末期肾病(ESRD),已成为我国慢性肾脏病(CKD)的主要原因[4]。DKD发病机制复杂,可能是糖脂代谢紊乱、炎性反应、血流动力学异常、细胞因子、蛋白激酶、遗传等多因素联合介导了DKD的发生发展[5-6]。目前西医临床对未进入ESRD阶段患者的主要治疗方式为积极控制DKD发展的危险因素,通过降血糖、降血压、调血脂等基础治疗以期延缓病情进展,但疗效往往并不理想。而中医在治疗DKD方面积累了丰富的经验,认为其基本病机为阴虚燥热,长期气阴亏耗而出现湿浊内蕴,瘀血阻滞之证。2019年5月至2021年5月,我们采用补气养阴祛瘀泄浊汤联合厄贝沙坦片治疗气阴两虚兼痰阻血瘀型DKD患者34例,并与单纯采用厄贝沙坦片治疗33例对照观察,结果如下。
1 资料与方法
1.1 一般资料 全部67例均为广州中医药大学附属宝安中医院肾病科收治的气阴两虚兼痰阻血瘀型DKD住院患者,按照随机数字表法分为2组。治疗组34例,男22例,女12例;年龄42~70岁,平均(57.14±9.02)岁;糖尿病病程6~17年,平均(10.88±4.72)年;DKD病程6个月~6年,平均(3.50±1.69)年;DKD病情Mogensen分期均为Ⅳ期[4]。对照组33例,男19例,女14例;年龄35~69岁,平均(58.18±7.43)岁;糖尿病病程6~19年,平均(11.27±5.94)年;DKD病程6个月~7年,平均(3.30±1.64)年;DKD病情Mogensen分期均为Ⅳ期。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 病例选择
1.2.1 诊断标准 西医诊断参照《糖尿病肾病防治专家共识(2014年版)》中DKD的诊断标准[4],其中Ⅳ期DKD即是指进入大量蛋白尿阶段,持续尿蛋白>0.5 g/24 h,肾小球滤过率(GFR)正常或下降。中医诊断参照《糖尿病肾病诊断、辨证分型及疗效评定标准(试行方案)》中气阴两虚兼痰阻血瘀型DKD的诊断标准[7]。主症:倦怠乏力,头晕耳鸣,心悸气短,自汗盗汗,心胸窒闷,肢沉体胖;次症:面色白,烦躁失眠,遗精早泄,口渴嗜饮,嗜睡,痰多口黏,肢体酸痛;舌脉:舌质淡红,苔少或浊腻,脉弦滑细。具备主症2项,或主症1项、次症2项,结合舌脉即可确诊。
1.2.2 纳入标准 符合上述中、西医诊断标准;年龄18~70岁;患者知情同意并自愿参加本研究,签署知情同意书,经过广州中医药大学附属宝安中医院医学伦理委员会批准。
1.2.3 排除标准 24 h尿蛋白定量(24 hUTP)>10 000 mg,血浆白蛋白<25 g/L者;合并急性心脑血管意外、糖尿病酮症酸中毒、恶性肿瘤等危重急病者;近期血压控制欠佳者[≥160/100 mmHg(1 mmHg≈0.133 kPa)];对本研究治疗药物过敏者;治疗依从性差,不能按要求完成治疗者;妊娠期或哺乳期妇女。
1.3 治疗方法
1.3.1 对照组 予厄贝沙坦片[赛诺菲(杭州)制药有限公司,国药准字H20040494]150 mg,每日1次口服。同时给予控制血糖、血脂等基础治疗,开展糖尿病饮食健康宣教,适量运动。
1.3.2 治疗组 在对照组的基础上加用补气养阴祛瘀泄浊汤治疗。药物组成:黄芪15 g,太子参15 g,生地黄15 g,山茱萸15 g,山药15 g,茯苓15 g,白术15 g,丹参15 g,川芎15 g,生大黄5 g,积雪草15 g,玉米须15 g。倦怠气短明显者,太子参、黄芪增至30 g;头晕明显者,加姜半夏10 g、胆南星5 g;自汗盗汗明显者,加煅牡蛎15 g、煅龙骨15 g;腰痛甚者,加杜仲15 g、牛膝15 g。日1剂,水煎取汁400 mL,分早、晚2次温服。
1.3.3 疗程 2组均治疗12周后统计疗效。
1.4 观察指标及方法 ①比较2组治疗前后中医症状积分变化情况,参考《中药新药临床研究指导原则(试行)》[8]中相关内容拟定评分标准,包括倦怠乏力、头晕耳鸣、心悸气短、自汗盗汗、心胸窒闷及肢沉体胖6项主症,均按无、轻、中、重的程度分别评为0、2、4、6分,积分越高表示症状越重。②比较2组治疗前后血糖、血脂指标变化情况,包括空腹血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)及甘油三酯(TG)。③比较2组治疗前后肾功能指标变化情况,包括血肌酐(SCr)、尿素氮(BUN)、胱抑素C(Csy-c)及24 hUTP。④比较2组治疗前后超敏C反应蛋白(hs-CRP)、白细胞介素6(IL-6)及D-二聚体(D-D)水平变化情况。⑤观察记录2组治疗期间不良反应发生情况。
1.5 疗效标准 显效:患者症状、体征明显改善,中医症状积分减少≥70%;有效:患者症状、体征均有好转,中医症状积分减少≥30%,<70%;无效:患者症状、体征均无好转甚或加重,中医症状积分减少<30%[8]。总有效率=(显效例数+有效例数)/总例数×100%。

2 结果
2.1 2组临床疗效比较 治疗组总有效率85.3%(29/34),对照组总有效率57.6%(19/33),治疗组疗效优于对照组(P<0.05)。见表1。

表1 2组临床疗效比较 例
2.2 2组治疗前后中医症状积分变化比较 与本组治疗前比较,2组治疗后中医症状倦怠乏力、头晕耳鸣、心悸气短、自汗盗汗、心胸窒闷及肢沉体胖积分均下降(P<0.05),且治疗组治疗后中医症状倦怠乏力、头晕耳鸣、心悸气短、自汗盗汗、心胸窒闷及肢沉体胖积分均低于对照组(P<0.05)。见表2。
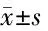
表2 2组治疗前后中医症状积分变化比较 分,
2.3 2组治疗前后肾功能指标水平变化比较 与本组治疗前比较,2组治疗后SCr、BUN、Csy-c及24 hUTP水平均降低(P<0.05),且治疗组治疗后SCr、BUN及24 hUTP水平均低于对照组(P<0.05)。见表3。
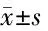
表3 2组治疗前后肾功能指标水平变化比较
2.4 2组治疗前后hs-CRP、IL-6及D-D水平变化比较 与本组治疗前比较,2组治疗后hs-CRP、IL-6及D-D水平均降低(P<0.05),且治疗组治疗后hs-CRP、IL-6及D-D水平均低于对照组(P<0.05)。见表4。
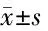
表4 2组治疗前后hs-CRP、IL-6及D-D水平变化比较
2.5 2组治疗前后FPG、HbA1c、TC及TG水平变化比较 与本组治疗前比较,2组治疗后FPG、HbA1c、TC及TG水平均降低(P<0. 05),且治疗组治疗后TC及TG水平低于对照组(P<0.05)。见表5。
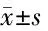
表5 2组治疗前后FPG、HbA1c、TC及TG水平变化比较
3 讨论
DKD是糖尿病代谢异常导致微小血管发生病变,而出现的肾小球基底膜增厚、肾小球肥大硬化、肾小管间质炎症纤维化等病变。目前,临床上对于DKD出现持续蛋白尿,伴或不伴高血压的患者推荐首选肾素-血管紧张素系统(RAS)阻滞剂治疗,有明确的证据表明,使用RAS阻滞剂可延缓大量蛋白尿DKD患者病情的进展[4]。故我们使用厄贝沙坦片作为基础治疗药物。厄贝沙坦片是血管紧张素Ⅱ(AngⅡ)受体抑制剂,通过选择性地阻断AngⅡ与受体的结合,抑制血管收缩,同时减少尿蛋白排泄,改善肾间质纤维化,从而有效发挥肾保护作用[9]。但单独选择RAS阻滞剂治疗,疗效存在较大的个体差异,并且有严重副作用的风险,如急性肾损伤和高钾血症,因此广大学者仍在不断探索更安全有效的治疗手段[10]。
中医学根据DKD的临床症状,将其归属为“消瘅”“尿浊”“虚劳”“水肿”等范畴。认为本病缘于消渴迁延日久,累及肾脏,形成本虚标实的病机特征,以脾、肾气阴两虚为本,湿浊内生、瘀血内阻为标。脾虚则水谷不化,升清功能障碍,导致湿浊之邪羁留,脾虚气血不生,肾精充养不足;肾虚封藏失职,水精失固,精微物质外泄,肾脏气阴耗伤更甚。阴虚者血不足,络脉空虚,血行不畅,导致瘀血内停。血瘀阻滞气机,津液输布困难,进一步加重湿浊,湿浊、血瘀交阻肾络,脾肾亏损不愈而发病。补气养阴祛瘀泄浊汤是在参芪地黄汤的基础上化裁而来,取其健补脾肾、补益气阴之功,同时又加强化湿泄浊、活血通络的作用。方中黄芪补气升阳,益气固表,使脾运升清,肾气补益,固涩在职;太子参益气生津,与黄芪合用,增强补气之功;生地黄滋补肾水真阴,助黄芪、太子参气阴双补;山茱萸滋补肝肾,固肾精,涩精微;山药健运脾胃,补肾涩精;茯苓、白术健脾益气,利水除湿,两者佐山药有助于脾胃生化气血,淡渗痰浊;丹参、川芎活血化瘀,合用加强化瘀通络功效;生大黄泻热通肠,凉血逐瘀,使热邪、湿浊从肠腑而去;积雪草清热利湿;玉米须利湿泄热。全方配伍严谨,共奏脾肾气阴并补、湿浊瘀血同消之效。现代药理学研究表明,黄芪中的有效成分黄芪甲甙及黄芪多糖具有抗炎、免疫调节作用,通过阻断肾组织内质网应激反应,减少蛋白尿,改善肾小球硬化和间质纤维化[11];太子参能降低血糖,调节血脂水平,在一定程度上改善糖尿病大鼠的肾脏病理变化[12];丹参提取物能保护血管内膜,改善肾脏的微循环,改善脂代谢紊乱,具有抗炎、抗凝作用[13];川芎可以有效降低糖尿病模型小鼠的血糖和脂质水平,具有降血糖、降血脂作用,同时具有扩张血管的功效[14];玉米须能降血糖,同时下调肾脏转化生长因子β1(TGF-β1)、纤维粘连蛋白(FN)的表达,发挥肾保护作用[15];积雪草总苷具有抑制炎性反应、抑制纤维化、抑制氧化应激、保护足细胞、抑制细胞凋亡作用[16]。
研究表明,DKD患者普遍存在脂代谢紊乱,且脂质紊乱是糖尿病患者肾脏损害进行性发展的重要因素之一。血脂异常可以诱发炎性反应,并通过氧化应激激活TGF-β途径损伤内皮细胞,加速肾脏病进展,另外TC、TC还可沉积于肾脏,导致肾小球硬化,通过调节血脂水平,或可改善DKD预后[17]。近年来,DKD被认为是多因素共同作用的结果,已经发现炎症因素及高凝状态参与了DKD的发病过程,糖脂代谢紊乱增加了血管内皮的通透性,损伤血管内皮功能,同时可引起炎症因子低水平、持续性释放,进一步加剧血管内皮损伤,加重肾脏损害[18-19]。IL-6是常见的促炎因子,几乎参与了所有慢性炎症性疾病的发展,在肾脏组织炎症损伤后迅速产生,随后诱导大量炎症因子如hs-CRP的分泌,IL-6及hs-CRP水平升高,诱导血管内皮生长因子(VEGF)的过量合成,导致血管通透性增加[20-21]。DKD患者在慢性、持续的炎性反应下,可导致肾脏血流动力学异常,血液黏稠度升高,血液流速降低,形成高凝状态,加重肾脏缺血情况,导致功能受损[22]。D-D是一种纤维蛋白降解产物,其水平异常增高提示体内高凝状态[23]。本研究结果显示,治疗组总有效率高于对照组(P<0.05),治疗后中医症状倦怠乏力、头晕耳鸣、心悸气短、自汗盗汗、心胸窒闷及肢沉体胖积分均低于对照组(P<0.05),TC、TG、SCr、BUN、24 hUTP、hs-CRP、IL-6及D-D水平均低于对照组(P<0.05)。提示补气养阴祛瘀泄浊汤联合厄贝沙坦片治疗气阴两虚兼痰阻血瘀型DKD疗效确切,可有效改善患者中医症状,有效减少蛋白尿,保护肾功能,其作用机制可能是通过调控血脂水平,改善血管内皮功能,抑制炎性反应,减轻肾脏损害,改善血液高凝状态,缓解肾脏供血不足,从而延缓DKD病情进展,具有较高的临床应用价值。但本研究观察样本量有限,且观察时间较短,具体机制未十分明确,仍需进一步深入研究。
