白藜芦醇治疗牙周炎及其生物利用度的研究进展
2023-01-10李琼于维先
李琼 于维先,2
1.吉林大学口腔医院牙周病科 长春 130021;2.吉林省牙发育及颌骨重塑与再生重点实验室 长春 130021
牙周炎是一种慢性炎症性疾病,其发病机制主要与牙菌斑生物膜形成、口腔微生态失调和机体的免疫炎症反应异常有关[1]。牙周炎已成为全球第六大常见疾病,影响着11%世界人口的牙周健康[2]。牙周炎可造成牙齿周围结缔组织破坏和牙槽骨进行性吸收,引起牙龈退缩,牙周袋形成,牙齿松动,最终导致牙齿脱落,咀嚼功能受损,对患者的生活质量产生负面影响[2]。白藜芦醇(resveratrol)是一种在深色葡萄、浆果和花生皮中发现的植物来源的多酚天然化合物。研究[3]表明,白藜芦醇具有抗炎、抗氧化、预防心血管疾病和抗衰老、抗癌活性等多种功能。随机对照试验[4]发现:含有白藜芦醇的口腔喷雾剂可显著减少学龄前儿童的牙菌斑数量和牙龈炎症,并改善唾液pH值。目前,白藜芦醇已被用作膳食补充剂和化妆品成分[3]。
近年来,由于白藜芦醇强大的生物学活性,它在预防和治疗牙周炎方面受到学术界的广泛关注。本文总结了白藜芦醇在治疗牙周炎时发挥的药理学机制和研究进展,以及白藜芦醇作为牙周炎治疗药物使用的一些问题及改进方法,旨在为进一步研究白藜芦醇,以便作为治疗牙周炎的药物,并开发更好的药品剂型提供参考依据。
1 白藜芦醇的结构
白藜芦醇是一种多酚二苯乙烯化合物,以白色粉末的形式存在,具有连接两个酚环的双键,可通过紫外线照射进行几何异构化。因此,白藜芦醇存在两种亚型,分别为顺式白藜芦醇(cisresveratrol) 和反式白藜芦醇 (trans-resveratrol),其结构式见图1,其中反式异构体是一种空间上更稳定的形式[5]。在各种常见的实验室条件下,反式白藜芦醇可以保持稳定,而顺式白藜芦醇只有在完全避光且接近中性pH时才能保持稳定,低pH和光照都会导致顺式白藜芦醇异构化为反式白藜芦醇[6]。可见在自然条件下,反式异构体除了具有更强的生物活性外,也比顺式异构体更稳定[5]。
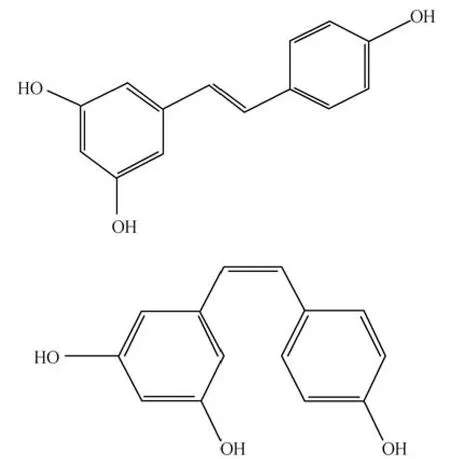
图1 反式(上)和顺式(下)白藜芦醇结构式Fig 1 Structural formula of trans-resveratrol (top) and cis-resveratrol(bottom)
2 白藜芦醇治疗牙周炎的作用机制
牙周炎是一种慢性细菌感染性疾病。牙周致病菌不仅可以表达多种毒力因子,如脂多糖(lipopolysaccharide,LPS)、肽聚糖、蛋白酶等,造成健康组织的破坏;还能刺激宿主产生各种细胞因子,如基质金属蛋白酶(matrix metalloproteinase,MMP)-1、MMP-8、白细胞介素(interleukin,IL)-1β、前列腺素E2(prostaglandin E2,PGE2)等,从而引发局部炎症反应[7]。氧化应激是机体抗氧化防御系统失衡的结果,可以通过各种机制导致细胞和组织损伤。牙周炎与氧化应激有直接的相关性,动物实验[8]表明:当抑制炎症牙周组织中的氧化应激水平后,小鼠牙周炎可明显减轻。白藜芦醇作为一种有效的抗炎抗氧化剂,在牙周炎治疗方面的研究受到学术界越来越多的关注。在一项随机双盲的临床试验[9]中发现:每天补充白藜芦醇可显著降低牙周炎合并2型糖尿病患者的牙周袋深度,因此补充白藜芦醇可以对牙周病的破坏发展起到一定的控制作用。白藜芦醇在治疗牙周炎中的作用机制,主要包括抗炎、抗氧化、抗菌作用,以及抑制骨吸收和成骨作用。
2.1 抗炎和抗氧化作用
白藜芦醇可通过抑制炎症因子的产生来发挥其抗炎作用。Li等[10]通过体外实验证明:白藜芦醇可以剂量依赖性方式下调炎症因子IL-1β、IL-6、IL-8、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)的表达。在牙周炎大鼠模型[11-12]中,白藜芦醇显著降低了IL-1β、IL-17、IL-4、干扰素-γ(interferon-γ,IFN-γ)等蛋白质的分泌。临床试验[13]也表明:每日服用白藜芦醇有利于降低伴有糖尿病牙周炎患者血清中炎症因子IL-6的表达。进一步研究[14]发现:白藜芦醇可通过激活ERK1/2通路,减少相关炎症因子的分泌。
此外,白藜芦醇具有很强的抗氧化活性,表现为抑制主要的抗氧化酶和减少活性氧(reactive oxygen species,ROS) 对组织的损伤。体外研究[10,15]显示:白藜芦醇可通过靶向调控PI3K/AKT和Wnt/β-catenin信号通路预防细胞的氧化应激反应,如增加抗氧化剂超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的含量,并减少ROS和氧化应激标志物丙二醛(malondialdehyde,MDA)的产生。Corrêa等[16]在体内研究中也发现:白藜芦醇可通过降低还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶水平、上调SIRT1(Sirtuin 1)和SOD的表达来减轻由吸入香烟烟雾造成的牙周炎大鼠的氧化应激状态,减轻牙周组织破坏程度。然而,目前关于白藜芦醇在治疗牙周炎中发挥抗炎抗氧化作用的机制研究仍不够透彻,需要进一步探索其涉及到的信号通路及相关分子。
2.2 抗菌作用
在多项针对牙龈卟啉单胞菌的研究[17-18]中发现:白藜芦醇可呈剂量依赖性地阻止生物膜形成,减少细菌与基质蛋白的结合,并通过降低毒力因子基因,如菌毛(Ⅱ型和Ⅳ型)和牙龈素的表达来减弱牙龈卟啉单胞菌的毒力。此外,白藜芦醇还可以通过抑制牙龈卟啉单胞菌对角质细胞紧密连接的破坏,从而对角质细胞紧密连接的完整性起到保护作用[17-18]。Pothapur等[19]在研究与白藜芦醇相互作用的牙周红色复合病原体的蛋白质和毒力因子时发现:与白藜芦醇相互作用的蛋白质主要与细胞过程有关,其次是代谢和毒力因子,没有鉴定出与信息存储相关的蛋白质。牙龈卟啉单胞菌与白藜芦醇反应的蛋白质包括去甲亚精胺脱羧酶(carboxynorspermidine decarboxylase)和SOD Fe-Mn(superoxide dismutase Fe-Mn);福赛斯坦纳菌与白藜芦醇反应的蛋白质是去甲亚精胺脱羧酶。Abdullahi等[20]通过分子力学Poisson/Boltzmann表面积分析表明:白藜芦醇与白细胞功能相关受体 (leukocyte function-associated receptor,LFA-1)具有较高的亲和力和稳定性,提示它们有能力占据白细胞毒素(leukotoxin,LtxA)的结合部位,从而降低伴放线聚集杆菌的毒力。虽然目前关于白藜芦醇对牙龈卟啉单胞菌的抗菌作用研究较多,但具体机制仍不十分清楚;此外,牙周炎是多细菌感染性疾病,需要进一步研究白藜芦醇对于其他牙周致病菌的抗菌机制。
2.3 抑制骨吸收和成骨作用
白藜芦醇能够调节破骨细胞生成相关因子的产生,表现为显著降低大鼠牙龈组织中IL-17的水平,从而减轻大鼠的牙槽骨吸收[21]。Wang等[22]通过体内体外研究表明:白藜芦醇可促进健康人群和牙周炎患者牙周组织中牙周膜干细胞(periodontal ligament stem cells,PDLSCs)聚集体的形成,并提高其成骨潜能。进一步研究[23]表明:经过白藜芦醇处理后,PDLSCs的自我更新和多向分化能力得到明显改善。进一步进行机制分析,发现白藜芦醇可激活ERK/WNT串扰,分别上调成骨和免疫调节中runx2和fasl基因的表达水平;此外在牙周炎动物模型上,白藜芦醇可通过激活内源性体干细胞和抑制炎症T细胞浸润来减轻部分骨吸收。Adhikari等[24]也发现:通过结扎法建立小鼠牙周炎模型,5 d后拔除患牙,并在拔牙窝内给予白藜芦醇治疗,免疫组织化学结果显示治疗组的促炎细胞因子水平(TNF-α和IL-6)、中性粒细胞和巨噬细胞标志物髓过氧化物酶(myeloperoxidase,MPO)反应性均低于对照组,并且观察到白藜芦醇治疗组CD31、F4/80 和骨钙素 (osteocalcin,OCN)阳性细胞的数量较对照组更多,同时显微CT也证实白藜芦醇治疗组拔牙窝骨量增加。虽然已经有不少研究,但白藜芦醇目前在抑制牙周炎骨吸收和促进牙周炎成骨方面的实验仍较少,并且缺乏相关机制方面的研究,仍需要进一步探索。
3 白藜芦醇的吸收与代谢
白藜芦醇口服后可通过被动扩散或载体介导的跨细胞顶端膜转运而被肠道细胞大量吸收,然后迅速广泛地代谢成白藜芦醇葡萄糖醛酸苷或硫酸盐[25]。研究[26]表明:摄入的白藜芦醇有很大一部分(约90%)以完整的形式到达结肠,随后进行肠道发酵。当通过门静脉吸收后,产生的多酚代谢物将进入肝脏进一步甲基化、葡萄糖醛酸化或与硫酸盐反应。随后,代谢物将渗透到体循环中,并到达目标组织和细胞发挥生物学活性。多余的白藜芦醇和其代谢物可以通过胆汁循环回小肠或通过尿液排出体外。
4 白藜芦醇应用中存在的问题及解决方法
快速吸收、低生物利用度和低水溶性是白藜芦醇体内应用的关键因素[27]。研究[28]表明:白藜芦醇的口服生物利用度低于5%,水溶性也较低,溶解度约为0.03 g·L-1,这也影响了其吸收和生物利用度。pH和温度变化都可强烈影响白藜芦醇的稳定性和溶解性。Zupančič等[29]研究表明:白藜芦醇在水中仅在室温或在酸性条件下的体温环境中保持稳定,随着pH值的增加,其溶解度则呈指数级降低。尽管白藜芦醇在口服使用时存在代谢速度快、生物利用度低和水溶性差等问题,但掩盖不了其强大的生物学活性及药用价值。目前学者们正在研究新的给药系统,以克服白藜芦醇的药代动力学障碍,提高其生物利用度并改善其溶解性。白藜芦醇在牙周炎治疗的应用方面,主要有以下两种改进方式。
4.1 助溶剂的使用
二甲基亚砜(dimethyl sulfoxide,DMSO)是一种有机溶剂,可用来溶解白藜芦醇等水溶性低的治疗药物。Adhikari等[24]通过DMSO作为溶剂溶解白藜芦醇,来治疗小鼠实验性牙周炎,并取得了一定效果。然而DMSO具有细胞毒性作用,必须在低浓度下使用。研究[30]显示:即使低于10%体积比,也能观察到DMSO的毒性效应。在此基础上,有学者提出使用安全性较高的溶剂——环糊精(cyclodextrin)。环糊精具有重要的药用价值,是一种有潜力的增溶剂和赋形剂,已被广泛用于食品和制药行业[31]。环糊精是一种环状低聚糖,有3种常见的天然存在形式,即α-环糊精、β-环糊精、γ-环糊精。2-羟丙基-β-环糊精 (2-hydroxypropyl-β-cyclodextrin,HPβCD)是一种通过羟丙基改性的环糊精,具有较好的安全性,在水中的溶解度高于天然存在形式,溶解度大于60%(质量分数)[32]。白藜芦醇与HPβCD络合后,白藜芦醇的水溶性提高,生物利用度和疗效方面均有提高[33]。Yang等[34]通过小鼠模型研究发现:口服白藜芦醇和HPβCD的络合物与口服白藜芦醇纳米悬浮剂相比,口服络合物可使白藜芦醇组织的生物利用度增加约2倍。Lim等[35]也证明:利用HPβCD作为溶剂溶解白藜芦醇,有效地抑制了牙周致病菌具核梭杆菌生物膜的形成。此外,羧甲基纤维素(carboxymethyl cellulose,CMC)也可作为溶剂应用。CMC是一种阴离子水溶性生物聚合物,是纤维素的衍生物之一。CMC具有亲水性、生物黏附性、无毒性和成胶能力等特点,广泛应用于药物输送和其他生物医学研究[36]。Li等[37]发现:白藜芦醇用0.5%的CMC溶解后进行全身给药,可有效防止实验性牙周炎大鼠的牙槽骨吸收。综合这些研究可以推测,使用安全性高的助溶剂,如HPβCD和CMC可以提高白藜芦醇的溶解度,增强其生物活性。
4.2 纳米颗粒的利用
纳米药物具有靶向输送功能,从而可以改善治疗效果。局部应用纳米药物可以将治疗药物直接输送进入靶组织,发挥治疗作用,且简单易行[38]。研究[39]表明:固体脂质纳米颗粒和纳米结构脂质载体可用于改善白藜芦醇的水溶性差和生物利用度低等问题。Shi等[40]研制了一种治疗性白藜芦醇脂质体系统(resveratrol-loaded liposomal system,Lipo-RSV),用于牙周炎的局部用药治疗,结果发现:Lipo-RSV具有良好的生物相容性,可通过激活p-信号传导及转录激活因子(signal transducer and activator of transcription,STAT) 3和下调p-STAT1,将炎症巨噬细胞从M1表型重新编码为M2表型,而巨噬细胞M1表型与M2表型比例的增加与牙周炎症的程度呈正相关。此外,Lipo-RSV还能有效清除ROS,降低促炎细胞因子IL-1β、IL-6和TNF-α,同时使抗炎因子IL-10升高,改善牙周组织的炎症状态[40]。如今基于生物相容高的蛋白质纳米颗粒、纳米结合物和蛋白质复合体越来越受到重视,如白蛋白、酪蛋白、大豆蛋白、鞘磷脂等。这些纳米颗粒具有独特的优势,可以提高药物稳定性,在某些情况下,还可以释放药物[41]。丝素蛋白(silk fibroin)在再生医学和促进伤口愈合方面具有显著的性能。体外和体内研究[42]均已证明:构成丝素蛋白结构的多肽在刺激脂肪细胞的葡萄糖转运和刺激伤口愈合时的成纤维细胞活性方面都具有很高的治疗价值,同时还能降低环氧合酶-2(cyclooxygenase-2,COX-2)、IL-6和IL-1β的水平,从而发挥抗炎作用。将白藜芦醇包裹在丝素蛋白纳米颗粒中,不仅可以提高其治疗能力,还改善了白藜芦醇在生物体内的稳定性,并防止它们经历不必要的代谢过程;此外,这2种天然化合物的组合也没有明显的细胞毒性,可见丝素蛋白纳米颗粒可以作为白藜芦醇的载体,同时还能在体内可控地释放白藜芦醇以延长治疗效果[43]。Giménez-Siurana等[44]研究表明:给实验性牙周炎的糖尿病雄性大鼠口服负载白藜芦醇的丝素蛋白纳米颗粒后,可以显著降低牙周炎局部组织中的IL-6和IL-1β,减轻局部炎症反应。能提高白藜芦醇生物利用度及溶解度的纳米颗粒有很多,仍然需要进一步的探索研究。
5 白藜芦醇在牙周炎相关全身性疾病中的治疗作用
一些全身性疾病,如糖尿病、动脉粥样硬化、阿尔兹海默症等,与牙周炎的发生发展相互影响。研究[13]显示:给患有牙周炎的2型糖尿病患者每日口服白藜芦醇480 mg可明显缓解胰岛素抵抗。还有学者[45]给予动脉粥样硬化患者每天服用白藜芦醇100 mg,持续1年,结果发现:白藜芦醇能降低患者的收缩压、舒张压,胆固醇、甘油三酯和低密度脂蛋白,同时还能减少血管平滑肌细胞系中NADPH氧化酶的表达。Abozaid等[46]观察到:白藜芦醇-硒纳米颗粒具有抗淀粉样蛋白生成的潜力,可增加错误折叠蛋白质的清除率,改善胆碱能缺陷,从而减缓阿尔兹海默症的神经病理改变和神经认知功能减退。白藜芦醇虽然对一些牙周炎相关的全身性疾病有治疗作用,但仍然需要进一步研究其治疗这些相关疾病的具体机制。
6 总结与展望
目前,牙周炎防治是一个全球性的公共卫生问题。白藜芦醇作为一种具有药用价值的天然化合物,有望成为新的牙周炎替代治疗药物,以减轻滥用抗生素造成的不良影响。虽然白藜芦醇存在生物利用度低,水溶性差和肝肠代谢快等缺点,但是可以通过改进助溶剂和使用纳米颗粒等方法解决或改善这些问题。根据助溶剂和纳米颗粒的特有优势,可以研发不同的白藜芦醇剂型,如口腔喷雾剂、局部缓释剂、口腔含片和口服胶囊等,使白藜芦醇的药效得到精准发挥。此外,白藜芦醇也可用于治疗一些牙周炎相关的全身疾病,在使用白藜芦醇治疗牙周炎的同时,也可能对牙周炎相关的全身性疾病起到一定的治疗效果,以充分发挥白藜芦醇的治疗作用。尽管白藜芦醇具有极佳的应用前景,但作为牙周炎治疗药物的研究仍不够深入和充分,还需要大量研究来探索如何提高白藜芦醇的生物利用度,以进一步提高其治疗效果。
利益冲突声明:作者声明本文无利益冲突。
