蜡样芽胞杆菌NJSZ-13致死松材线虫的因子1)
2023-01-10孙玉凤谈家金赵晓佳袁裕超
孙玉凤 谈家金 赵晓佳 袁裕超
(南京林业大学,南京,210037)
松材线虫病是由松材线虫(Bursaphelenchusxylophilus)所引起的一种侵染性病害,传播速度快,短时间内可造成大面积的松林毁坏[1]。松材线虫主要以墨天牛属昆虫为媒介进行传播,通过寄生于松树体内而导致树木迅速死亡[2-3]。自1982年松材线虫首次在我国的南京中山陵被发现以来,至今已蔓延至我国19个省市,且近年来有从南向北扩散的趋势,对我国森林资源造成极大破坏。根据国家林业和草原局公告(2021年第14号)(2021年全国松材线虫病新发县级疫区公告),我国2021年3—7月新增7个松材线虫病县级疫区[4]。由于松材线虫寄生于松树体内,发病速度快,其防控已成为世界性的难题[5]。目前还没有彻底根治的方法,可采取的防治方法有物理防治、化学防治、生物防治等,其中应用最广泛的是化学防治,但由于化学农药易造成环境污染,且线虫易产生抗药性,化学杀线剂的应用受到一定的限制,因此更多的研究者们开始进行生物防治研究[6-7]。近年来的研究表明,在健康植物体内能够筛选到对松材线虫具有高效拮抗活性的内生细菌[8-9]。
蜡样芽孢杆菌(Bacilluscereus)NJSZ-13是从松树体内分离的一株内生细菌,经杀线作用测定发现该菌株的无菌发酵液对松材线虫的致死率能达到100%,菌体水悬液对松材线虫的致死率能达到81.5%[10]。在实际应用中细菌需通过菌体对松材线虫起作用,因此本研究针对NJSZ-13菌悬液对松材线虫的作用方式进行研究。为了明确蜡样芽胞杆菌NJSZ-13对松材线虫的作用机制,本研究在弄清菌株在线虫虫体位置的基础上,揭示了菌株胞外蛋白酶的杀线作用,从而为进一步探讨蜡样芽胞杆菌NJSZ-13的杀线机制提供参考。
1 材料与方法
1.1 试验材料
蜡样芽孢杆菌NJSZ-13菌株来源于南京林业大学森林病理实验室。
松材线虫AMA3虫株分离自安徽省病死黑松(Pinusthunbergii),现保存于南京林业大学松材线虫虫株资源库。
NJSZ-13菌悬液:挑取NJSZ-13单菌落置于200 r/min、28 ℃条件下持续摇培,于10 000 r/min、4 ℃条件下离心15 min,弃上清,得到的菌体沉淀以原体积1/2的无菌水彻底悬浮,至最终菌浓度为3×108菌落/mL,即为供试菌悬液。
营养琼脂(NA)有抗培养基:蛋白胨10 g/L,氯化钠5 g/L,牛肉膏3 g/L,青霉素10 mg/L,pH为7.2~7.4。
1.2 菌株NJSZ-13于松材线虫虫体上存在位置的鉴定
NJSZ-13菌悬液处理松材线虫AMA3虫株24 h后,挑取活的松材线虫,加入200 μL无菌水清洗线虫,3 000 r/min离心3 min,研究表明菌株NJSZ-13对青霉素耐药,因此分三组处理,使用加入青霉素的抗性培养基检测线虫带菌情况。A组吸取离心后的100 μL上清液涂布于抗性培养基,观察菌株NJSZ-13是否生长。B组依次使用0.05%硫酸链霉素、3%过氧化氢以及无菌水彻底清洗线虫体表。清洗完成后使用无菌水重悬线虫,混匀后吸取100 μL虫液涂布抗性培养基,未长菌落说明线虫表面消毒成功。C组将体表彻底消毒的松材线虫研磨破碎,混合物涂布抗性培养基。以无菌水处理松材线虫为对照,观察线虫体内菌落生长情况。若抗性培养基中长出菌落,挑取单菌落进行分离纯化培养,提取细菌DNA,进行PCR扩增及纯化,将得到的PCR纯化产物进行测序鉴定。
将灭菌玻璃纸覆盖于固体NA培养基上,以避免线虫进入培养基。将含有gfp荧光质粒的菌株NJSZ-13接种于玻璃纸上,置于培养箱内28 ℃培养。待菌落长满整个平板后,将松材线虫悬液(约1 000条线虫)分多点打到玻璃纸上,尽量使虫铺满平板,以无菌水为对照,每个处理重复3次。在培养皿底部划线,将培养皿平均分成20个小块,每隔24 h在解剖镜下随机选取5个小块,使用Zeiss荧光显微镜观察NJSZ-13在松材线虫虫体上的存在位置,每次观察至少30条松材线虫。
1.3 菌株NJSZ-13处理松材线虫后上清液的杀线活性测定
已有研究表明NJSZ-13菌悬液对松材线虫存在较高的致死作用,为明确NJSZ-13对松材线虫的作用方式,使用NJSZ-13处理松材线虫后的上清液测定杀线效果。在1.5 mL离心管中分别加入1 mL NJSZ-13菌悬液与50 μL松材线虫虫液(约2 000条),于25 ℃黑暗条件下静置48 h,10 000 r/min、4 ℃条件下离心取上清液,将1 mL上清液转入新的1.5 mL离心管中,加入50 μL松材线虫虫液(约2 000条),25 ℃黑暗条件下静置48 h后吸取20 μL(大约50条松材线虫)于显微镜下观察线虫死亡情况,以针刺法判定线虫的死亡,统计死虫数并计算松材线虫死亡率。分别以NJSZ-13菌悬液与无菌水处理松材线虫48 h后线虫的死亡率为对照,每处理重复5次。
线虫死亡率=(线虫死亡数/线虫总数)×100%。
在200 mL NJSZ-13菌悬液中加入大约10万条松材线虫,200 r/min、28 ℃条件下持续摇培4 d,10 000 r/min、4 ℃离心15 min,取上清,向上清中加入硫酸铵使饱和度达到100%,4 ℃条件下静置过夜,离心取沉淀物用1/10原滤液体积的PBS缓冲液进行溶解,溶解完成之后,将溶液装到截留分子量为8 000~14 000 Da的透析袋进行除盐,得到菌株NJSZ-13的胞外蛋白粗提液。将200 μL胞外蛋白粗提液和等体积线虫液(约1 000条松材线虫)混合,每隔24 h查看线虫存活情况。以PBS缓冲液和沸水浴30 min的胞外蛋白粗提液为对照,每处理重复5次。
1.4 菌株NJSZ-13处理松材线虫后菌体繁殖量的测定
将50 mL菌悬液与等体积线虫液(约5 000条/mL)混合。每隔24 h使用紫外分光光度计Lambda 365测定600 nm处的OD值,以OD值大小反应菌体繁殖量的变化。以同等浓度的菌悬液和松材线虫虫液为对照,每处理重复3次。
2 结果与分析
2.1 菌株NJSZ-13于松材线虫虫体上的存在位置
图1显示挑取NJSZ-13处理后的松材线虫加入无菌水离心取得的上清液涂布抗性平板后长出菌落(图1A),线虫体表彻底消毒(图1B)及研磨后(图1C)涂布抗性平板,均无菌落生长。挑取A组中的单菌落进行测序比对后发现,菌处理组的分离菌与蜡样芽胞杆菌NJSZ-13的序列结果一致,水处理组分离菌进行序列比对后发现该菌属于肠杆菌属(Enterobacterspp.)。结果表明,蜡样芽胞杆菌NJSZ-13未存在于松材线虫体内。
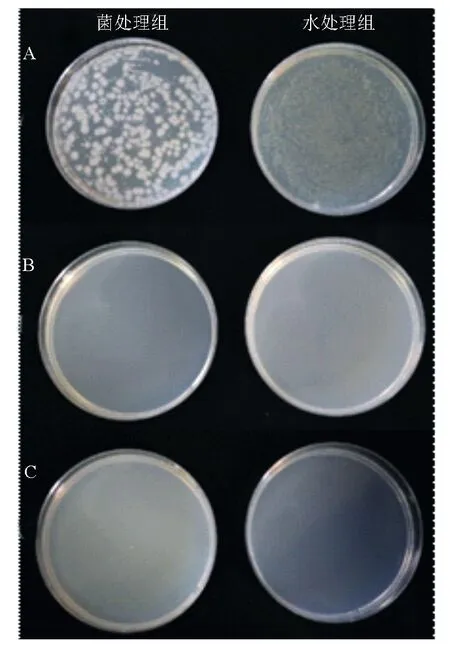
A为无菌水清洗线虫涂布结果;B为体表消毒后涂布结果;C为研磨虫液涂布结果。
gfp标记NJSZ-13菌株处理松材线虫后,线虫虫体荧光菌体数量随时间变化结果如图2所示,菌株NJSZ-13随着时间的推移逐渐覆盖虫体。gfp基因标记菌株处理24 h后,菌体附着于松材线虫体表(图2A)。处理48 h后,附着于松材线虫体表的菌体增多(图2B)。处理72 h,菌体已经遍布于松材线虫全身(图2C)。对照组经无菌水处理72 h后,松材线虫依然存活,线虫运动正常,体表无荧光(图2D)。结果进一步表明蜡样芽胞杆菌NJSZ-13作用位置位于松材线虫体表。
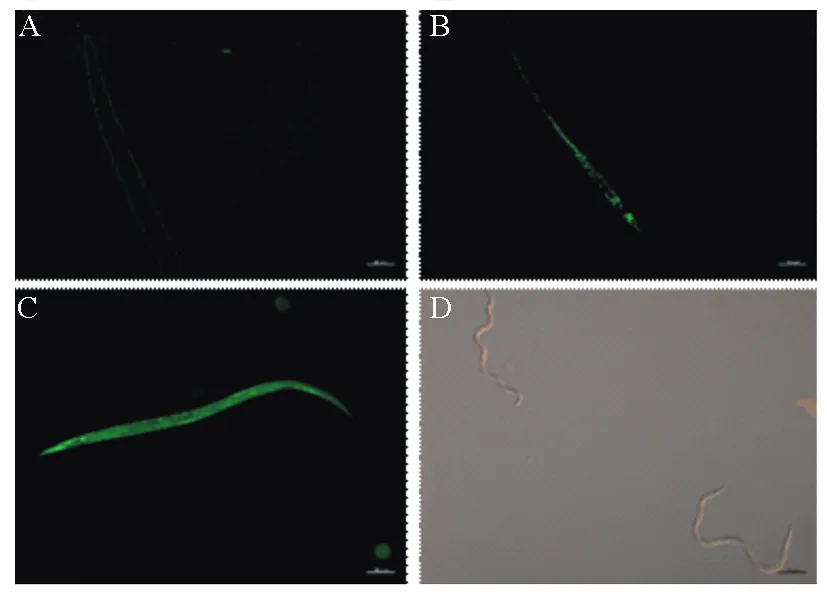
A为菌株NJSZ-13处理24 h,菌体附着于线虫体表;B为菌株NJSZ-13处理48 h,附着于松材线虫体表的菌体增多;C为菌株NJSZ-13处理72 h,菌体覆盖松材线虫全身;D为无菌水处理72 h,线虫运动正常。
2.2 菌株NJSZ-13处理松材线虫后上清液的杀线活性
NJSZ-13菌悬液处理松材线虫后的上清液杀线活性如表1所示。离心所得的上清液处理线虫48 h后,松材线虫死亡率为13.58%,与无菌水对照无显著差异,而NJSZ-13菌悬液处理松材线虫48 h后,松材线虫死亡率达到70.19%,与上清液相比差异显著。该结果表明NJSZ-13菌悬液处理松材线虫后的上清液对松材线虫几乎无杀线活性。要达到良好的杀线效果,菌株NJSZ-13需靠近甚至附着于松材线虫虫体。

表1 菌株NJSZ-13处理松材线虫后上清液的杀线活性
表2为菌株NJSZ-13处理松材线虫后的上清液中分离出的胞外蛋白粗提物对松材线虫的杀线活性结果。结果表明,菌株NJSZ-13的胞外蛋白粗提物具有较强的杀线活性,沸水浴处理后,杀线活性降低显著。随着处理时间的延长,胞外蛋白粗提物的杀线活性逐渐增强。处理24 h后,胞外蛋白粗提物的杀线率为50.31%,沸水浴处理后,杀线率降至13.23%,但仍然高于对照的1.92%;处理48 h和72 h后,胞外蛋白粗提物的杀线率分别提高至66.23%和82.48%,此时沸水浴处理的杀线率也分别增至23.88%和26.81%。表明菌株NJSZ-13主要通过分泌胞外蛋白酶杀死松材线虫。
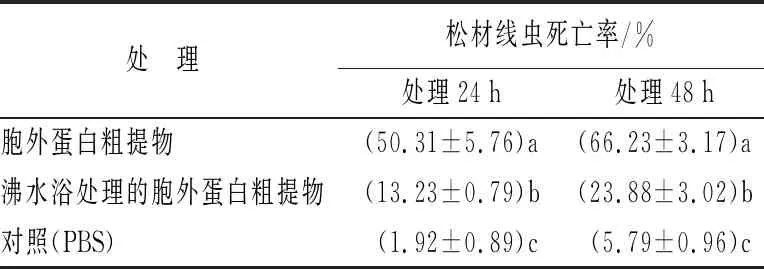
表2 蜡样芽胞杆菌NJSZ-13胞外蛋白粗提物的杀线活性
2.3 菌株NJSZ-13处理松材线虫后菌体繁殖量的变化
通过细菌悬浮液的吸光度可以反映细菌菌体的浓度。由图3可见,菌株NJSZ-13处理松材线虫AMA3后,菌虫混合液和单独菌悬液的吸光度总体上呈现前期下降明显,后期逐渐稳定的趋势,但自始至终两者都显著高于单独虫悬液的吸光度。同时发现,菌株处理松材线虫1 d后,菌虫混合液的吸光度开始高于单独菌悬液的吸光度,处理后3 d至10 d,菌虫混合液的吸光度始终显著高于单独菌悬液的吸光度。由此表明,菌株NJSZ-13能够以松材线虫虫体为营养进行生长繁殖。
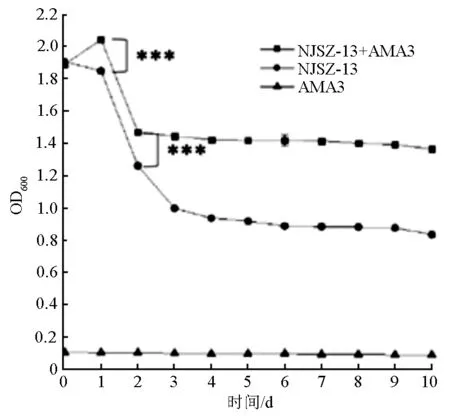
*** 表示经Tukey多重检验在P<0.001水平差异显著。
3 结论与讨论
在自然界中,松材线虫与微生物之间形成了十分复杂的关系。对于杀线虫微生物而言,提高线虫和其接触机会显然会提高其生防效果[11]。本试验发现,生防菌株NJSZ-13粘附在松材线虫体表,可通过分泌胞外蛋白酶杀死线虫以获取营养进行繁殖。
大多数芽孢杆菌其营养结构简单、生长繁殖速度快、易于存活定殖,形成抗逆性极强的内生芽孢,并且能够分泌一些抗菌蛋白[12]。目前关于杀线虫细菌侵染线虫机理的国内外报道比较少,大多数为产胞外水解酶(几丁质酶、丝氨酸蛋白酶、中性蛋白酶等)细菌[13]。1987年有学者首次发现苏云金芽孢杆菌的伴胞晶体蛋白毒素(Cry5B、Cry6A、Cry14A、Cry21A)能杀死植物寄生线虫[14]。Huang et al.发现侧孢短芽孢杆菌(Brevibacilluslaterosporus)G4菌株和嗜麦芽糖寡养单胞菌(Stenotrophomonasmaltophilia)G2菌株都能够分泌蛋白酶,纯化后的蛋白对全齿复活线虫(Resurrectednematodes)和松材线虫均具有高效杀线活性[15-16]。本研究发现,菌株NJSZ-13处理松材线虫后的上清液中分离出的胞外蛋白粗提物对松材线虫具有较强的杀线活性,随后将胞外蛋白粗提物进行沸水浴处理后,杀线活性显著降低,表明菌株NJSZ-13主要通过分泌胞外蛋白酶杀死松材线虫。这与Huang et al.研究结果相似,不同的是大多数研究者分离出的蛋白酶均是从细菌发酵滤液中所得,本研究中的蛋白酶为菌株NJSZ-13菌体水悬液处理松材线虫后的上清液中分离所得,这与菌株NJSZ-13菌悬液具有较高的杀线活性有关,后续工作中对分离到的胞外蛋白酶的结构与功能还需进行深入研究。
线虫表皮由蛋白质和甲壳素组成,外层被一层蛋白膜覆盖,这是保护线虫免受环境破坏的有效屏障[17]。因此,蛋白酶、胶原酶和几丁质酶在线虫生物防治中一直受到重视。本研究证明菌株NJSZ-13主要通过分泌胞外蛋白酶杀死松材线虫,为利用细菌进行高效防治松材线虫奠定了基础,今后利用生物技术方法克隆毒性蛋白酶基因、构建杀线虫工程菌和转基因植物也可能成为防治松材线虫的有效途径。在可持续发展的今天,利用细菌开发生物制剂,防治松材线虫,已经越来越凸显出其研究和应用价值。蜡样芽胞杆菌中杀线虫蛋白酶对松材线虫毒杀活性的发现,与传统的化学杀线虫剂相比有着无可比拟的优势。通过基因工程手段改良菌株提高其毒力,可以使杀线细菌在自然环境中更好地发挥作用,也有望获得对松材线虫有良好防治效果的生防制剂,对深入研究及开发防治松材线虫的商品化生防细菌具有重要意义。随着研究的不断深入,利用蛋白酶防治松材线虫应用前景将非常广阔,对其进行深入的研究对于开发新的松材线虫生防细菌制剂以及发展新的生防战略具有重要意义。
