HP-β-CD对紫外光谱法检测表面活性剂复配体系中NP-40的抗干扰作用*
2023-01-10石东坡许慧华朱生华
吴 浩,石东坡,许慧华,姜 怡,李 赓,朱生华,王 齐
(石油石化污染控制与处理国家重点实验室(长江大学),湖北荆州 434023)
0 前言
表面活性剂驱是低渗透油田和中老油田保产能、提效率的主要技术之一。随着我国越来越多的油田相继进入开采中后期,强化表面活性剂驱技术将为低渗透油田及中老油田的高效开发提供新动力[1]。烷基酚聚氧乙烯醚(NP-40)可将油水界面张力降至10-3mN/m 超低数量级,且具有较强的抗盐性能,是当前表面活性剂驱最常用的表面活性剂之一。在三次采油过程中,通常将NP-40 与其它表面活性剂进行复配[2-4]以进一步提高采油效果。
准确检测表面活性剂复配体系中NP-40 含量,是了解NP-40等表面活性剂组分在油藏地层吸附和运移规律的基本方法,对于准确评估表面活性剂复配体系驱油效果具有重要意义。
表面活性剂含量的检测方法有光谱法[5-8]、表面张力法[9-11]和液相色谱法[12-16]等,这些方法一般能准确检测无干扰或干扰作用较弱的NP-40浓度。郭文建等[7]通过高效液相色谱-荧光检测法测定了水相中8种NP系列表面活性剂含量,但是水样需要酸化至pH 值为2.0~3.0,表面活性剂回收率为92.1%~118.0%。陈松辉等[13]采用液相色谱-质谱法测定有机农药中NP 系列表面活性剂含量,检测精度可低至50 μg/L,但是回收率仅为81.8%~115.5%。赵陈晨等[14]通过二氯甲烷-乙酸乙酯混合溶剂超声预提取,采用超声萃取-高效液相色谱法检测土壤中的NP 系列表面活性剂含量,该方法的灵敏度高,检测误差为5.1%~12.1%。这些研究结果均表明,NP-40能与其它表面活性剂组分之间产生较强的协同作用[17-18],导致光谱法、液相色谱法等均难以准确检测表面活性剂复配体系中的NP-40含量。环糊精化学的系统研究表明了环糊精可以提供一个疏水性空腔,自发地包结各种尺寸及结构合适的客体[19],环糊精作为遮蔽剂消除分子间协同干扰作用在某些领域已有报道[20-21]。Solomonov 等[20]通过环糊精来调控芳香族表面活性剂Triton X-114 胶束配位簇的稳定性。宁爱民等[21]研究了β-环糊精对“溶菌酶/十六烷基三甲基溴化铵”复合体系构象的破坏能力,由于环糊精内腔的遮蔽作用,明显降低了溶菌酶与十六烷基三甲基溴化铵之间的相互作用。本文以十二烷基硫酸钠(SDS)为复配组分配制NP-40/SDS表面活性剂复配体系,通过添加适量的羟丙基-β-环糊精(HP-β-CD)以降低SDS 对NP-40 的协同作用,再利用紫外光谱法测定NP-40/SDS 表面活性剂复配体系中NP-40 浓度,以期显著提高复配体系中NP-40浓度检测的准确性。
1 实验部分
1.1 材料与仪器
烷基酚聚氧乙烯醚(NP-40),有效物含量99%,上海麦克林生化科技有限公司;十二烷基硫酸钠(SDS),分析纯,天津北联精细化学品开发有限公司;羟丙基-β-环糊精(HP-β-CD),含量≥98%,国药集团化学试剂有限公司;氯化钠,分析纯,国药集团化学试剂有限公司。
AVANCE III HD 500MHz 型核磁共振波谱仪,瑞士Bruker公司;NICOLET 6700型红外光谱仪,美国Thermo Fisher Scientific 公司;TU-1900 型紫外可见分光光度计,北京普析通用仪器有限责任公司;DZ-2BC 型真空干燥箱,天津市泰斯特仪器有限公司。
1.2 实验方法
(1)HP-β-CD与NP-40包结物制备
称取2.00 mmol HP-β-CD 和2.00 mmol NP-40,加水搅拌,完全溶解后置于恒温干燥箱(温度设为80 ℃)中干燥,待水分完全蒸发后即可得到HP-β-CD/NP-40包结物。
(2)测试与表征
先对一系列浓度的NP-40水溶液进行紫外光谱测试,再向NP-40水溶液中加入一定量的SDS,并进行紫外光谱测试,分析SDS 对NP-40 的吸光度及复合物的临界胶束浓度的影响。在NP-40/SDS 复配体系中加入HP-β-CD,测定溶液的紫外光谱,分析HP-β-CD对NP-40紫外光谱的抗干扰作用。
采用等摩尔连续变化法(Job's 法)测定HP-β-CD与NP-40包结物的包结比。再按照此包结比作出HP-β-CD/NP-40 在水溶液中的定量标准曲线,测定NP-40/SDS 复配体系中NP-40 的回收率。并在复配体系中加入NaCl,研究该方法的抗NaCl性能。最后对HP-β-CD/NP-40 包结物进行红外光谱表征(FT-IR)和核磁共振氢谱表征(1H-NMR,D2O 作为溶剂)分析HP-β-CD 与NP-40 之间的作用关系。
2 结果与讨论
2.1 SDS对NP-40紫外光谱检测干扰分析
浓度为0.50 mmol/L 的SDS 水溶液、浓度为0.20、0.25 mmol/L 的NP-40 水溶液以及0.20、0.25 mmol/L NP-40 +0.50 mmol/L SDS 的复配水溶液的紫外光谱图见图1。由图1 可知,在240~320 nm波长范围内,NP-40的最大吸收波长为275 nm,SDS无明显吸收峰。对比图1 中的曲线b 和c、d 和e 可知,在NP-40 水溶液中加入0.50 mmol/L SDS 后,0.20、0.25 mmol/LNP-40 溶液在275 nm 处的吸光度分别由0.281、0.345增加至0.303、0.378,增幅分别为7.8%及9.6%,表明了SDS对NP-40的紫外光谱产生了明显干扰。这可能是因为SDS与NP-40均含有憎水基团,在水溶液体系中,SDS分子与NP-40分子会相互聚集从而产生协同作用。

图1 SDS、NP-40及SDS/NP-40复配水溶液的紫外光谱图
2.2 SDS 加量对NP-40/SDS 复合物临界胶束浓度的影响
向系列NP-40 水溶液中加入一定量(0.20、0.50 mmol/L)的SDS 后进行紫外光谱测试,NP-40 浓度与吸光度(波长275 nm)的对应关系见图2。由图2可知,NP-40 在纯水中的临界胶束浓度ccmc为0.237 mmol/L,加入0.20 及0.50 mmol/L 的SDS 后,ccmc分别降至0.227、0.224 mmol/L。这可能是因为在水溶液中SDS 分子与NP-40 分子共同聚集形成了胶束,SDS分子参与了胶束化过程,导致胶束结构体中也含有一部分SDS 分子,形成了混合胶束,从而降低了胶束中NP-40浓度[22]。由于SDS能引起复合物中NP-40的ccmc值发生明显变化,因此采用紫外光谱法难以准确测定NP-40浓度,需进一步修正。
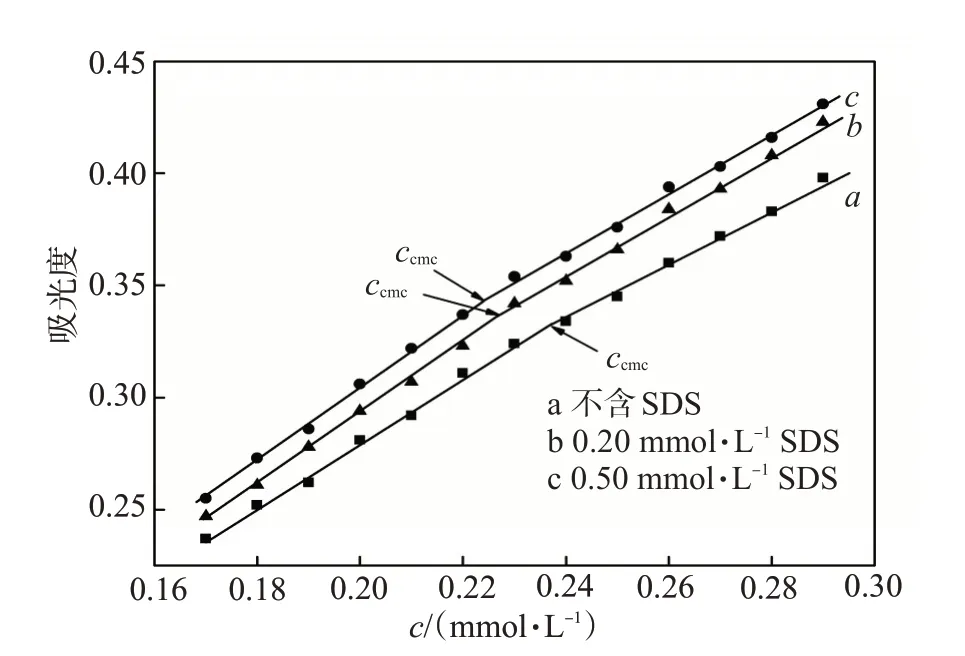
图2 SDS对复合物中ccmc的影响
2.3 HP-β-CD消除SDS对NP-40紫外光谱检测干扰
分别在浓度为0.25 mmol/L 的NP-40 水溶液及0.25 mmol/LNP-40/0.50 mmol/L SDS 复配溶液中加入0.50 mmol/L HP-β-CD 后的紫外光谱图见图3。图3 表明,在0.25 mmol/L 的NP-40 溶液加入0.50 mmol/L 的HP-β-CD 后,吸光度由0.345 增至0.379,可见HP-β-CD 可适当增强NP-40 的吸光度,进而提高紫外光谱法的检测灵敏度。在0.25 mmol/L NP-40/0.50 mmol/L SDS 复配溶液中加入0.50 mmol/L HP-β-CD后,吸光度由0.378变化为0.381,与在0.25mmol/L的NP-40溶液加入0.50 mmol/L 的HP-β-CD 后的吸光度相近。这说明加入HP-β-CD后,可消除SDS对紫外光谱法检测NP-40的干扰。

图3 在NP-40及NP-40/SDS复配溶液加入0.50 mmol/L HP-β-CD后的紫外光谱图
HP-β-CD 是一种具有不对称疏水空腔的大环化合物,在水相中极易与NP-40 分子的憎水性苯环基团形成包结物。相比于SDS 分子,NP-40 分子中苯环基团与HP-β-CD分子内腔尺寸适配度相符,可以形成稳定的包结物。包结物形成后,位于HP-β-CD分子内腔的NP-40分子处于被隔离的疏水微环境中不易受到水溶液中SDS分子的影响,从而可以消除SDS对紫外光谱法检测NP-40的干扰。一般认为,NP-40 在水溶液中可优先与HP-β-CD 形成包结物,从而中断了与SDS 之间的作用,并且可阻止NP-40分子聚集形成胶束[20]。
2.4 HP-β-CD消除SDS对NP-40/SDS复合物ccmc的影响
在系列NP-40溶液中分别加入0.20、0.50 mmol/L HP-β-CD 以及0.50 mmol/L HP-β-CD 和0.50 mmol/L SDS 后进行紫外光谱测试,NP-40 浓度与吸光度(波长275 nm)的对应关系见图4。由图4 可知,在NP-40 溶液中加入0.20、0.50 mmol/L HP-β-CD 后,NP-40 的吸光度随浓度的变化曲线均未出现拐点,这表明在NP-40 溶液加入HP-β-CD 后并未形成胶束,且NP-40 的吸光度随HP-β-CD 浓度的增加而增大。另外,SDS 的加入并未使NP-40 溶液的吸光度产生明显变化,曲线b、c基本重合,可见,NP-40分子已全部与HP-β-CD 分子形成了包结物,阻断了NP-40 分子与SDS 分子之间的相互作用,消除了复配溶液中SDS 对紫外光谱检测NP-40 的干扰。此外,NP-40 分子能进入HP-β-CD 分子内腔形成包结物,包结体如分子一般均匀分布于水溶液中,致使NP-40分子无法再相互聚集,复合物体系表现出“性质均一”的溶液状态[23],阻止了NP-40 形成复合物胶束。

图4 HP-β-CD对NP-40/SDS复合物中NP-40 ccmc的影响
2.5 HP-β-CD与NP-40包结物包结比分析
为了研究HP-β-CD与NP-40形成包结物时的包结比,采用等摩尔连续变化法(Job's)对HP-β-CD/NP-40 包结物进行分析。保持水溶液中NP-40 与HP-β-CD总浓度为0.50 mmol/L,逐渐改变NP-40的摩尔分率,检测时以相同浓度的NP-40 水溶液为检测背景,扣除背景后,NP-40在HP-β-CD水溶液中的吸光度随摩尔分率的变化如图5 所示。由图5 可知,当NP-40的摩尔分率为0.5时,该Job's曲线出现最大值,表明在水溶液中NP-40 与HP-β-CD 按物质的量比1∶1进行包结。

图5 NP-40在HP-β-CD溶液中的Job’s曲线
2.6 HP-β-CD消除SDS对NP-40干扰验证试验分析
在一系列浓度的NP-40 溶液中按物质的量比1∶1 加入HP-β-CD,测定NP-40 在波长275 nm 处的吸光度,作NP-40 在HP-β-CD 水溶液中的定量标准曲线,见图6。

图6 NP-40在HP-β-CD溶液中的定量标准曲线
分别采用NP-40 在纯水中的定量标准曲线(图2中曲线a)及图6的定量标准曲线,由浓度测定值与浓度实际值之比计算系列已知浓度的NP-40/SDS复配溶液中NP-40 的回收率,结果如表1 所示。因油田地层水通常含有无机矿物离子,且主要组分一般为NaCl,故同步研究了在NaCl 溶液中,HP-β-CD消除SDS 对NP-40 检测的干扰效果。由表1 可知,在纯水中建立的NP-40定量标准曲线难以准确检测NP-40/SDS 复配溶液中NP-40 的含量,计算所得的回收率为105.00%~110.00%。而按NP-40 与HP-β-CD 按物质的量比1∶1 加入HP-β-CD 后,采用图6 的定量标准曲线检测复配溶液中NP-40 浓度时,方法回收率为99.09%~100%,误差均在0.91%以内,与未添加HP-β-CD相比,NP-40浓度的检测准确度显著提高。在紫外光谱法检测NP-40/SDS 复配溶液中NP-40 的含量时,加入HP-β-CD 能够有效消除SDS 所带来的干扰,而且NaCl 浓度在20.0~100.0 mg/L 时,所测NP-40 的回收率为98.18%~100.00%,亦有较高的准确度。表明了在具有一定矿化度的NaCl水溶液中,采用紫外光谱法也能准确检测NP-40/SDS复配溶液中NP-40浓度。
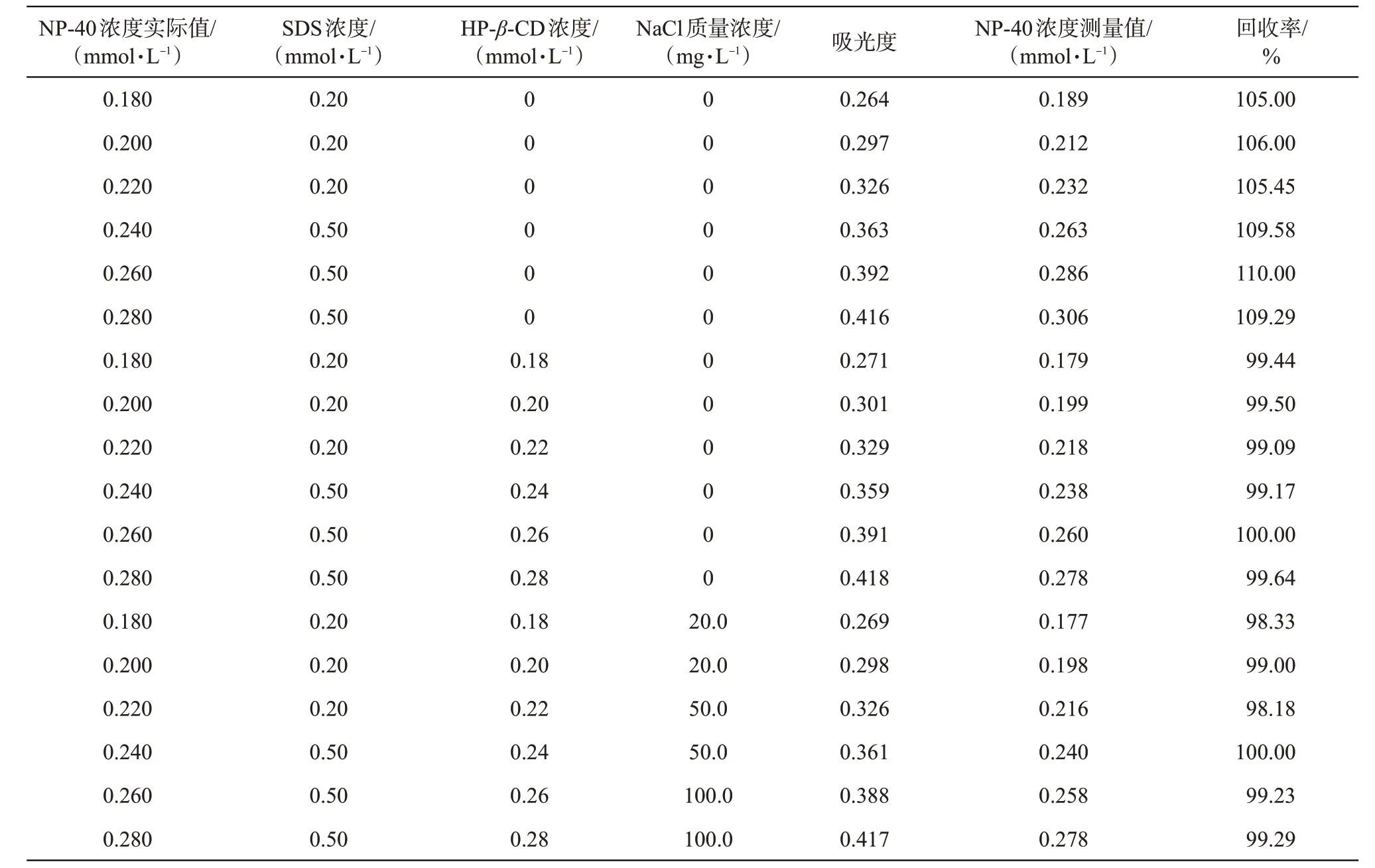
表1 NP-40/SDS复配溶液中NP-40定量验证结果
2.7 HP-β-CD/NP-40包结物结构及键合作用分析
图7为HP-β-CD及HP-β-CD/NP-40包结物的红外光谱图。HP-β-CD 与NP-40 形成包结物后,在1095 cm-1处,属于HP-β-CD分子中C—O—C基团的振动峰强度发生了明显改变,表明了NP-40 分子进入了HP-β-CD分子内腔;在1158 cm-1处,属于HP-β-CD 分子窄口径处的—CH2OH 基团的弯曲振动峰强度发生了较大改变,表明了包结物结构中,NP-40分子的亲水基团靠近HP-β-CD分子窄口径一端;在1459 cm-1处,属于HP-β-CD 分子宽口径处的—OH 基团的弯曲振动峰强度也发生了一定改变,表明包结物结构中也有较少部分NP-40分子的亲水基团靠近HP-β-CD分子宽口径一端。
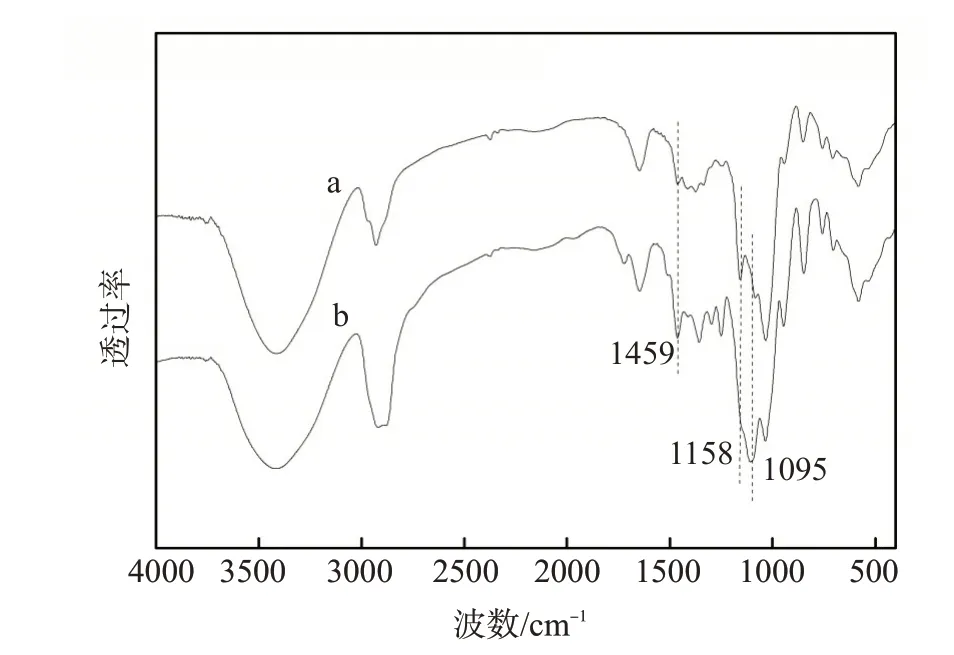
图7 HP-β-CD(a)和HP-β-CD/NP-40包结物(b)的FT-IR谱图
HP-β-CD 和HP-β-CD/NP-40 包结物的1H-NMR分析如图8 所示,1H—6H 的化学位移值列于表2。由图8 和表2 可知,NP-40 与HP-β-CD 形成包结物后,HP-β-CD分子中质子峰的化学位移值均发生了一定改变,其中属于HP-β-CD 分子空腔外侧的1H、2H 和4H 的质子峰化学位移值变化较小,而属于HP-β-CD 分子空腔内侧的3H、5H 的质子峰化学位移值变化较大,表明NP-40 分子已经进入HP-β-CD分子的内部,同时,位于HP-β-CD 分子窄口径处的6H 的质子峰化学位移值变化较大,也说明了NP-40 分子的亲水基团靠近HP-β-CD 分子窄口径一端。

表2 HP-β-CD及与NP-40形成包结物后其分子中1H—6 H的化学位移值
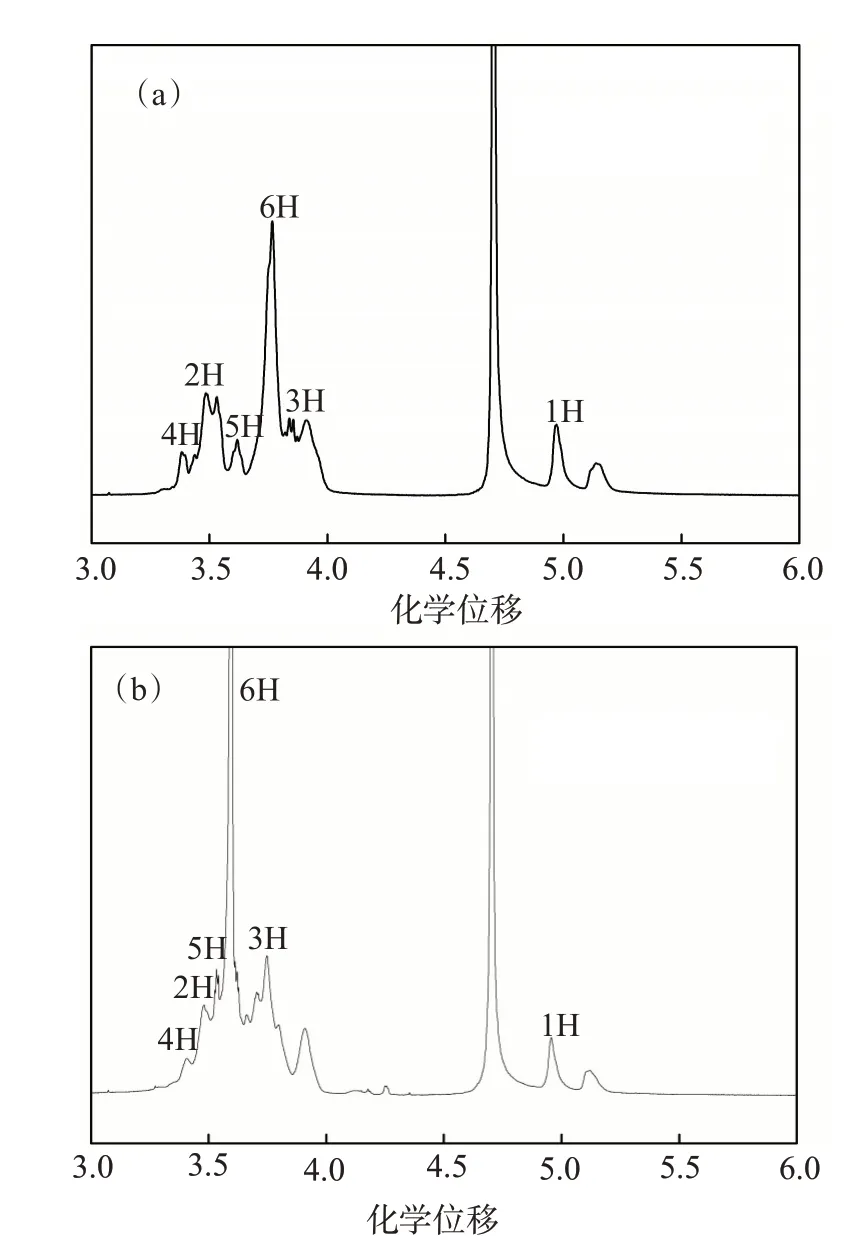
图8 HP-β-CD(a)和HP-β-CD/NP-40包结物(b)的1H-NMR谱图
由以上分析结果可知,在NP-40/SDS 复配溶液中按NP-40与HP-β-CD物质的量比1∶1加入HP-β-CD后,HP-β-CD优先与NP-40形成包结物,阻止了混合胶束的形成,从而使紫外光谱法能够准确检测出复配溶液中NP-40 的浓度,回收率为99.09%~100%。NP-40 与HP-β-CD 包结物可能的形成过程如图9所示。

图9 NP-40/SDS复配溶液中HP-β-CD/NP-40包结物可能的形成过程
3 结论
在NP-40/SDS 复配溶液中,SDS 会对NP-40 的吸光度和ccmc产生明显干扰,致使传统的紫外光谱法无法准确检测复配体系中的NP-40浓度。
在水溶液中,NP-40 分子优先进入HP-β-CD 分子内腔,形成物质的量比1∶1的包结物,二者之间的包结作用有效阻止了复配体系中NP-40 形成胶束,且NP-40分子难以再与SDS分子保持稳定的协同作用,HP-β-CD能有效地消除复配体系中SDS对NP-40的干扰作用。
经HP-β-CD消除干扰后,采用紫外光谱法可准确检测复配体系中NP-40 含量,回收率99.09%~100%,在具有一定矿化度的NaCl 溶液中该方法亦可适用。
