纤维素降解菌株的筛选、鉴定及其酶活力的测定
2023-01-09伊国云
伊国云,程 亮
(1.青海大学农林科学院,青海 西宁 810016;2.青海省农业有害生物综合治理重点实验室,青海 西宁 810016)
天然纤维素约占植物总干重的30%-50%,是自然界中产量最为丰富的可再生资源之一[1-2]。从纤维素结构成分来看,它是由D-吡喃葡萄糖以β-1,4-糖苷键连接起来的高分子长链状多糖,其分子式为(C6H10O5)n,n是指葡萄糖残基的聚合度,n值越大纤维素单链就越长[3-4],随着n值的不断增大不同葡萄糖残基中吡喃环基团之间由于范德华力的作用,使微纤丝形成致密的晶体结构,表现出强极性和刚性,因此难溶于水和弱酸弱碱,严重阻碍对纤维素的可再生性利用[5-6]。
从目前现有的纤维素利用手段来看主要方法包括物理方法、化学方法、微生物法[7]。物理方法如蒸汽爆破法、高压膨化法、机械粉碎法,但主要作用于纤维素无定型区,降解效率很低;化学法如酸碱液处理法、氨化处理法,但对环境污染较为严重,降解产物易变性且不彻底[8-9];微生物降解即便降解速率较慢,但能降解为可利用性单糖,且反应条件温和生产成本低,有利于大面积应用[10-12]。因此,开发高效降解纤维素的微生物菌剂已成为当今关注的热点[13-14]。本研究以原始森林土壤为菌源,筛选优势菌株,对其进行滤纸条崩解能力和纤维素酶测定,筛选产酶能力佳的菌株,为开发高效降解纤维素菌剂及优质菌源提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
使用蛇形采样法从青海省北山、大坂山等处采集森林土,装入聚乙烯塑料袋中,外部贴标签标明序号,在4℃冰箱保存备用。
1.1.2 培养基
富集培养基:羧甲基纤维素钠(CMC-Na)2.0g,K2HPO41.0g,NaCl 5.0g,NaNO33.0g,MgSO4·3H2O 0.5g,FeSO4·7H2O 0.01g,琼脂20.0g,去离子水1L。
滤纸条培养基:1cm×2cm滤纸条,KH2PO41.0g,NaCl5.0g,FeCl30.01g,MgSO40.3g,NaNO32.5g,CaCl20.1g,1000ml蒸馏水。
细菌种子培养基:牛肉膏3.0g,蛋白胨10g,KH2PO41.0g,NaCl5.0g,pH7.0,去离子水1L。
液体产酶培养基:CMC-Na20.0g,(NH4)2SO42.0g,KH2PO42.0g,FeSO4·7H2O0.01g,CaCl20.1g,NaCl5.0g,去离子水1000ml。
LB培养基:NaCl10.0g,蛋白胨10.0g,酵母膏5.0g,琼脂15.0g,去离子水1000ml。
上述培养基均121℃,101KPa灭菌20min。
1.2 试验方法
1.2.1 降解菌的富集与分离
称取森林土5g于装有100ml已灭菌无菌水的250ml锥形瓶中,150r/min振荡1h,使样品完全分散,静置后取上清液1ml加入装有9ml无菌水的试管中,得到1×10-1稀释液,依次连续稀释,制成1×10-2、1×10-3、1×10-4浓度梯度稀释液,接种到富集培养基上,用涂布棒涂布均匀,于恒温恒湿培养箱中培养,多次继代纯化培养,直至得到纯的单菌株。
1.2.2 降解菌的初筛
采用刚果红染色剂培养菌株:将分离纯化得到的不同菌株接转到富集培养基上,25℃恒温培养72h。待生长出完整旺盛菌落时用0.2mg/ml刚果红染色,测量水解圈直径(D)和菌落直径(d),计算降解效果(D/d),每株菌株重复测量3次,菌株纤维素水解能力与D/d值呈正比,根据比值选取高产酶菌株。
滤纸的崩解实验:将水解能力较好的不同菌株置于50ml的种子培养基中,在25℃、180r/min摇床中振荡培养2d制成种子液,按2%(W/V)的接种量转接至滤纸条培养基中,在25℃、150r/min下培养15d;空白组不接种菌液。每组3个重复,根据滤纸的崩解情况来初步判断菌株降解纤维素的能力。降解指标如下:+,滤纸表面膨胀不整齐;++,滤纸表面膨胀并四角下弯;+++,滤纸形状已改变;++++,滤纸完全成糊状。
1.2.3 降解菌的复筛1.
2.3.1 粗酶液的制备
将复筛获得的单菌落于50mL液体产酶培养基中,在25℃、180r/min条件下振荡培养72h,获得的发酵液在4℃、6000r/min条件下离心10min,上清液即为粗酶液,用于酶活力的测定。
1.2.3.2 标准曲线的绘制
分别取葡萄糖标准液(1mg/ml)0、0.2、0.4、0.6、0.8、1.0、1.2ml于25ml试管中,分别准确加入DNS试剂1.5ml,沸水浴5min,取出后待冷却至室温,使用蒸馏水补足至20ml,颠倒混匀,540nm波长下测定吸光度。以吸光度为纵坐标,葡萄糖含量为横坐标,绘制出标准曲线,葡萄糖标准曲线见图1。测定葡萄糖标准曲线为:y=0.9197x-0.1488(R2=0.9985)。

图1 葡萄糖标准曲线
1.2.3.3 纤维素酶活的测定[15]:
(1)羧甲基纤维素酶酶活测定:取0.5mL稀释后的粗酶液至试管中,加1mL1%的CMC-Na溶液和0.5mL的磷酸缓冲液(0.1mol/ml,pH值6.0)混匀,于50℃水浴反应30min,取出,加入1.5ml DNS试剂,沸水浴5min中止反应,冷却至室温,以100℃煮沸10min失活的粗酶液作为空白对照组,采用3,5-二硝基水杨酸比色法在540nm下测定还原糖的量,计算酶活。
(2)滤纸酶活性测定:取1cm×2cm的滤纸条作为底物,加入1.5ml pH 6.0的磷酸缓冲液和0.5ml粗酶液,于50℃水浴条件下反应60min后终止反应,余下操作与羧甲基纤维素酶的处理方式相同,在540nm下测定其OD540nm值。
(3)外切-β-葡聚糖酶活性测定:在试管中加入1%的微晶纤维素底物溶液和0.5ml缓冲液,再加入0.5ml酶液,于50℃水浴锅中反应30min,剩余操作与羧甲基纤维素酶的处理方式相同。以每分钟生成相当于1μg的葡萄糖为一个酶活力单位。
酶活力X=1000×G/(V×T)
式中,X是样品的酶活力(U/ml);G是标准曲线上光吸收值所对应的葡萄糖毫克数;V是加酶量(ml);T为作用时间(min)。
1.2.4 分子生物学鉴定
菌株DNA提取:按照细菌基因组提取试剂盒的操作步骤提取菌株的基因组DNA,提取的DNA使用NanoDrop2000检测浓度(μg/ml)及纯度(A260/A280),使用1.0%的琼脂糖凝胶电泳检测DNA完整性。PCR扩增及测序:以提取的细菌基因组DNA为模板,选用细菌通用引物(上游引物27F:5′-AGTTTGATCMTGGCTCAG-3′,下游引物1492R:5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。扩增体系(25μl):DNA模板0.5μl、上下游引物各0.5μl、PCR Master Mix 12.5μl、dd H2O补足25μl。反应程序:94℃ 4min,94℃ 45s,55℃ 45s,72℃ 60s,30个循环;72℃延伸10min。PCR产物用1%琼脂糖凝胶电泳检测,取阳性样品送至生工生物工程(上海)股份有限公司测序。将测序所得序列提交Gen-Bank并进行BLAST序列同源性比对,采用MEGA7.0软件以邻接法构建系统发育树,进行1000次Bootstraps检验,比较生防菌株与其他近缘菌株的亲缘关系。
2 结果与分析
2.1 纤维素降解菌的分离与筛选
以森林土为菌源,经过多次富集培养和分离纯化,初步筛选的得到24株菌,将筛选的菌株再接种到刚果红培养基上,在刚果红培养基上的生长情况见图2。11个菌株均产生大小不同的水解圈,筛选的11株菌对纤维素均具有一定降解能力,由表1可知,11株菌的D/d为1.91-6.28,其中GG-5-1、H36-7-4、AM-1-4的D/d分别为4.0、6.28、3.56,高于其它菌株,之后对这三个菌株做进一步的滤纸条试验。

图2 11株菌在刚果红培养基上的生长情况

表1 纤维素降解菌水解圈与滤纸崩解情况
2.2 滤纸条崩解试验研究
接种GG-5-1、H36-7-4、AM-1-4菌液的培养瓶中,菌株AM-1-4整体呈现为淡黄色浑浊液,滤纸表面蓬松粗糙,四角已被崩解且整体厚度较对照薄,滤纸崩解效果为+++;菌株H36-7-4浑浊度比AM-1-4低,整体呈乳白色,滤纸边缘均变薄,滤纸崩解效果为+++。菌株GG-5-1的浑浊度是最高的,滤纸成边缘薄小段,滤纸崩解效果为++++。表现出高崩解效果。
2.3 纤维素酶活性测定
选取滤纸条试验效果最好的GG-5-1为目的菌株,分别测定羧甲基纤维素酶、滤纸酶和外切-β-葡聚糖酶酶活。每隔24h测定1次,连续测定7d,分析产酶特点。由图3可知,羧甲基纤维素酶活在第3d时达到最大值,为12.96U/ml,外切-β-葡聚糖酶在第3d时达到最大值,为12.96U/ml,滤纸酶在第2d时达到最大值,为9.00U/ml。

图3 菌株GG-5-1纤维素酶酶活测定结果
2.4 GG-5-1菌株分子生物学鉴定
以GG-5-1菌株基因组为模板,扩增获得GG-5-1菌株的16S rDNA基因,序列长度为1485bp。如图4所示,基于16S rDNA基因序列的系统发育分析结果表明,GG-5-1菌株与多株蕈状芽胞杆菌(Bacillusmycoides)相似性最高,达到99%,并与蕈状芽胞杆菌登录号为KR233759.1、ON287188.1、MT586023.1、KR233754.1以及OL354433.1的为同一分支。基于16S rDNA基因序列的系统发育分析结果,将GG-5-1鉴定为蕈状芽胞杆菌(Bacillusmycoides),命名为B.mycoidesGG-5-1。
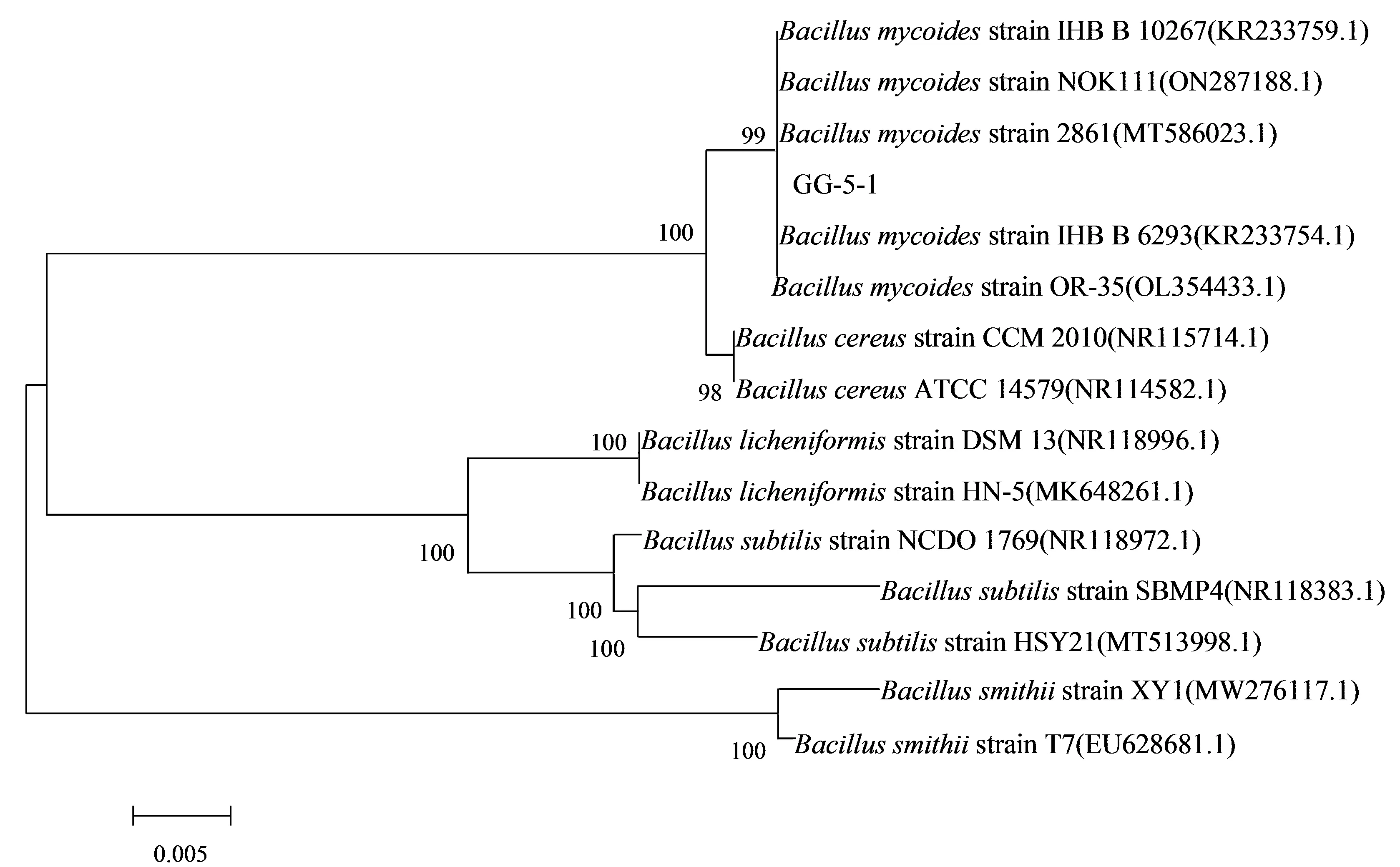
图4 基于16S rDNA基因序列以邻接法构建菌株GG-5-1及其相关菌株的系统发育树
3 结论与讨论
微生物降解法因其能够提高作物秸秆利用效率、保护环境且耗能小、已被广泛关注[16]。微生物降解纤维素主要分为3大类:细菌、真菌和放线菌[17],其中纤维素降解细菌在生长的过程中分泌大量胞外酶,促进纤维素的降解。据报道,纤维素的降解主要是依赖于微生物产生的降解酶,主要包括内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶[18]等多种酶相互协同,可安全无毒害性的作用于纤维素分子的结晶区,彻底解成小分子寡糖和葡萄糖[19]。郜道玉[20]将从奶牛粪污异位发酵床高温期物料中筛选到地衣芽孢杆菌(Bacilluslicheniformis)a4和a8在摇瓶培养5d后,发现其羧甲基纤维素酶活力分别为168.92和114.98U/ml。黄颖婕等[21]从牛粪秸秆堆肥中分离获得的解淀粉芽孢杆菌(Bacillusamyloiquefaciens)X7,10d内完全崩解滤纸条,37℃培养3d,纤维素酶活为40.02U/ml。
芽孢杆菌属是自然界分布极广的一类细菌,因具有芽孢、耐碱、耐酸、耐高温、适应能力强等特点,广泛应用于堆肥,其中蕈状芽孢杆菌还具有嗜热、兼性厌氧和降解有害物质等特性[22]。本研究筛选得到的1株降解菌,25℃恒温培养经过多次纯化后生长较好,具有较强的产酶和降解纤维素能力,但有关蕈状芽孢杆菌GG-5-1菌株高产酶活性的报道较少,具有较高的研究价值。关于菌株的生化特性、产酶条件及其在秸秆降解过程中降解纤维素与生产运用的效果有待进一步研究。
本研究从原始森林土中分离出11株纤维素降解菌,经过刚果红培养基和滤纸崩解试验筛选,得到1株纤维素降解能力较好的菌株GG-5-1,进一步对这1株菌株的CMC酶活力进行测定,其CMC酶、外切-β-葡聚糖酶和滤纸酶活力分别为12.96、12.96和9.00U/ml,经过分子生物学鉴定,初步确认其为芽孢杆菌属菌B.mycoides。
