富硒黄山贡菊多糖的提取及其抗氧化活性研究
2023-01-09许丹丹汪昌保杜冬生张金铭戴翠红雷晓璐卢留颖胡瀚洋
杭 华,许丹丹,汪昌保,杜冬生,张金铭,戴翠红,雷晓璐,卢留颖,胡瀚洋
(1.安徽师范大学生命科学学院,安徽 芜湖 241000;2.安徽师范大学生态与环境学院,安徽 芜湖 241000)
菊花(Chrysanthemum morifoliumRamat.)是菊科植物菊的头状花序,味甘、性寒,具有清热、健肝、明目、解毒、改善心血管健康、防止氧化损伤和抑制炎症等功效[1],其为2009年卫生部首批批准的药食同源的植物。2015年版《中国药典》将杭菊、亳菊、滁菊、贡菊、怀菊等归为药用菊花,菊花可用于药用、保健和功能性食品等,因此受到青睐[2]。黄山贡菊亦称“徽州贡菊”,产自著名的旅游胜地黄山地区,其既有观赏价值,也是药食两用的保健品。菊花的主要成分有挥发性油、黄酮类化合物、绿原酸和多糖类等。植物多糖具有抗氧化、降血糖、抗衰老、调节脂代谢、提高免疫力和抗病能力等功能,使其成为研究的热点[3]。菊花多糖作为菊花主要活性成分,具有调节免疫力、抗氧化(清除活性自由基)等作用,开展菊花多糖的研究具有重要的经济和社会价值[4]。
微量硒元素对人体的健康至关重要,其具有抗病毒、抗癌与提高机体免疫等能力[5]。无机硒对人体是有毒的,需要转化为有机硒来被人体利用;有机硒主要以硒多糖、硒蛋白等形式存在。硒多糖来源有天然硒多糖、微生物硒多糖和合成硒多糖[6],其中通过植物的生物富集作用来转化有机硒,是目前最有效、最安全的方法[7]。硒多糖与普通多糖的不同之处在于其独特的硒氧键,具有更稳定的结构[8],且有利于人体吸收利用[9]。赵子华等[10]研究富硒菊花提取物的抗氧化活性,结果表明富硒菊花提取物的抗氧化活性优于普通菊花。张斐然[11]开展了富硒菊花多糖的提取分离、结构表征等研究,获得良好的结果。然而,富硒黄山贡菊多糖的提取与生理活性等方面的研究尚未见。本研究拟采用响应面优化富硒黄山贡菊多糖的超声辅助提取工艺,探究富硒黄山贡菊多糖的体外抗氧化性活性,为富硒贡菊多糖进一步研究及应用提供参考依据。
1 材料与仪器
1.1 试验材料与试剂
富硒黄山贡菊(安徽省黄山市休宁县蓝田镇菊花合作社提供);1.1-二苯基-2-三硝基苯肼(DPPH,纯度≥97%,购于国药集团);2.2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS,纯度≥98%,购于国药集团);其他试剂均为实验室常用试剂(分析纯)。
1.2 试验仪器
KQ5200DE 型数控超声波清洗器(昆山市超声仪器有限公司);TGL-20M 台式高速冷冻离心机(湖南湘仪集团);AFS-993 原子荧光光度计(北京吉天仪器有限公司);WSC-S 色差计(上海仪电物理光学仪器有限公司);FTIR-650 傅里叶变换红外光谱仪(天津港东科技股份有限公司);JSM-6390LV 扫描电子显微镜(日本电子株式会社)。
2 方法
2.1 富硒黄山贡菊多糖的制备
将干燥的富硒黄山贡菊(含水量<6%)粉碎过筛(孔径0.28 mm),称量富硒黄山贡菊粉末5 g,放入300 mL 三角瓶中,加入125 mL 蒸馏水,在不同条件下进行超声提取,离心(8000 rpm,10 min)过滤,收集上清液,滤渣再提取一次,收集合并上清液(体积V)。采用真空浓缩将上清液浓缩至约20%V,向浓缩液中加入3 倍体积的无水乙醇,放置于冰箱冷藏过夜,离心(8000 rpm,10 min)收集沉淀,将沉淀物真空冷冻干燥,得到富硒黄山贡菊多糖,低温保存备用。富硒黄山贡菊多糖的提取率:

2.2 单因素实验
选择液料比(15、20、25、30、35 mL/g),超声时间(20、30、40、50、60 min),超声功率(40、50、60、70、80W),超声温度(40、50、60、70、80℃)为参考因素,以富硒黄山贡菊多糖提取率为指标,进行单因素实验。
2.3 响应面优化超声提取富硒黄山贡菊多糖的试验设计
根据单因素实验结果,选择料液比(25 mL/g)为固定值,以富硒黄山贡菊多糖的提取率为响应值,选择超声时间、提取温度和超声功率等三个因素,进行响应面优化试验(表1)。
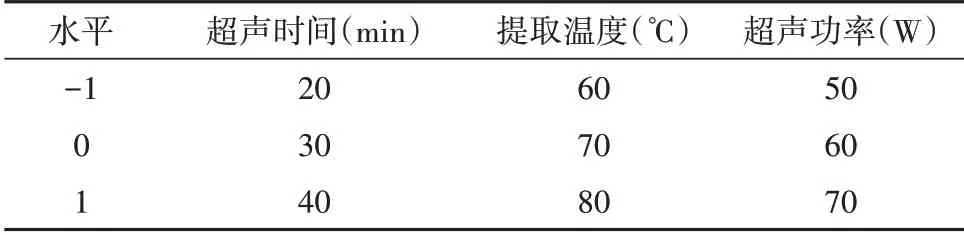
表1 响应面试验的因素与水平Tab.1 Factors and levels of response surface trials
2.4 富硒黄山贡菊多糖的初步纯化
依据响应面优化的最佳工艺条件来提取富硒黄山贡菊多糖,将提取液与大孔树脂D101按照体积比2:1,室温处理8 h,过滤收集滤液;用去离子水洗涤树脂2 次,收集洗涤液,与滤液合并,将合并液真空浓缩至原体积的20%。浓缩液经Sevag 法脱蛋白处理后,加入3 倍体积的无水乙醇,离心收集沉淀,经真空冷冻干燥,获得初步纯化的富硒黄山贡菊多糖。
2.5 富硒黄山贡菊多糖抗氧化活性的检测
2.5.1 DPPH·自由基清除能力
依据Zheng 等[12]实验方法,以Vc 为阳性对照,检测不同浓度富硒黄山贡菊多糖溶液对DPPH·清除能力(IDPPH·),其计算公式如下:
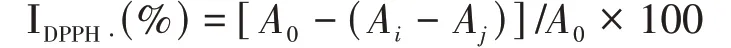
式中:A0-空白对照的吸光值,Ai-试验样品的吸光值,Aj-无水乙醇代替DPPH吸光值。
2.5.2 羟基自由基清除能力
依据Wang等[13]实验方法,以Vc为阳性对照,检测不同浓度富硒黄山贡菊多糖溶液对羟基自由基清除能力(I·OH),其计算公式如下:

式中:A0-空白对照的吸光值,Ai-试验样品的吸光值,Aj-蒸馏水代替双氧水的吸光值。
2.5.3 ABTS+·自由基清除能力
依据Thaipong 等[14]实验方法,以Vc 为阳性对照,检测不同浓度富硒黄山贡菊多糖溶液对ABTS+自由基清除能力(IABTS+),其计算公式如下:

式中:A0-空白对照的吸光值,Ai-试验样品的吸光值,Aj-蒸馏水代替ABTS的吸光值。
2.5.4 总还原能力
依据kozarshi 等[15]实验方法,检测不同浓度富硒黄山贡菊多糖溶液的还原能力(RFe3+),其计算公式如下:
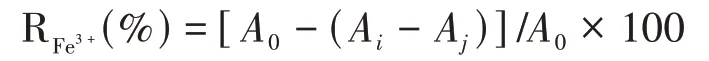
式中:Ai-试验样品的吸光值,A0-空白对照的吸光值,Aj-蒸馏水代替Fe3+的吸光值。
2.6 富硒黄山贡菊多糖的检测
2.6.1 色度测定
利用色差计进行检测。L*值为亮度,a*值为红绿度,b*值为黄蓝度;较高a*值倾向于红色,较高b*值倾向于黄色。测得数值使L*×a*×b*系统中的色差公式:ΔΕ=
2.6.2 扫描电镜
扫描电子显微镜观察超声提取法和水提法获得富硒黄山贡菊多糖,取适量的多糖粉末固定在样品台上,进行喷金,放大至1 000倍进行观察。
2.6.3 红外光谱扫描
采用溴化钾(KBr)压片法进行富硒黄山贡菊多糖的傅里叶红外光谱分析。称取2 mg 富硒黄山贡菊多糖样品,置于研钵内,加入干燥的KBr,充分混匀研磨,压制成片。放入傅里叶红外光谱仪内进行检测,在400~4 000 cm-1波数范围内扫描获得图谱。
3 结果与分析
3.1 单因素试验分析
3.1.1 料液比的试验结果
在超声功率60 W、超声时间30 min、提取温度70℃的条件下,结果如图1A所示,富硒黄山贡菊多糖提取率先增大后倾向于平缓;当料液比≥25 mL/g时,多糖提取率变化不大。因此,最适料液比为25 mL/g。
3.1.2 超声时间的试验结果
超声时间对富硒黄山贡菊多糖提取率的影响,结果如图1B所示。随着超声时间的提升,富硒黄山贡菊多糖提取率呈现先升后降,可能是超声时间的增加,促进多糖的降解[16]。当超声时间超过30 min时,富硒黄山贡菊多糖提取率下降明显。因此,最适超声时间为30 min。
3.1.3 提取温度的试验结果
提取温度对富硒黄山贡菊多糖提取率的影响,结果如图1C 所示。随着温度升高,分子运动加快,多糖溶出率增大,多糖提取率先快速上升;当提取温度≥70℃时,多糖提取率增速趋于平缓。因此,最适提取温度为70℃。
3.1.4 超声功率的试验结果
超声功率对富硒黄山贡菊多糖提取率的影响,结果如图1D 所示。在超声功率40~80 W 范围内,富硒黄山贡菊多糖提取率呈现先提高后降低;当超声功率为60 W 时,多糖提取率最高。因为增大超声功率能促进细胞破碎,提高多糖溶出率;然而,当超声功率>60 W 时,可能引起多糖分解。因此,最适超声功率为60 W。

图1 单因素实验结果Fig.1 Experimental results of single factor
3.2 响应面试验
3.2.1 响应面试验结果
依据单因素试验结果,本实验选择料液比25 mL/g,以富硒黄山贡菊多糖提取率为响应值,选择3因素3水平进行响应面试验,结果如表2,方差分析结果如表3,响应面曲面图见图2。

图2 各因素响应面分析Fig.2 Response surface analysis of each factor

表2 富硒黄山贡菊多糖提取响应面试验设计与结果Tab.2 Design and results of response surface trials for selenium-rich Huangshan Gongju polysaccharides extraction
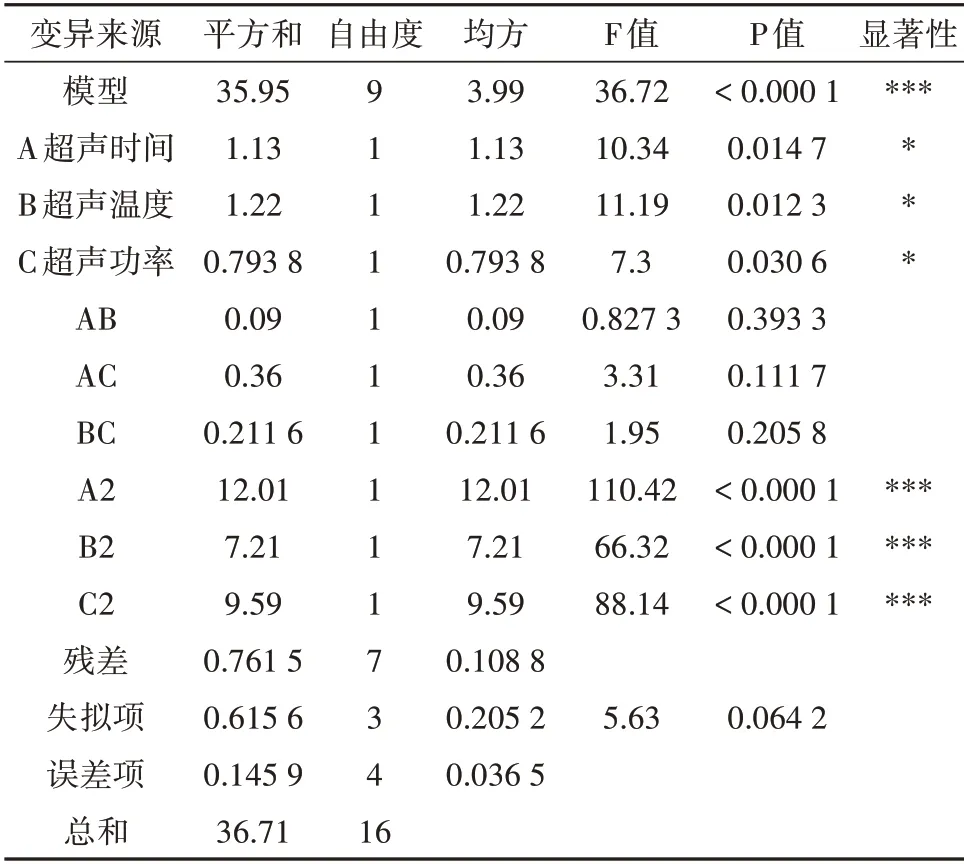
表3 回归模型方差分析Tab.3 Analysis of variance of regression model
富硒黄山贡菊多糖提取率(Y)对超声时间(A)、超声温度(B)和超声功率(C)的二次项回归模:Y=15.7+0.375A+0.39B-0.315C+0.15AB-0.3AC-0.23BC-1.69A2-1.31B2-1.51C2。
回归模型的F值(36.72)和较低的P值(P<0.001),表明该模型是高度显著的。本模型的R2为0.979 3,R2Adj为0.952 6,说明回归模型与试验结果具有良好的拟合度,可用于预测和分析富硒黄山贡菊多糖提取率。线性系数(A、B、C)是显著的(P<0.05),二次项系数(A2、B2、C2)是极其显著的(P<0.001),其他系数是不显著的(P>0.05)。通过观察线性和二次系数,单因素对富硒黄山贡菊多糖提取率的响应程度为提取温度>超声时间>超声功率。
响应曲面图和等高线图常用来表示变量间的交互作用和变量与响应值关系的变化。如图4(A)所示,随着超声时间和超声温度的增加,富硒黄山贡菊多糖的提取率呈现先升后降的趋势;可能的原因是开始超声能使细胞破壁,促进多糖释放到溶剂中,提高多糖的提取率;然而,随着超声功率升高和时间延长,多糖易发生降解,导致提取率降低。同样,超声功率和超声时间也可以从图4(B,C)中看到。在该实验提取温度范围内,其对富硒黄山贡菊多糖提取率呈现正相关作用。
3.2.2 模型验证
通过响应面优化富硒黄山贡菊多糖超声提取条件分析,最佳提取工艺条件为:超声时间31.3 min,超声温度71.8℃,超声功率58.7 W,预测富硒黄山贡菊多糖最佳提取率为15.8%。考虑实际操作,将最佳提取条件调整为超声时间30 min,超声温度70℃,超声功率60 W,在此条件下重复三次提取,获得富硒黄山贡菊多糖的提取率为15.83±0.10%,与预测值基本一致,因此采用响应面得到二次回归模型可用于富硒黄山贡菊多糖的最佳提取工艺。
3.3 富硒黄山贡菊多糖的测定
依据响应面优化超声提取的工艺条件,以水提法为对照。利用苯酚-硫酸法[17]测定富硒黄山贡菊多糖提取率。超声辅助提取富硒黄山贡菊多糖提取率为15.83%,水提富硒黄山贡菊多糖提取率为13.46%。应用凯氏定氮法测富硒黄山贡菊多糖中蛋白质含量[18]。超声辅助提取多糖中蛋白质含量为3.23%,水提法多糖中蛋白质含量为2.83%。采用Chen 等[19]方法,测定富硒黄山贡菊多糖的硒含量。超声辅助提取法获得硒含量为1.276 mg/kg,水提法获得硒含量为0.408 mg/kg。结果表明:超声辅助提取富硒黄山贡菊多糖优于水提法,原因可能是超声能促进细胞破裂,有利于(硒)多糖和(硒)蛋白分泌出来。
3.4 体外抗氧化活性
以VC抗氧化活性为对照,结果如图3所示,富硒黄山贡菊多糖的抗氧化活性(DPPH·自由基的清除作用、羟基自由基的清除作用与ABTS+清除作用)明显低于VC的抗氧化活性。因此,超声辅助提取与水提富硒黄山贡菊多糖的抗氧化活性将做如下分析。
3.4.1 DPPH·自由基的清除作用
DPPH·自由基清除试验作为常规的抗氧化活性实验之一。富硒黄山贡菊多糖显示出较好的DPPH·清除活性,与其浓度呈正相关,如图3A所示。随着浓度的升高,富硒黄山贡菊多糖对DPPH·自由基的清除能力也随之提高;当浓度为0.6 mg/mL 时,富硒黄山贡菊多糖对DPPH·的清除能力达到最大值,且超声辅助法为78.14%,水提法为74.62%。超声辅助提取多糖对DPPH·自由基的清除能力高于水提法,可能原因是超声辅助能促进细胞内抗氧化内容物分泌出来。
3.4.2 羟基自由基的清除作用
富硒黄山贡菊多糖对·OH清除能力,如图3B所示。富硒黄山贡菊多糖浓度在2~10 mg/mL 范围内,随着浓度增加,其对·OH 清除能力呈上升趋势,且超声提取多糖对·OH 清除率比水提多糖高。当多糖浓度为0.8 mg/mL 时,超声提取多糖对·OH 清除率达到93.26%,水提多糖对·OH 清除率达到91.38%。
3.4.3 ABTS+清除作用
富硒黄山贡菊多糖对ABTS+清除能力,如图3C所示。富硒黄山贡菊多糖浓度在0.1~0.5 mg/mL范围内,其对ABTS+清除能力呈逐步升高趋势,且超声提取多糖对·OH 清除率比水提多糖高。当多糖浓度为0.6 mg/mL 时,超声提取多糖对ABTS+清除率达到82.43%,水提多糖对·OH 清除率达到80.26%。
3.4.4 Fe3+还原能力
Fe3+还原能力是测定多糖的抗氧化能力,其数值反映多糖的总抗氧化活性。富硒黄山贡菊多糖的Fe3+还原能力,如图3D 所示。富硒黄山贡菊多糖浓度在2~12 mg/mL 范围内,随着多糖浓度增加,吸光值升高,Fe3+还原能力越强,富硒黄山贡菊多糖浓度与铁还原力呈线性关系,且超声提取多糖的Fe3+还原能力比水提多糖略高。

图3 富硒黄山贡菊多糖的抗氧化活性Fig.3 Antioxidant ability of selenium-enriched Huangshan Gongju polysaccharide
3.5 富硒黄山贡菊多糖的特性
3.5.1 色差分析
采用色差计检测结果:超声辅助提取多糖(L*1=67.64、a*1=-0.24、b*1=2.73),水提多糖(L*2=68.5、=-2.48、b*2=3.57),经计算ΔE 为2.542 2。结果
表明:两种方法提取的多糖粉末,颜色差异肉眼可见;超声多糖测得的L*小于水提多糖,说明两者之间的成分含量存在差异。孔维楠等[20]研究表明糖度增加,L*数值减小。采用超声提取多糖含量高于水提法,与孔维楠等研究结果一致。
3.5.2 扫描电镜分析
采用扫描电镜观察水提法和超声辅助法提取富硒黄山贡菊多糖粉末的微观结构,如图4所示。可以看出水提法(A)和超声辅助提取法(B)的多糖表面结构复杂,水提多糖呈纤维状,而超声多糖表面呈颗粒状,凝结成块;可能是超声辅助提取过程中空穴效应产生剪切力造成的[21],引起多糖键断裂产生较多小分子多糖,小分子多糖聚集。同样,超声对富硒黄山贡菊细胞的破坏力更强,促进多糖从细胞内释放出来,从而导致两种提取方式糖含量的差距。

图4 扫描电镜图(A.水提多糖;B.超声辅助提取多糖)Fig.4 Scanning electron microscope(A.Water extraction of polysaccharide;B.Ultrasonic assisted extraction of polysaccharide)
3.5.3 红外光谱分析
富硒黄山贡菊多糖经脱色脱蛋白后,多糖进行红外光谱分析(蛋白影响可以忽略)。从图5可以看出,两种方法提取的多糖具有相似的多糖特征吸收峰。依据崔杰等[22]对荣保灵芝1号多糖的红外光谱分析结果,水提多糖(A)和超声辅助提取多糖(B)在1 000 cm-1左右都有强而宽的C-H(-CH2)伸缩震动峰,在2 921.6 cm-1(A),2 927.4 cm-1(B)处也有C-H伸缩震动峰,说明富硒黄山贡菊多糖不含糖醛酸。根据金志民等[23]研究东北红松蘑多糖的结果,在1 746.27 cm-1处都有C=O 的伸缩振动峰,说明富硒黄山贡菊多糖为吡喃糖。依据葛含静[24]对光皮木瓜多糖的研究结果,水提多糖和超声辅助提取多糖在1 614.1 cm-1处有C=C 的共轭伸缩振动峰,800~1 200 cm-1吸收峰,说明富硒黄山贡菊多糖主要是α-吡喃糖。

图5 红外光谱图(A.水提多糖;B.超声辅助提取多糖)Fig.5 Infrared spectrum(A.Water extraction of polysaccharide;B.Ultrasonic assisted extraction of polysaccharide)
4 结论
本研究采用响应面法优化超声辅助提取富硒黄山贡菊多糖的工艺,获得最佳条件:超声时间30 min,提取温度70℃和超声功率60 W;提取率为15.83%。富硒黄山贡菊多糖经初步纯化后,以水提多糖为对照,超声辅助提取多糖在多糖提取率、蛋白含量、硒含量及抗氧化活性均高于水提多糖。利用色差分析、扫描电镜与红外光谱等分析,探讨富硒黄山贡菊多糖的色差、颗粒表面和化学键等特性。由于多糖的性质功能与其组成、结构及分子量等密切相关[25],后续将开展富硒黄山贡菊多糖的纯化、化学结构及其生物功能等方面的研究工作,为富硒黄山贡菊多糖的研发和应用提供理论依据。
