星状神经节阻滞减轻急性肺损伤的研究进展
2023-01-09戴诗云吉青青袁红斌何星颖
戴诗云 吉青青 袁红斌 何星颖
1983年,Liverpool和Alexander意外发现颈交感神经干离断可以治疗癌痛,此后多年主要采用手术离断颈部星状神经节(stellate ganglion,SG)治疗疼痛,后逐渐采用非手术经皮且可逆的星状神经节阻滞(stellate ganglion block,SGB)方法,并在多种疾病的治疗中广泛使用。随着研究不断深入,人们发现SGB除具有缓解疼痛的效果外,还可用于心律不齐、支气管哮喘、胃炎、痛经、原发性高血压及硬皮病等多等种疾病的治疗[1]。
急性肺损伤(acute lung injury,ALI)或急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是由各种直接和(或)间接致伤因素导致的肺泡上皮细胞、毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,导致急性低氧性呼吸功能不全。临床上针对ALI的治疗措施很多,但至今尚无特效药物或治疗方法。近年研究[2]结果表明,SGB具有肺保护作用。本文对SGB减轻ALI或ARDS的研究进展进行综述。
1 SG的解剖和阻滞方法
1.1 解剖 SG即颈胸神经节,由颈下神经节和第1胸神经节融合而成。SG长约2.5 cm,宽约1.0 cm,厚约0.5 cm[3]。其位于斜角肌内侧,颈长肌、食道和气管外,锁骨下动脉的上方,颈7横突前方和椎动脉起始部后方[4]。由于SG毗邻肺尖、迷走神经、臂丛、椎动脉、颈动脉鞘和椎动脉,实施SGB可能会发生臂丛阻滞、气胸和椎动脉损伤等并发症。
1.2 阻滞方法 早期采用手术暴露法找到颈上神经节并离断颈交感神经干(transection of the cervical sympathetic trunk,TCST),以达到SGB效果。但由于TCST创伤较大,操作复杂且持续性的SGB会影响患者健康,故其逐渐被微创法SGB取代。微创法SGB即经皮肤将局部麻醉药注入SG周围,暂时或永久地阻断SG内交感神经的传递[5]。为进一步提高SGB成功率及减少并发症发生,目前多超声引导下行SGB。
2 ALI的病理生理和发病机制
ALI和ARDS的病理学基本特征是弥漫性肺泡损伤,由肺泡上皮屏障及血管内皮功能障碍发展而来,最终导致肺水肿[6]。此外,炎症反应失调、白细胞和血小板的过度聚集和激活,以及凝血途径的失控性激活也参与了ALI的发生和发展[7]。ARDS分为3个阶段:渗出期、增生期和纤维化期。早期即渗出期,是影响ALI进展及预后的最重要时期,当前绝大部分ALI的治疗主要针对渗出期。ARDS早期的特征为肺泡毛细血管屏障完整性丧失导致肺泡腔内透明膜形成,肺顺应性降低,气体交换功能受限。中性粒细胞(polymorphonuclear neutrophil,PMN)向肺部迁移活化产生多种促炎介质,如IL-1β、IL-6、IL-8、TNF-α,过氧化物和蛋白酶。肺泡巨噬细胞(alveolar macrophages,AM)、肺泡上皮细胞和成纤维细胞也可产生多种细胞因子,加剧肺部炎症反应。募集的PMN和AM会释放大量氧化物质,进一步加重肺部组织损伤。此外,ARDS早期会发生凝血和纤溶功能紊乱,引起广泛的血栓形成和纤维蛋白大量沉积[8],导致微循环障碍(图1)。
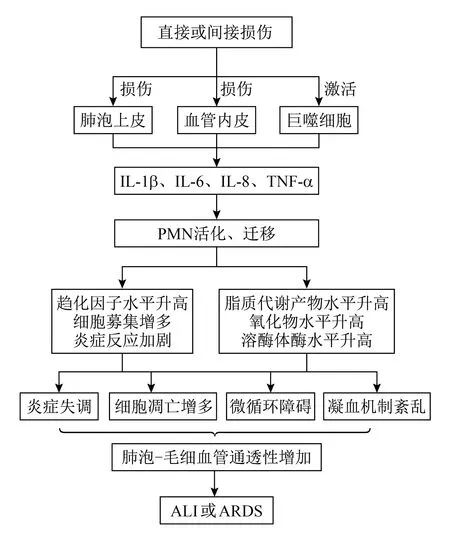
图1 ALI和ARDS的发病机制示意图
3 SGB的肺保护作用
随着对SGB的深入研究,其在肺保护方面的作用日益显现。临床研究发现,颈交感神经阻滞可通过抑制促炎细胞因子IL-1β、IL-6和TNF-α调节严重创伤患者早期全身炎症反应[1];降低肺部毛细血管通透性,减轻肺水肿,改善重症胰腺炎合并ALI患者的氧合功能及预后[9];调节免疫功能,减轻氧化应激,减少食管癌根治术后患者的肺部感染和早期肺功能障碍发生[10],以及改善老年患者单肺通气期间氧合[11]。另一方面,全身麻醉联合SGB有利于开胸手术围手术期血管舒缩细胞因子,如降钙素基因相关肽及NO的调节[12],从而降低低氧血症发生率。此外,癫痫发作后可能引起神经源性肺水肿(neurogenic pulmonary edema,NPE)[13-14]。一项针对686例死于颅脑损伤或自发性中枢神经系统出血的患者资料的回顾性分析结果显示,肺水肿患病率约为75%[15];考虑其原因可能为颅内压升高时交感神经放电对肺有直接损害作用[16],同时儿茶酚胺增多会使全身及肺血管收缩。因此,可逆性的SGB可通过抑制交感神经放电来预防肺水肿。目前与SGB肺保护作用相关的临床研究相对较少,未来还需进一步探索。
与临床研究相比,关于SGB肺保护作用的实验动物研究更为多见。研究[2]发现,SGB可通过抑制炎症反应减轻脓毒血症大鼠的肺损伤;降低TNF-α水平,调节凝血与纤溶功能,减少脓毒血症大鼠肺血管内皮损伤[17];降低肺动脉高压兔的平均动脉压,这与SGB升高降钙素基因相关肽水平及降低NO水平有关;调节盐酸吸入致ALI兔的自主神经稳态,降低促炎因子水平,改善肺顺应性与氧合功能[18]。此外,SGB还具有拮抗氧化应激、抑制细胞自噬及调节免疫功能等作用。另有研究[19-20]结果表明,神经系统损伤后儿茶酚胺类物质释放引起暴发性动脉高压伴肺水肿,α-肾上腺素能阻滞剂(酚妥拉明)、颈7水平的脊髓横断及右侧TCST可预防NPE发生。
4 SGB肺保护作用的潜在机制
4.1 SGB减少促炎因子释放和炎症细胞生成 ALI和ARDS本质上是由直接或间接肺损伤诱发的全身炎症反应引起[21]。炎症介质的大量释放进一步激活PMN和巨噬细胞,后者随之释放更多的促炎因子,形成炎症信号级联反应,造成组织损伤。临床研究[9]发现,SGB可降低急性胰腺炎患者早期的IL-1β、IL-6和TNF-α水平,减轻肺水肿,改善肺氧合状况。动物实验结果显示,SGB可显著降低促炎因子和高迁移率族蛋白1水平,增加抗炎症因子IL-10的生成[2,18],其作用机制可能是SGB抑制了转录因子NF-κB生成。交感神经活性降低后,儿茶酚胺类物质与免疫细胞的肾上腺素能受体结合减少,抑制免疫细胞激活,使促炎因子释放减少,炎症减轻[22]。此外,SGB可通过阻滞交感神经系统从而使迷走神经相对兴奋,通过“乙酰胆碱抗炎通路”抑制炎症因子的释放[23]。
PMN是机体抵御微生物的第一道防线,但是PMN过度激活和募集会导致组织损伤,炎症效应增强,最终损害肺功能[24]。有研究[25]结果显示,肺泡灌洗液中PMN较多的ARDS患者病情较重且预后较差。离体实验结果显示,PMN过度募集会损伤内皮细胞的完整性,进而损害肺泡毛细血管屏障[26]。SGB可减少ALI大鼠和兔支气管肺泡灌洗液中PMN数量,减少肺组织炎症细胞浸润[2,18]。促炎细胞因子IL-8是主要的PMN趋化因子,促进PMN的活化、募集并减少其凋亡。过量的IL-8会导致PMN扩增,造成机体损伤。研究[22]发现,SGB可降低血清IL-8水平,对于预防PMN大量浸润肺部加重肺损伤有一定效果。
目前诸多研究发现,AM也是ALI和ARDS发生、发展的重要因素。AM有M1和M2两种分型。M2型巨噬细胞是常驻型AM,主要参与免疫应答,发挥抗炎效应。当机体出现类似ALI或ARDS的刺激时,常驻型AM立刻转为M1型[27]。同时,外周血单核细胞也被招募至肺泡腔中,进而分化成M1型AM[28]。M1型AM可释放多种有害介质和促炎因子(如IL-6、IL-8和IL-18)。这些炎症因子可影响PMN的迁移和累积,增强炎症反应,造成组织损伤[29]。据报道,抑制交感神经过度刺激会下调M1型巨噬细胞的表达,减轻炎症反应[30]。SGB能够减少M1型巨噬细胞的生成,降低单核细胞趋化蛋白-1和TNF-α水平,这可能与其抑制NF-κB信号通路有关[31]。
4.2 SGB抗氧化应激 在ALI和ARDS的进展中,生产过剩的氧化剂修饰细胞蛋白质、脂质、DNA和碳水化合物,导致其结构异常,肺泡毛细血管屏障受损,肺水肿形成[32]。氧自由基不仅参与肺动脉高压的进展,还能影响交感神经活动。Campese等[33]研究结果显示,血管紧张素Ⅱ对交感神经系统的作用是通过增强氧化应激来介导的。超氧化物歧化酶(superoxide dismutase,SOD)是生物体内抗氧化酶系的重要组成部分,可治疗由自由基产生的炎症性疾病。丙二醛是脂质过氧化指标,反映机体的氧化程度。研究[34]发现,SGB可增加肺动脉高压患者SOD活性,减少自由基损伤,从而达到肺保护的目的。SGB治疗也可显著降低ALI大鼠和兔肺组织中丙二醛水平,增加血清SOD活性[2,35]。此外,SGB可调节下丘脑激素分泌,抑制垂体-肾上腺轴引发的急性应激反应[36],从而减少应激对机体的损害。
4.3 SGB调节细胞凋亡和自噬 细胞凋亡即细胞程序性死亡,对细胞的选择性消除至关重要。在ARDS发生过程中,活性氧、NO、内毒素和激素刺激会激活凋亡信号通路,诱发半胱氨酸蛋白酶级联反应,促进细胞凋亡,进而损伤肺泡上皮和血管内皮[37]。有研究[38]结果显示,抑制细胞凋亡对肺上皮细胞具有保护作用,提高ALI大鼠存活率,这可能与NF-κB和磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)通路调控有关。SGB可上调抗凋亡蛋白bcl-2表达,并抑制促凋亡蛋白Bax表达,进而发挥组织保护作用,这可能与其抑制丘脑-垂体-肾上腺(HPA)轴和交感-肾上腺髓系的活性有关[36,39]。
正常情况下,细胞自噬参与维护细胞内环境的稳态。过度激活或抑制自噬均可能造成细胞死亡及组织损伤。SGB可降低肺组织细胞自噬标志物微管相关蛋白轻链3及Beclin-1蛋白表达,这可能与SGB抑制炎症反应进而减少细胞自噬激活有关[40]。上述研究结果表明,SGB的肺保护作用可通过抑制细胞自噬来实现。
4.4 SGB调节凝血功能 正常情况下,机体的凝血与抗凝系统处在动态平衡中。在脓毒血症致ALI或ARDS中,机体大量内毒素释放,PMN大量激活伴内皮细胞黏附,炎症因子大量释放,凝血与抗凝系统失衡,导致微血管血栓形成,严重的会进展为弥散性血管内凝血[41]。研究[17]发现,SGB可增高脓毒血症大鼠纤维蛋白原和抗凝血酶Ⅲ水平,改善大鼠凝血和纤溶功能,进而抑制ALI进一步加重。TNF-α和IL-6等炎症因子可导致血管内皮细胞损伤,进而增加组织因子和血小板活化因子释放,激活外源性凝血途径,最终导致凝血功能障碍[42]。SGB不仅可通过抑制炎症细胞聚集来减少促炎因子释放,还能通过离断交感神经间接兴奋迷走神经,乙酰胆碱作用于巨噬细胞和内皮细胞,抑制促炎介质释放,改善机体凝血和纤溶紊乱,最终发挥减轻ALI的效应[43]。
4.5 SGB调节血管舒缩活动 机体长期缺血、缺氧时,血管内皮细胞受损引发血管舒缩因子分泌失衡,肺血管收缩,肺动脉压升高。组成SG的部分交感神经节后纤维支配肺血管平滑肌和内皮细胞,调节肺血管舒缩活动[44]。SGB通过抑制交感神经血管收缩纤维的传递使肺血管扩张,肺动脉压下降,肺血流量增加[45]。NO是血管舒张因子,血管腔内的NO不仅可有效抑制血小板聚集[46],还可通过抑制白细胞黏附至血管壁而发挥抗炎效应[47]。研究[48]发现,SGB可增高兔血浆中NO水平,这可能与SGB后交感神经节后纤维分泌一氧化氮合酶有关。SGB还可通过灭活精氨酸酶,提高NO生物利用度来抑制肺血管重构,改善肺血流和氧合功能[34]。有研究[49]结果显示,SGB后缺氧性肺动脉高压家兔的肺动脉压降低,伴血管舒张因子降钙素基因相关肽和NO水平增高,血管收缩因子内皮素-1水平降低,提示SGB可通过调节血管舒缩活动来发挥肺保护作用。
4.6 SGB调节免疫系统 交感神经对免疫系统的调节十分复杂。研究[50]发现,SGB可显著降低正常人体内去甲肾上腺素和儿茶酚胺水平。SGB调节机体节后交感神经纤维,降低转录因子活性,进而降低全身或局部体液免疫介质水平,这可能是SGB能够缓解相关疾病症状的原因。SGB能够减少创伤早期促炎因子的分泌,表明SGB可调节过度激活的细胞因子。创伤导致机体HPA轴过度兴奋,促肾上腺皮质激素和糖皮质激素生成和释放增加,而SGB可抑制上述变化。
SGB还能影响细胞免疫反应,改变白细胞亚群分布。SGB能够降低人外周血中自然杀伤细胞活性,增高B细胞、T细胞的分布比例及CD4+/CD8+比值[51],降低成人特异性皮炎患者血清IgE和嗜酸性粒细胞水平[52],缓解肺结核和肺癌患者的免疫抑制[53],以及提高免疫力低下的患者血中免疫球蛋白IgA、IgG、IgM水平[54]。虽然SGB能够调节机体免疫功能,但其具体作用机制仍不明确,还需要进一步研究阐明。
4.7 SGB调节自主神经系统 正常状态下,机体的交感神经系统与副交感神经系统保持动态平衡,共同维护机体内环境的稳态。在机体发生严重的感染、创伤及休克时,交感神经过度激活,自主神经系统失调,发生“严重交感神经放电”和“儿茶酚胺风暴”,促使全身外周血管和肺静脉收缩,肺泡壁受损,导致肺水肿[55]。SGB可减少儿茶酚胺释放,降低压力感受器的敏感性,改善心肺循环,最终减轻NPE[56]。此外,SGB还能够调控交感神经,进而抑制肺动脉高压的进展[34];调节自主神经紊乱,从而改善ALI兔的肺功能[18]。
5 总 结
综上所述,SGB可影响神经、内分泌、免疫、循环、消化、呼吸等多个系统。本文综述了SGB减轻ALI的研究进展并阐述了其可能机制,这对于拓展SGB的临床应用具有重要意义。未来需要更多的研究深入探索实施SGB的最佳时间点、频率、药物浓度及剂量。
