北方景观湖泊夏季菌藻多样性及共生关系
2023-01-07司光超薛晓东赵传富
司光超,薛晓东,赵 伟,赵传富,闫 涛,魏 东
(1. 济南大学 水利与环境学院,山东 济南 250022;2. 山东省环境保护科学研究设计院有限公司,山东 济南 250013)
湖泊是城市生态系统中物质循环和能量流动的重要节点,具有调蓄洪水、减少城市热岛效应、游览休闲、航运交通等多种有益功能。城市景区湖泊水质的好坏直接影响景观的观赏价值和周围的人居环境。由于土地利用和养分循环发生变化,因此对管理和维持城市景观湖泊的水质提出了很高的要求。人类活动、雨水径流或城市排水造成的营养物质积累会破坏湖泊的形态、生物学和物理化学特性,此外,水文剖面改变导致的富营养化现象正在威胁全球大多数城市景观湖泊的生存能力和质量[1]。
湖泊富营养化是一个自然过程,人为的磷、氮元素输入到水体中会使湖泊水质恶化,并影响其水生生态系统。具体地说,富营养化是由居民区、工业区和农业区增加的养分投入引发的,有害藻类大量繁殖是湖泊营养丰富的主要表现。一般来说,富营养化会改变水生生态系统的结构和功能,导致水生生物多样性的丧失,并对人类、社会和经济福祉产生负面影响[2]。
本文中利用藻类种群鉴别以及物种相关性共表达网络等大数据信息处理手段,分析山东省济南市著名的景观湖大明湖中藻类种群结构的区域演替规律和相互作用机制,揭示藻类区域生长及种群结构之间的相互关系,从生物技术角度防治水体富营养化现象,保护生态系统生物多样性,为了解城市湖泊的藻类和伴生菌群的群落结构以及生态系统生物多样性保护,为研究城市湖泊水华暴发机制及人工控藻技术提供参考。
1 实验
1.1 样品采集
选取大明湖景观水域3个采样点,分别为南门、玉函亭和沧浪亭。采用有机玻璃垂向直立式采样器对水样进行采集,每个采样点分别取0、50、100、200 cm共4个深度处的水样共1.5 L,其中0.5 L水样用于鉴别微生物群落结构,1.0 L水样进行水质指标的测定。在取样同时同地进行溶解氧(DO)、pH和氧化还原电位(ORP)等指标的实时测试,并记录。
1.2 实验仪器
实验仪器包括:JK205-A型化学需氧量恒温加热器、雷磁-571-1型化学需氧量测定仪,济南精密科学仪器仪表有限公司;722型可见分光光度计,上海光谱仪器有限公司;LS-55型荧光光度计,美国Perkin-Elmer公司;IX-51型生物显微镜,日本Olympus Corporation公司;Multi 3420型便携式多参数测量仪,德国WTW公司。
1.3 分析方法
1.3.1 水质分析
采用Multi 3420型便携式多参数测量仪实时测定取样点水样的pH、DO和ORP。水样中氨氮、亚硝酸盐、硝酸盐分别根据环境保护行业标准《水质氨氮的测定纳氏试剂分光光度法》(HJ 535—2009)、国家标准《水质 亚硝酸盐氮的测定 分光光度法》(GB/T 7493—87)和环境保护行业标准《水质 硝酸盐氮的测定 紫外分光光度法(试行》(HJ/T 346—2007)中的方法测定。总磷采用国家标准《水质 总磷的测定 钼酸铵分光光度法》(GB/T 11893—89)中的方法测定。
1.3.2 荧光光谱分析
微生物产物(SMP)的三维荧光光谱图使用荧光光度计获得。仪器参数设定如下:发射波长为200~400 nm,增量为10 nm;激发波长为280~550 nm,间隔5 nm,增量为0.5 nm;激发狭缝和发射狭缝均为10 nm,扫描速度设置为2 400 nm/min。
1.3.3 微生物群落结构分析
采用十六烷基三乙基溴化铵(CTAB)法提取污泥样品基因组脱氧核糖核酸(DNA),用稀释后的基因组DNA作为16S V4区的模板,用带有条形码的高效高保真酶和细菌多样性引物515F和806R扩增16SrDNA基因V4区。利用R语言3.6.3计算的Pearson相关系数矩阵构建共表达网络,并由Gephi0.9.2软件可视化。
2 结果与讨论
2.1 区域空间水质
大明湖水质数据分析结果如图1所示。由图可以看出,3个采样点的水质数据pH、DO和ORP差距较小(见图1(a)、(b))。3个采样点的pH相近,均呈现中性偏碱,有研究[3]表明,碱性环境适宜藻类和细菌的生存和繁殖。沧浪亭、南门采样点的DO质量浓度为10.32、10.73 mg/L,属于自然水体的正常浓度范围,玉函亭采样点的DO浓度偏低,平均质量浓度为8.73 mg/L,可能与玉函亭所处的凹形地理环境有关。3个采样点的ORP数据中,沧浪亭的最大,玉函亭的最小,说明前者水质更复杂,所含物质更多样,而后者导电性较低,相对而言所含物质较简单。
3个采样点的无机氮浓度均保持极低水平,主要以硝酸盐的形式存在(质量浓度为1~2 mg/L,见图1(c))。适宜的温度和高浓度溶解氧促进了硝化作用和光合作用等微生物生命过程的进行,加速了氮的消耗转换,使得水体总氮维持相对稳定在低浓度水平。3个采样点的总磷浓度均保持极低水平(见图1(c))。7月盛夏,湖水中磷极易被生物利用,且入水因雨水和地下泉水比例的增加,使得总磷浓度呈极低浓度态势,且3个采样点的浓度数值相差较小。
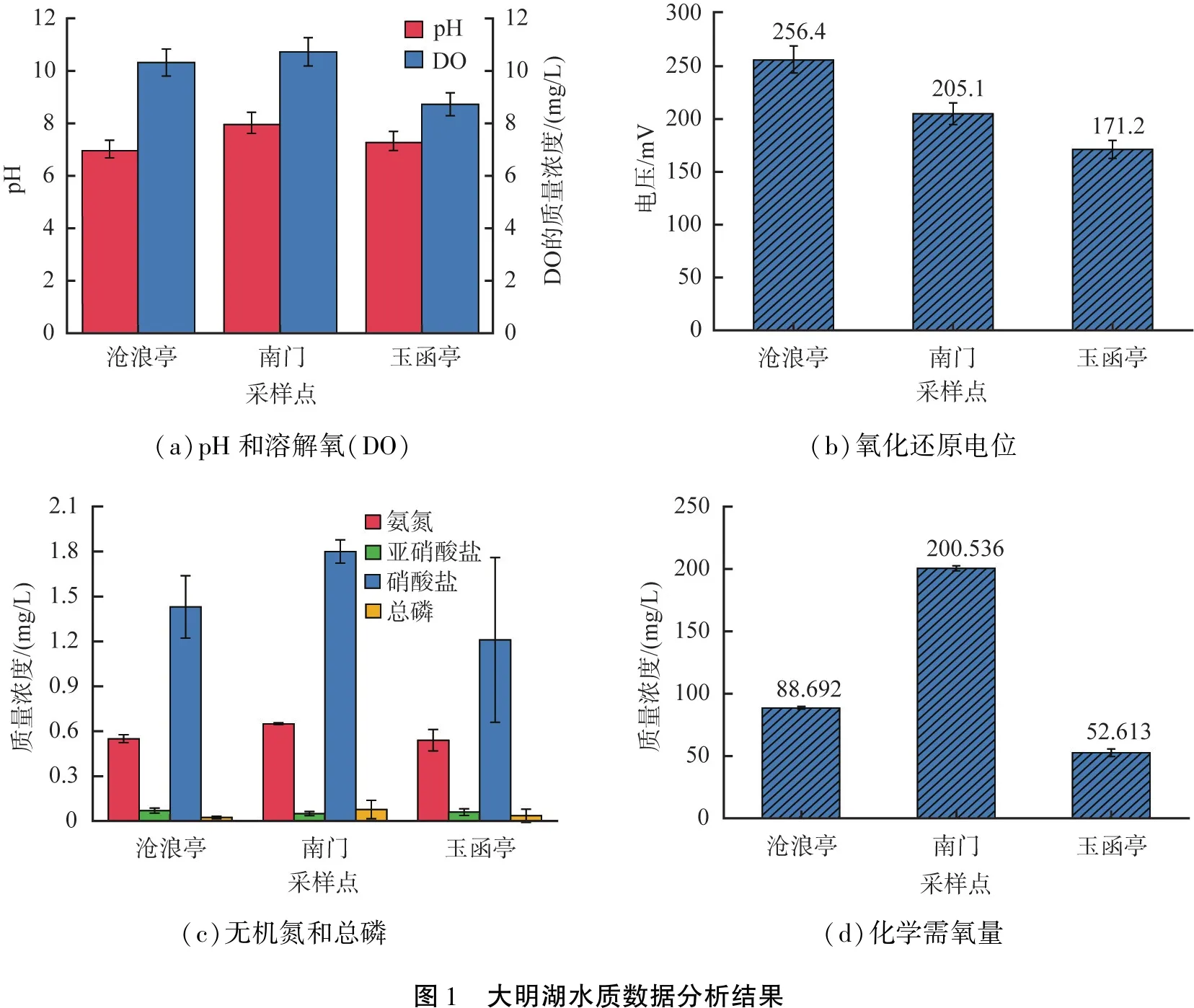
3个采样点的化学需氧量(COD)均呈现高浓度水平(见图1(d)),其中沧浪亭、玉函亭采样点的COD 质量浓度分别为88.692、52.613 mg/L,而南门采样点的则高达200.536 mg/L。南门的水流来源于百花洲,流经芙蓉街等居民聚集区,导致COD含量有所升高。除此之外,大量的荷花、菖蒲等水生生物死亡后陆续腐烂,也会释放COD。
2.2 溶解性微生物产物
溶解性微生物产物(SMP)是一种水溶性的异构复合体,主要包含多种生物和地质来源的腐殖质、蛋白质、多糖等物质,广泛存在于自然水体中。在自然水体中的SMP是影响水质和整体有机物的一个重要因素;但是,由于微生物在代谢过程中会释放出一些毒性物质,因此SMP的释放会增加自然水体中的毒性有机物[4]。除此之外,SMP对于富营养化过程中藻类等生物的生长过程有预警作用,在水体生物多样性保护过程中扮演关键角色。
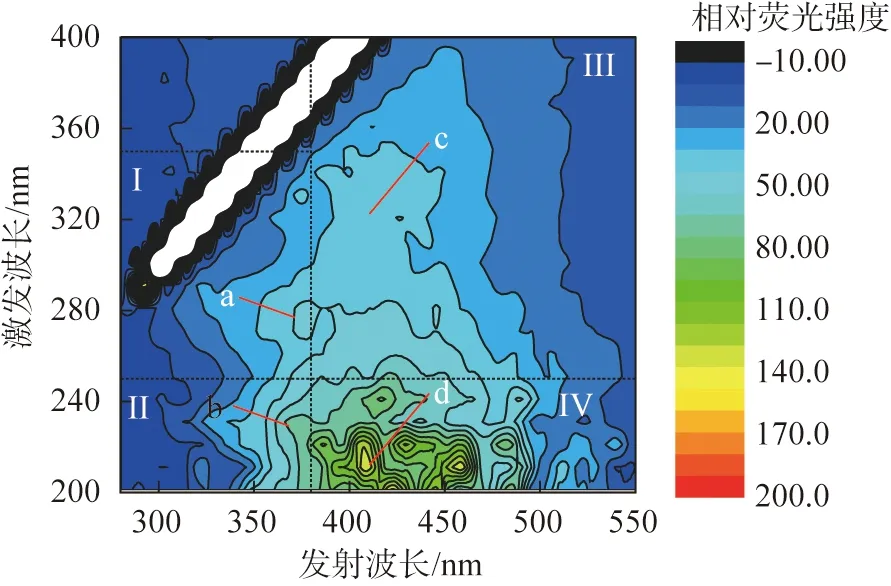
在自然水体中,SMP中的可降解部分可以参与生物代谢,例如作为电子供体参与反硝化过程。有研究表明,SMP的化学组成影响其对细菌和藻类的生物利用度,因此对于SMP的释放机制的研究具有重要的意义。图2所示为大明湖3个采样点水样中的SMP三维荧光光谱图。由图可知,SMP样品共检测出4个主要的特征峰(a、b、c、d)分别在激发波长为270、220、340、210 nm,发射波长为349、363、415、400 nm处,相对荧光强度分别为47.35、80.98、45.89和139.07,分别代表色氨酸类蛋白质(I)、芳香族类蛋白质(II)、腐殖酸类物质(III)和富里酸类物质(IV)[5]。在3个采样点中,蛋白质类物质存在差异性,可能与微生物差异性有关。腐殖酸类物质最丰富,原因是它无法被微生物转换利用[6]。同时,水体中的蛋白质类物质可以逐渐转化为难降解的腐殖酸类物质,导致其大量存在于湖水中[7]。
2.3 微生物群落
2.3.1 菌藻群落组成
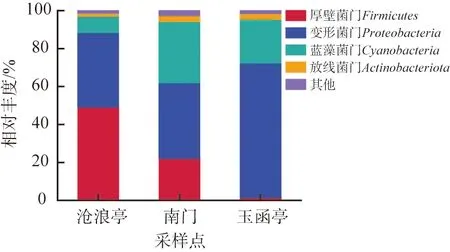
利用高通量测序技术对大明湖3个采样点水样中的微生物群落结构进行分析,结果如图3所示。由图可以看出,在门水平上共鉴别出4种菌群,分别为变形菌门Proteobacteria、蓝藻菌门Cyanobacteria、放线菌门Actinobacteriota和厚壁菌门Firmicutes。上述4种菌群在3个采样点存在明显的分布差异。沧浪亭采样点的厚壁菌门(相对丰度为49.17%)和变形菌门(相对丰度为39.31%)是优势菌群。南门采样点的变形菌门(相对丰度为40.04%)、蓝藻细菌门(相对丰度为32.23%)和厚壁菌门(相对丰度为22.03%)是优势菌群。玉函亭采样点的变形菌门(相对丰度为70.85%)和蓝藻细菌门 (相对丰度为23.07%)为优势菌群。变形杆菌门在所有样品中均为优势物种,在湖泊生态系统的生物降解与生物地球化学过程中起着重要作用。蓝藻细菌门为光合自养细菌,普遍存在于3个采样点的水域,是湖泊生态系统的重要组成部分,同时具有固氮、固碳的净化作用。沧浪亭采样点检测出大量的厚壁菌门,可能与该门细菌受到水质影响,产生了抵抗脱水和极端环境条件的孢子有关[8]。
(a)沧浪亭采样点
(a)门水平
在属水平上,微小杆菌属Exiguobacterium、不动杆菌属Acinetobacter、蓝菌属Cyanobium_PCC-6307和丛毛单胞菌属Comamonas作为3个采样点水样的优势属,它们的相对丰度分别占样本总群落的93.30%、88.72%和73.90%。微小杆菌属在环境生物修复和脱氮等方面发挥着重要作用,具有优良的氨氮、硝酸盐和亚硝酸盐脱氮能力,可以实现从氨氧化到亚硝酸盐的异养硝化过程和从亚硝酸盐到氮气的好氧反硝化过程[9]。不动杆菌属和丛毛单胞菌属都属于变形菌门。不动杆菌具有异养硝化和好氧反硝化能力,可以利用羟胺、亚硝酸盐和硝酸盐作为氮源进行生长代谢[10]。丛毛单胞菌属也具有氮转化的功能,可以将氨氮转化为硝酸盐和氮气[11]。此外,在玉函亭采样点还检测出较高丰度的寡养单胞菌属Stenotrophomonas和短波单胞菌属Brevundimonas,它们均属于不动杆菌属,相对丰度分别占样本总群落的8.14%和7.49%,说明玉函亭水域具有更高的生物多样性。
2.3.2 菌藻共表达网络
为了更深入地了解菌藻之间的关系,本文中构建大明湖水中菌、藻优势属的共表达网络,如图4所示。共生网络根据物种相关性 (Pearson相关系数ρ>0.8)和显著性(p值小于0.05)进一步描述了属水平物种潜在的复杂相互作用。该网络分为菌(蓝色)和藻(绿色)2个交织模块,揭示了2个独特的生态位在水体中密切的相互作用。在网络中,正相关(红色)表示,物种之间通过共生或互惠关系联系在一起,负相关(绿色)表示捕食或竞争关系。每个节点的大小与连接数量成正比。显然,网络的大部分连接是红色的,呈正相关,表明共生合作在水体中菌藻占绝对优势。优势属微小杆菌属、不动杆菌属和蓝菌属之间呈强烈的正相关,表明它们存在共生关系,蓝菌属可能为微小杆菌属和不动杆菌属提供生命代谢所需的氧气。假单胞菌属Pseudomonas和短波单胞菌属与其他属之间呈强烈的负相关,表明它们之间存在竞争关系。
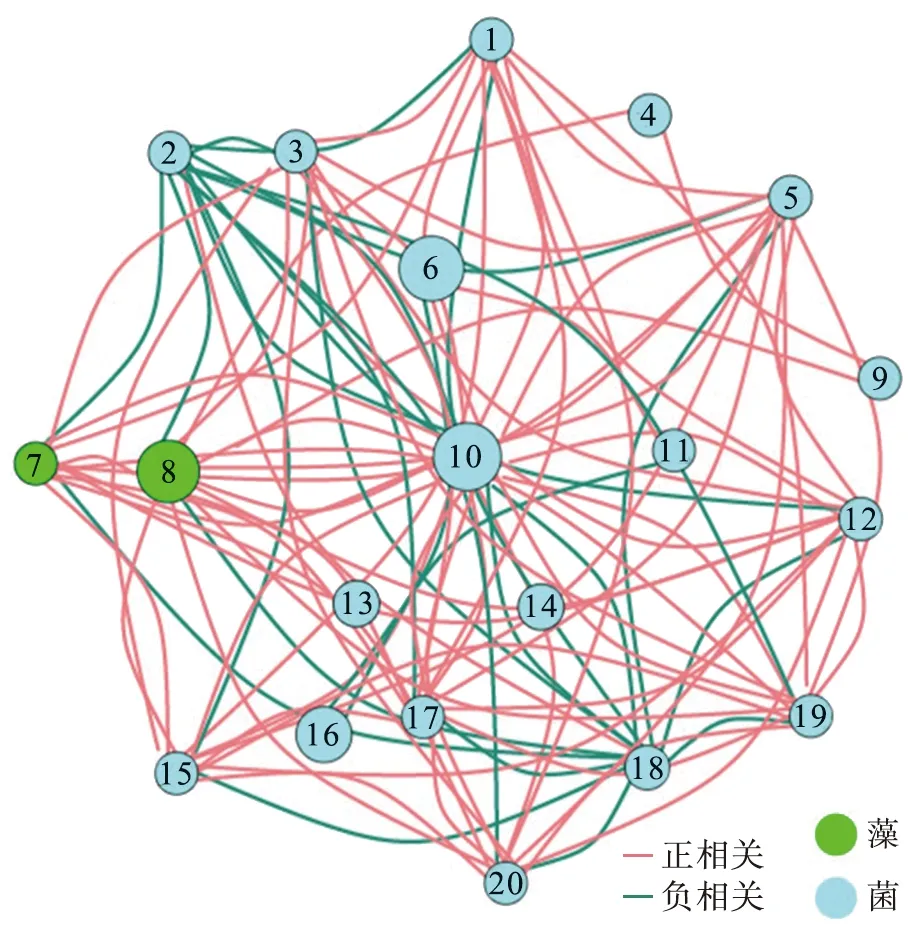
1—分枝杆菌属g_Mycobacterium;2—假单胞菌属g_Pseudomonas;3—梭状杆菌属g_Clostridium_sensu_stricto_1;4—金黄杆菌属g_Chryseobacterium;5—g_norank_f_Rhizobiales_Incertae_Sedis;6—微小杆菌属g_Exiguobacterium;7—g_norank_f_Caldilineaceae;8—蓝菌属g_Cyanobium_PCC-6307;9—g_norank_f_Gemmataceae;10—不动杆菌属g_Acinetobacter;11—伊丽莎白金菌属g_Elizabethkingia;12—g_norank_f_norank_o_Chloroplast;13—g_norank_f_Propionibacteriaceae;14—玫瑰单胞菌属g_Roseomonas;15—g_CL500-29_marine_group;16—丛毛单胞菌属g_Comamonas;17—g_unclassified_f_Micrococcaceae;18—短波单胞菌属g_Brevundimonas;19—甲基孢囊菌属g_Methylocystis;20—g_norank_f_norank_o_PeM15。图4 大明湖水中菌、藻优势属的共表达网络
3 结论
本文中利用藻类种群鉴别、物种相关性共表达网络等手段,分析我国北方景观湖大明湖中藻类种群结构的区域演替规律和相互作用机制,揭示藻类区域生长及种群结构之间的相互关系,得到如下结论:
1)水质数据分析表明,大明湖水体营养元素保持在较低的水平,不利于水华暴发。
2)微生物产物分析表明,大明湖水体中不可降解的腐殖酸类物质为主要成分,蛋白质类物质略有差异。
3)微生物群落分析表明,大明湖水体中微小杆菌属、不动杆菌属、蓝菌属和丛毛单胞菌属是优势菌属。
4)共表达网络表明,大明湖水体中菌藻优势菌属的共生合作关系占主导地位。
