DHX33作为可切除结肠癌患者术后辅助化疗预后标志物的临床研究
2023-01-07刘楠楠宋珊珊李凡
刘楠楠,宋珊珊,李凡
(辽宁省健康产业集团阜新矿总医院 消化内科,辽宁 阜新 123000)
辅助化疗(ACT)是目前结肠癌术后标准的治疗方案[1-2]。然而众多临床实践发现,即使处于同一病理阶段,患者的个体复发风险也存在很大差异[3-4]。因此,考虑到ACT对结肠癌(CC)的适度益处和相关毒性,寻找一种有效的生物标志物来前瞻性地区分能够从ACT中获益的患者,具有重要的临床意义。在ACT过程中,CC中许多重要的信号通路被解除调控,例如Wnt、Ras、p53信号通路。DEAH盒解旋酶(DHX)33是ATP依赖性RNA解旋酶的DEAH-box家族成员之一,对RNA代谢至关重要[5]。例如胞质DHX33参与mRNA翻译起始,而细胞核DHX33在细胞周期进展、迁移和核糖体RNA合成过程中调节特定的基因转录。重要的是,DHX33还被发现在感应dsRNA以启动先天性免疫反应中发挥关键作用[6]。然而DHX33在人类癌症中的作用仍然难以确定。本研究旨在分析组织DHX33表达与可切除CC患者术后ACT预后的关系,从而为探索DHX33对癌症进展的影响提供一些线索。
1 资料和方法
1.1 一般资料
本研究纳入了215例CC手术切除患者的甲醛固定-石蜡包埋(FFPE)组织。所有患者均于2014年1月至2018年9月期间在我院接受CC根治性切除。该研究由当地医院机构审查委员会审查和批准。在采集样本之前,获得每位患者的知情同意。纳入标准:(1)根 据国际抗癌联盟/美国癌症联合委员会第八版癌症分期系统(至少由两名我院病理学专家审查),经组织病理学或细胞学证实为原发性CC[7-8];(2) 接受肿瘤根治性切除,然后接受标准化疗方案;(3) 之前没有接受过化疗或放疗者。在免疫组识化学染色前,通过苏木精和伊红染色对所有标本进行鉴定,以确保肿瘤细胞富集。排除标准:(1) 术前接受新ACT和(或)辅助放疗者;(2)因肉眼可见的残留病灶或接受非根治性切除手术而接受R2切除术的患者以及未接受ACT的患者;(3)术后短期内(≤3个月)死亡者。
1.2 治疗及随访
进行标准的CC根治性切除后,由内科肿瘤学专家考虑患者术后恢复时间,个体化启动ACT。包括FOLFOX(奥沙利铂130 mg·m-2,d1,静脉滴注;亚叶酸钙200 mg·m-2,d1~d2,静脉滴注;5-氟尿嘧啶,d1~d2,静脉推注;5-氟尿嘧啶600 mg·m-2,静脉持续滴注,d1~d2。每2周为1个疗程)、FOLFIRI(伊立替康180 mg·m-2,d1,静脉滴注;亚叶酸钙400 mg·m-2,d1,静脉滴注;5-氟尿嘧啶400 mg·m-2,d1,静脉推注;之后给予5-氟尿嘧啶静脉泵入,2 400 mg·m-2,持续46 h。每2周为1个疗程)、XELOX(奥沙利铂130 mg·m-2,d1,静脉注射;希罗达1 000 mg·m-2,d1~d14,口服,每日2次。每3周为1个疗程)、sLV5FU2(亚叶酸钙400 mg·m-2,d1,静脉滴注;5-氟尿嘧啶400 mg·m-2,d1,1 200 mg·m-2,d2~d3,静脉输注,总量2 400 mg·m-2,输注46~48 h。每2周为1个疗程)或希罗达(希罗达1 000 mg·m-2,d1~d14,口服,每日2次,休息7 d。每3周为1个疗程)治疗。选定的患者在肿瘤位置、肿瘤浸润深度、直肠周围淋巴结转移、环切缘、合并症和术后表现评分方面评估后接受术后放疗。所有手术患者在前5年内每隔3个月或6个月进行1次随访,此后每年进行1次。从手术到第1次确诊复发的时间,或最后1次接触时没有复发的存活时间被定义为无病生存时间,从手术到最后1次随访或死亡的时间被定义为总生存时间。
1.3 组织DHX33表达检测
样本在离体20 min内采集,确保样本新鲜。在癌灶处取CC组织,在离癌灶远侧或近侧15 cm处取正常结肠组织作为对照。用甲醛固定,制备石蜡切片。取FFPE组织切片后,在二甲苯和分级乙醇溶液中脱蜡,水化,并在PBS中洗涤。在微波炉中预处理后,内源性过氧化物酶在3%过氧化氢/甲醇溶液中抑制20 min,然后使用生物素阻断试剂盒阻断亲和素。之后将载玻片与DHX33抗体(1∶400,货号sc-137424,美国Santa Cruz Biotechnology公司)在4 ℃潮湿室内孵育过夜,PBS洗涤,并与生物素化的山羊抗兔/小鼠抗体孵育。玻片用DAB显影,苏木精复染。半定量免疫组织化学(IHC)检测用于确定DHX33蛋白质水平。使用H评分法,将百分比评分乘以染色强度评分。阳性染色细胞的百分比评分为0(0)、1(1%~25%)、2(26%~50%)、3(51%~75%)、4(76%~100%)。强度评分为0(阴性染色)、1(弱染色)、2(中度染色)、3(强染色)。对于每种情况,随机选择1 000个细胞并进行评分。评分由两名病理学专家独立决定。H评分≥4分被判断为高表达。
1.4 其他检测指标
采用免疫组织化学染色检测FFPE组织错配修复蛋白[人类Mutl同源物1(hMLH1)、人类减数分裂后分离增强蛋白2(hPMS2)、人类MutS同源物(hMSH)2、hMSH6],任意1个以上蛋白表达缺失则视为微卫星不稳定(MSI)状态;抗体购自北京中杉生物技术有限公司。提取FFPE组织DNA,采用ARMS-PCR法检测BRAF V600E基因突变、KRAS基因外显子2第12、13位密码子突变,QIAamp DNA FFPE Tissue Kit 试剂盒和基因突变检测试剂盒购自德国QIAGEN公司。
1.5 统计学处理

2 结 果
2.1 DHX33在肿瘤组织和癌旁正常组织中的表达水平
IHC显示DHX33主要定位于细胞核和细胞质,在CC细胞中多呈阳性染色(图1)。与癌旁正常组织(17.67%,38/215)相比,53.95%(116/215)的肿瘤组织样本中DHX33呈高表达(χ2=61.545,P<0.001)。

图1 肿瘤组织和癌旁正常组织中DHX33蛋白表达(×400)Fig 1 DHX33 protein expression in tumor tissues and normal tissues adjacent to cancer (×400)
2.2 CC组织中DHX33表达水平与临床病理特征的关系
对比不同临床病理特征的DHX33不同表达状态,与DHX33低表达亚组相比,DHX33高表达亚组CC组织MSI比例、cTNM Ⅲ~ⅣA期比例及癌旁正常组织DHX33蛋白高表达比例更高(P<0.05)。见表1。
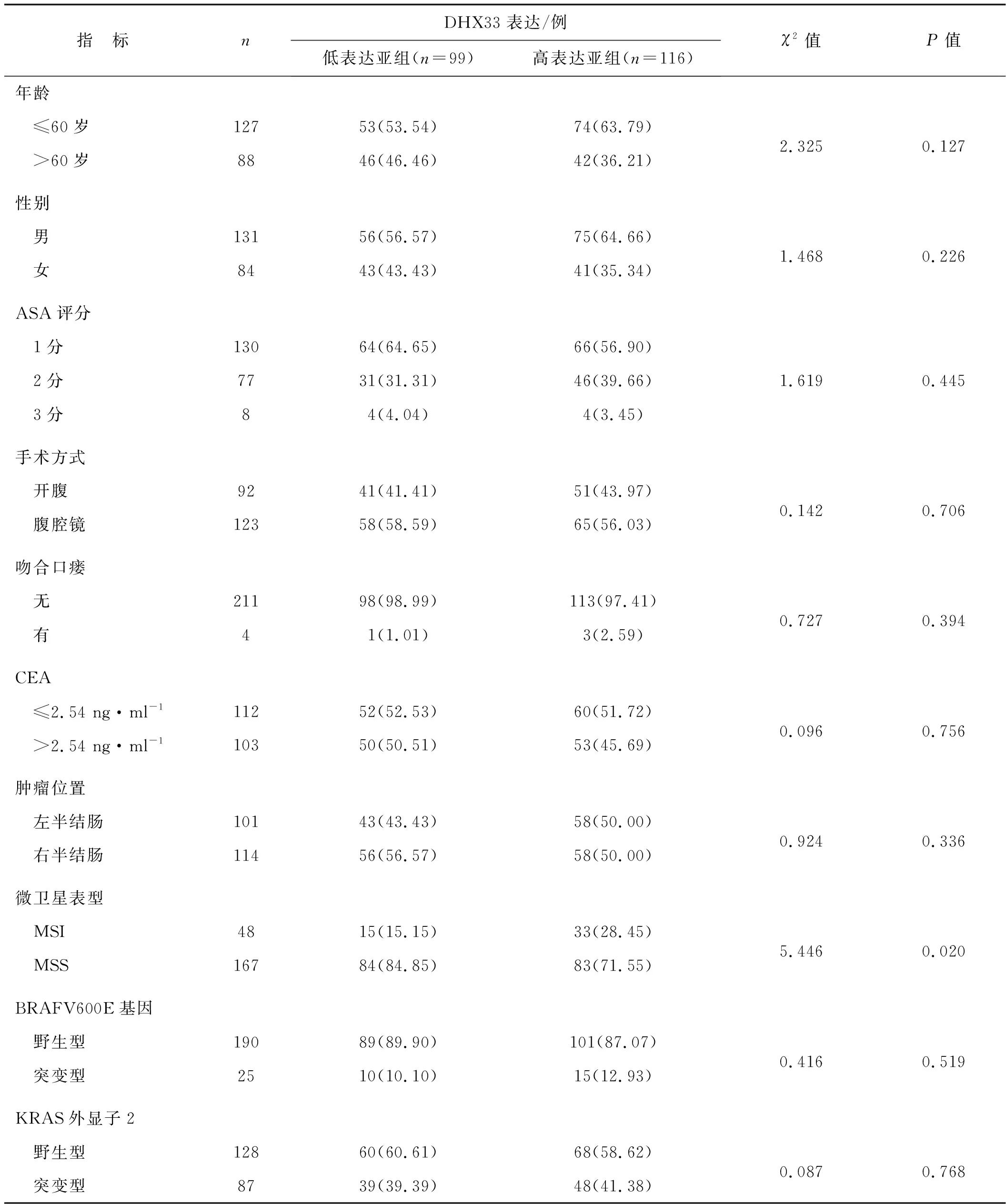
表1 CC组织中DHX33表达水平与临床病理特征的关系Tab 1 The relationship between the expression level of DHX33 in CC tissues and clinical pathological characteristics

(续表)
2.3 COX回归模型分析CC患者远期复发/生存预后
随访期内复发65例(30.23%),死亡44例(20.47%)。Kaplan-Meier分析(LOG-RANK检验)显示DHX33低表达者无病生存时间(χ2=12.566,P<0.001)和总生存时间(χ2=13.986,P<0.001)更长(图2)。此外,单因素及多因素COX回归分析结果显示,年龄、术前血清CEA水平、cTNM分期、病理分级、CC组织DHX33蛋白表达是影响手术+ACT治疗后复发和远期死亡的独立危险因素(P<0.05,表2、3)。

图2 肿瘤组织DHX33表达状态与CC患者生存时间的Kaplan-Meier生存曲线Fig 2 Kaplan-Meier survival curve between DHX33 expression status in tumor tissue and survival time of CC patients

表2 单因素分析影响CC患者预后不良的临床因素Tab 2 Univariate analysis of clinical factors affecting poor prognosis of CC patients

表3 多因素分析影响CC患者预后不良的临床因素Tab 3 Multivariate analysis of clinical factors affecting poor prognosis of CC patients
3 讨 论
CC的发病是一个多基因相关、多步骤的复杂过程[9-11]。根治性切除手术后的ACT是Ⅱ期和Ⅲ期CC患者的标准治疗方法,可大大降低局部复发率并提高患者的生存预后。然而一部分患者无法在ACT中获益[12]。既往有很多与CC术后ACT预后相关的预测生物标志物研究[13-15],然而灵敏度和特异度有限。在本研究中,我们调查了可切除CC中DHX33蛋白的表达,并发现DHX33高表达的肿瘤患者术后复发风险更高。据我们所知,这是第1项证明DHX33可以作为术后复发的预测性生物标志物的研究。
DEAD/H盒蛋白属于RNA解旋酶中最大的一类,具有多种保守基序,包括Asp-Glu-Ala-Asp/His(DEAD/H)。已发现这些蛋白质在涉及RNA/DNA结构改变的许多细胞过程中发挥重要作用,例如翻译起始、核/线粒体mRNA剪接、核糖体/剪接体组装、miRNA生物发生和RNA衰变。DHX33是DEAD/DEAH盒蛋白家族的成员,在肺癌、肝癌和淋巴瘤中高度表达[16-17]。Wang等[18]发现,DHX33基因下调可导致胶质母细胞瘤细胞在体外和体内的增殖和迁移显著降低。在机制上,DHX33可调控一组参与细胞周期和细胞迁移的关键基因,以促进胶质母细胞瘤的发展,这也强调了其在治疗胶质母细胞瘤中的潜力[18]。此外DHX33缺乏可导致Bcl-2下调和BAD上调,以支持CC细胞凋亡[19]。基于上述数据分析,我们推断DHX33在CC中的过度表达对于维持CC的恶性表型至关重要,并且可能参与CC的发生和发展。这一点也解释了本研究中组织DHX33过表达与肿瘤进展和术后复发有关。
最近Wang等[20]发现,DHX33基因消融消除了大多数由Ras驱动的肺腺癌发展。但在少数情况下,仍然能观察到DHX33基因敲除小鼠出现恶性病变,尽管效率和速度都要低得多,这可能是由于替代上游信号的激活。Wnt途径中的β-连环蛋白可随着DHX33基因敲除而显著下调,这意味着DHX33在调节Wnt信号中起着关键作用[5]。RNA解旋酶DHX33已被证明是细胞增殖和生长的关键调节因子。然而,其功能背后的潜在机制仍不完全清楚,目前的一些证据表明DHX33转录控制参与细胞周期的基因表达,尤其是细胞周期蛋白、E2F1、细胞分裂周期和微染色体维持基因。DHX33与这些基因的启动子发生物理关联,并控制活性RNA聚合酶Ⅱ在这些启动子上的装载。DHX33缺乏会破坏细胞周期进程和DNA复制,并导致细胞凋亡。例如Yuan等[21]发表的一项来自肺组织的RNA测序分析表明,DHX33缺乏可导致基因表达的整体变化。由于这些RNA是从具有异质细胞起源的肺组织中提取的,我们不能排除许多基因在癌症发展过程中受到DHX33间接调控或仅受Ras调控的可能性。尽管如此,DHX33显然在Ras驱动的肿瘤发生过程中起着关键和多方面的作用。这也解释了为何CC肿瘤被根治性切除后,组织DHX33高表达仍然能够预测术后复发风险。
综上,本研究表明,原发性肿瘤组织中DHX33高表达可能是CC患者根治性手术+ACT治疗后复发和死亡的强有力的预测因子。因此DHX33可作为一种临床生物标志物,用于识别可从ACT积极管理策略中获益的患者。
