单/同轴载SM药/微球支架的制备及性能研究
2023-01-07陈宇彤姜朝瑞张旭婧印治涛
陈宇彤,姜朝瑞,许 燕,张旭婧,印治涛
(新疆大学 机械工程学院,新疆 乌鲁木齐 830047)
0 引言
骨结核是一种常见的肺外结核,其特征是在局部形成脓肿、肉芽肿、干酪样坏死和隔离等病变。这些病变通常导致局部血液循环极差,抑制抗结核药物通过血液运输到达病灶,延长了口服维持药物局部有效浓度的周期[1]。手术清创是治疗骨结核的另一重要方法。然而,完全清除结核杆菌是极其困难的。术中病灶区未清理彻底的结核杆菌和口服抗结核药物到达病灶区浓度较低导致的反复用药是骨结核复发和产生耐药性的根本原因。因此,改善和维持术后残留腔内的抗结核药物浓度已成为治疗这一病症的主要研究方向。
1995年,Grane等[2]提出骨组织工程学的概念。生物3D打印作为一种新兴的制造技术,广泛应用于骨组织工程支架(简称骨支架)的成型。生物3D打印技术通过CT扫描收集患者病灶处的骨缺损数据,使用计算机辅助设计,建立与骨缺损部位相匹配的3D模型,再根据需求选用合适的材料,使用生物3D打印设备制备出与病灶处尺寸和功能相匹配的骨支架,其优势在于能够打印出具有理想孔隙率和孔径的支架,利于活性细胞黏附[3-4]。载抗生素的骨支架可控制感染,显著提高抗生素的释放可控性,改善细胞增殖、分化性能,有助于骨组织愈合[5]。载药微球与骨支架的结合,不仅可在一定程度上控制支架的释药速率,还可提高药物利用率,从而减少药物对人体的损伤[6]。生物3D打印技术制备载药微球骨支架已成为研究骨结核治疗的主要技术手段。
羟基磷灰石(Hydroxyapatite, HA)又称为羟磷灰石,是骨基质中的主要无机物,机械性能和生物性能较好,在骨领域中具有较好的再矿化作用及脱敏效果[7]。聚乙烯醇(Polyvinyl Alcohol,PVA)是一种具有亲水性、粘接性、生物相容性和优良力学性能的高聚物,被广泛应用于生物胶水、薄膜和纳米纤维的制备[8]。Wang等[9]制备出PVA/HA骨支架用于骨缺损的治疗,研究表明HA具有良好的生物相容性和机械性能,是一种理想的医用可植入材料。丝素蛋白(Silk Fibroin,SF)约占蚕茧重量的70%,由于其具有非致癌性、无毒性、低免疫原性和良好的生物相容性、可降解性,被广泛应用于生物医学领域[10]。SF具有突出的韧性和机械强度,通过细胞增殖、生长以及迁移参与伤口愈合过程的不同阶段来诱导伤口愈合[11]。刘海兰等[12]选用磷酸钙作为支架基材,单乳化法制备聚羟基丁酸羟基戊酸酯微球,得到复合体系的载药微球支架,研究表明,适量的微球可增强复合支架的最大抗压强度。安田田等[8]选用HA作为支架基材,通过正交实验探究SF/PVA/HA之间的最优材料配比,制备SF/PVA/HA微球支架,研究表明,SF溶液浓度为3%,SF与PVA质量比为1∶5、SF/PVA水凝胶与HA的比为1.6 mL∶1 g时,支架具有优良的机械性能、生物安全性及较高的孔隙率。氧化石墨烯(Graphene Oxide, GO)具有较大的比表面积,能够提高支架载药量,同时具有低毒性、良好的降解性、抗菌性和亲水性[13-14]。王博蔚等[15]以GO/SA/CS复合水凝胶为材料制备支架,研究发现,GO的加入使复合支架材料的溶胀比降低,降解性能和机械性能均得到了提升。链霉素(Streptomycin, SM)是临床上治疗结核病常用的一线药物,通过与结核杆菌RNA结合,干扰结核杆菌蛋白质合成,破坏结核杆菌细胞膜的完整性,最终抑制或杀灭结核杆菌[16]。
本研究采用生物3D打印成型装置,以HA作为支架基材,GO/PVA复合凝胶作为粘结剂,SM作为抗结核药物,制备出单/同轴内芯载SM原药、SF/SM载药微球、GO/SF/SM载药微球六组支架。分别对各组支架进行体外降解实验、力学性能测试、药物释放实验,对比选出满足人体松质骨处缺损各性能要求的复合支架,为后期载药微球骨支架应用于骨结核的临床治疗提供新思路。
1 实验方法
1.1 试剂和仪器
丝素蛋白(SF)(自制);氧化石墨烯(GO)溶液(南京先丰纳米科技有限公司);聚乙烯醇(PVA)(北京博奥拓达科技有限公司);GO/PVA复合凝胶(自制);羟基磷灰石(HA)(纯度96%,粒径40 nm,河南新源科技有限公司);去离子水(上海穗天环保科技有限公司);1× 磷酸盐缓冲液(1× PBS)(pH=7.0~7.2,美国HyClone公司);链霉素(SM)(上海源叶生物科技有限公司);司盘-80(span-80)、溴化锂(LiBr)、碳酸钠(Na2CO3)(北京博奥拓达科技有限公司);蛋白酶XIV(8.9 U/mL,上海源叶生物科技有限公司)。
扫描电镜(SUPRA55vp,北京国鼎环科技术有限公司);数显恒温水浴锅(HH-1,金坛市城东新瑞仪器厂);离心机(长沙湘仪离心机仪器有限公司);高精度数字电子秤(浙江凯丰集团有限公司);冷冻干燥箱(力辰科技有限公司);数显恒温磁力搅拌器(常州越新仪器制造有限公司);紫外分光光度计(浙江力辰科技有限公司);恒温震荡器(浙江纳德科学仪器有限公司);微机控制电子万能试验机(WDW-20,方辰仪器设备公司);自主研制3D打印成型装置。
1.2 SM标曲方程
使用高精度电子秤称量10 mg SM原药与PBS混合,配置出100 μg/mL PBS混合液,将其分别稀释为10 μg/mL、12.5 μg/mL、15 μg/mL、17.5 μg/mL、20 μg/mL;使用紫外分光光度计选定波长203 nm处测其吸光值。经实验拟合得SM药物标准曲线方程:Y=0.033 6X-0.001 7,相关系数R2=0.999。
1.3 SF溶液的制备
使用高精度电子秤称取一定质量的蚕茧与Na2CO3溶液混合后置于磁力搅拌器中搅拌,30 min后用去离子水清洗脱胶,重复3次后将所得产物烘干;称取脱胶的蚕茧20 g浸润于80 mL的LiBr烧杯中,加热搅拌1.5 h后装入透析袋,用去离子水浸泡4 d,每4 h更换溶液;离心取上清液置得SF溶液,测其浓度为3.5%[17]。
1.4 载药微球的制备及性能表征
采用乳化法制备GO/SF/SM微球。盛取一定量GO溶液与SF溶液共混为水相,置入盛有SM原药的烧杯中搅拌待用;盛取一定量液体石蜡与span-80共混为油相置于烧杯中;将水相与油相混合反应一段时间后,加入有机溶剂异丙醇(C3H8O),溶液匀速搅拌,制得混合溶液;将混合溶液使用胶头滴管垂直向下滴至离心管,离心去除上清液;加入C3H8O,溶液离心两次去除上清液;加入PBS离心一次去除上清液;将其底部白色沉淀冻干1 d,即得GO/SF/SM载药微球。SF/SM微球制备与其步骤相同[15]。微球形貌电镜图如图1所示,SF/SM载药微球,如图1(a)所示,大部分微球发生黏连和团聚现象,仅得到少部分完整的微球,这对微球的载药量和包封率均产生了一定的影响;GO/SF/SM载药微球如图1(b)所示,微球粒径均匀、个体完整,几乎未发生黏连和团聚现象,这是由于GO的分散性将各微球分离,较大的比表面积很好地包封了SM原药[18]。

图1 载药微球SEM图Fig.1 SEM image of drug-loaded microspheres
1.5 GO/PVA复合凝胶的制备
使用高精度电子秤称取一定量的PVA晶体与去离子水混合加热搅拌1 h后,即得PVA凝胶;超声处理GO溶液(0.1 mg/mL)1 h后将其沿杯壁流至PVA凝胶中,搅拌均匀后,即得0.1%GO/PVA复合凝胶,待其冷却至室温,4 ℃冷藏保存备用。
1.6 载药支架的制备
1.6.1负载SM原药支架的制备
使用自制的3D打印成型装置,设置打印速度为20 mm/h,制备出单/同轴载药骨支架。其中,单轴载药骨支架直径为0.6 mm,尺寸为10 mm×8 mm×8 mm,载药量约为20 mg;同轴载药骨支架内径为0.6 mm,外径为0.84 mm,尺寸为10 mm×8 mm×8 mm,载药量约为20 mg。
按溶质比为0.1∶1.4∶1分别称取一定量SM原药、GO/PVA复合凝胶及HA粉末于陶瓷坩埚中混合搅拌;待均匀后上料打印,即得负载SM原药的单轴支架。
按溶质比为1.4∶1分别称取一定量GO/PVA复合凝胶及HA粉末于陶瓷坩埚中混合搅拌,即得同轴支架的外芯材料,内芯材料制备过程与负载SM原药的单轴支架相同。
1.6.2载药微球支架的制备
将一定量的SF/SM载药微球与SM原药混合制备单轴载SF/SM微球支架,为便于后期对比分析,设定单个支架SM总药量为20 mg。单轴GO/SF/SM微球的制备与单轴SF/SM微球的制备方法相同,仍需保证单个支架SM总药量为20 mg。同轴支架内芯的制备与单轴载SM原药支架的制备方法相同,外芯的制备与同轴载SM原药支架外芯的制备方法相同。
1.7 成形单/同轴骨组织工程支架宏观结构
单/同轴载药/微球支架均成型效果良好,尺寸规整,达到制备预期效果。骨支架结构中的贯通孔径尤为重要,合适的贯通孔径利于活性细胞的黏附和迁移,利于SM药物在病灶区的缓释,可在后期体外降解和药物释放实验中得出结论[19]。图2是单/同轴载SM原药支架图,根据测量,除单轴载SM原药支架,其余支架贯通孔径均较大。

图2 单/同轴载SM原药支架图Fig.2 Image of monaxial/coaxial scaffolds with SM drug-loaded
由于本研究中单轴支架基材与同轴支架内、外芯基材一致,呈灰白色,虽然载药微球呈灰黄色,但经过支架基材的包封后,只呈现内芯材料的灰白色,故无法通过支架的宏观形貌区分单轴支架与同轴支架。由于单、同轴支架中均包含支架基材、SM原药与载药微球,其微观形貌无明显区别,也无法通过支架的微观形貌区分支架的单、同轴结构。单、同轴结构的形貌与性能差异仅能从下文中支架的降解、释药特性加以区分。因此,图2中仅放置单/同轴载SM原药支架图,以展示支架宏观形貌。
1.8 载药骨支架体外降解研究
使用高精度电子秤称取冷冻干燥处理后的各单/同轴载药/微球支架,设置三个平行样,避免误差;称取25 mg活性为8.9 U/ml的蛋白酶与223 mlPBS混合后使用胶头滴管滴入盛有各支架的离心管,离心12周;其中,每2周取出支架干燥称重,求加权平均值并计算降解率后更换PBS混合液。降解率(Dr)公式[20]如下:
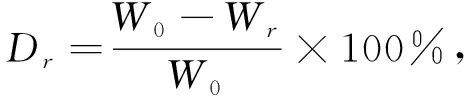
(1)
式中:Dr为支架降解率;W0为单个支架初始质量,g;Wr为单位时间点称取支架干燥后质量,g。
1.9 力学性能测试
将6组单/同轴载药/微球支架平行样分别置于压缩试样机的载物台上进行压力测试,设定最大负载为1 kN,位移速度为1 mm/min,计算各支架最大抗压强度σmax和弹性模量E。最大抗压强度σmax和弹性模量E公式分别如下:

(2)
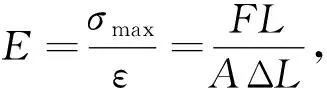
(3)
式中:F为试件破坏时的最大载荷,KN;A为试件接触面面积,mm2;σ为试件正应力,MPa;ε为应变;L为试件高度,mm;ΔL为轴向形变量,mm。
1.10 药物释放曲线
使用高精度电子秤称重干燥后的各支架平行样并记录数据后与溶有活性蛋白酶的PBS混合离心12周,实验开始2 d后取上清液5 ml冷藏,加入等量的含酶PBS继续离心,每隔1周重复此操作[21]。12周后,使用紫外分光光度计测定各样本吸光度,计算其体外累计释药率。
2 成形单/同轴骨支架性能对比分析
2.1 成形单/同轴骨组织工程支架降解微观结构对比分析
为探究支架降解12周的微观变化,沿纵垂线方向截断支架,对断面进行SEM检测。由图3(a)、(b)可以看出,单/同轴载SM原药支架降解均匀,仅有少部分孔隙生成;对比图3(a)、(c)与(b)、(d)发现,单/同轴载SF/SM微球支架截面存在较多的不规则孔隙,这进一步地验证了载药微球的加入加速了支架的降解;对比图3(c)、(e)与(d)、(f)发现,GO的加入加速了支架的降解,使支架截面产生多个较大的不规则孔隙;由于同轴支架的内、外芯基材相同,使其具有较好的结合性,未出现明显的内、外芯边界,对支架降解未产生影响。
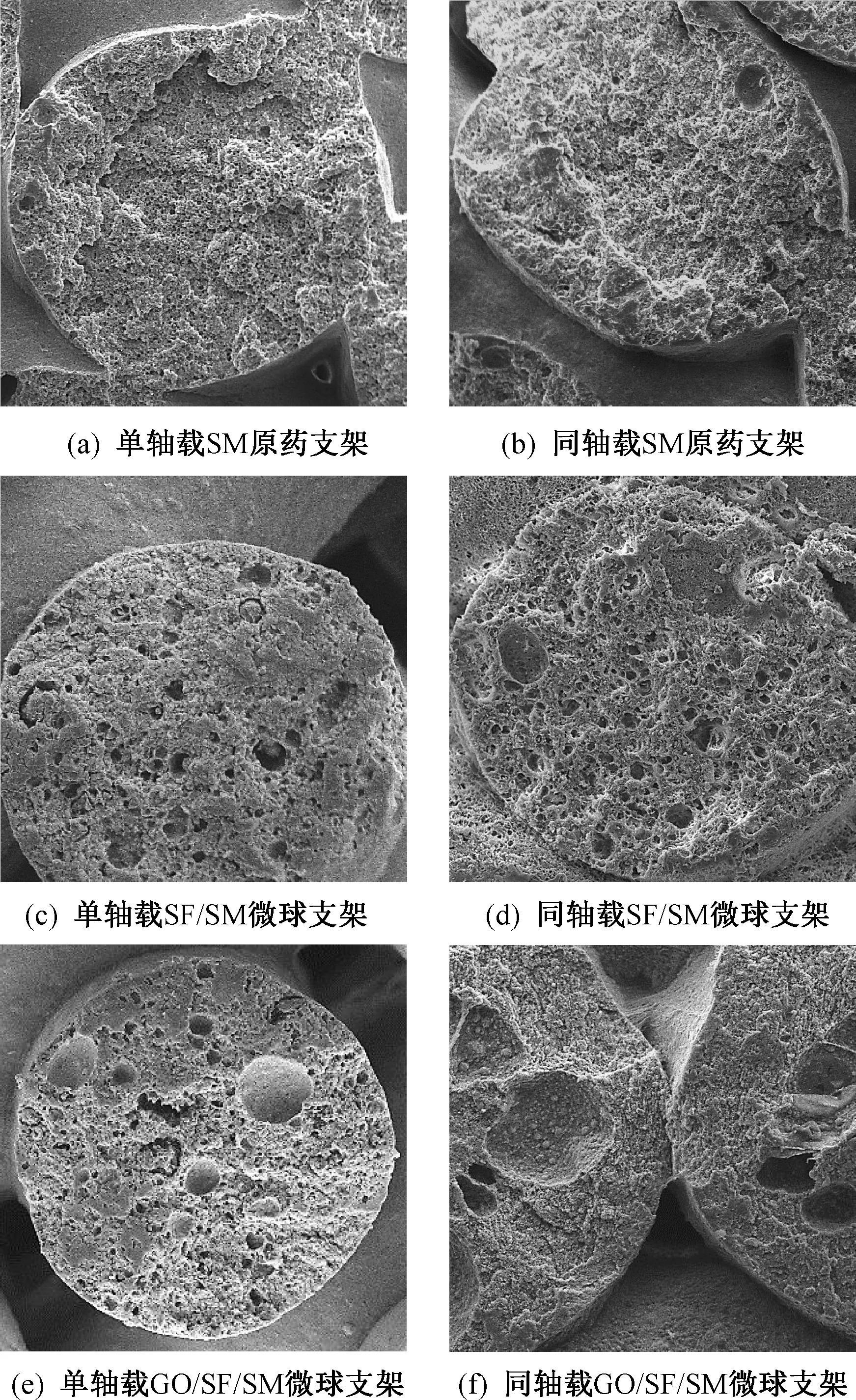
图3 支架降解12周后断面SEM图Fig.3 SEM image of section on degradation of scaffolds after 12 weeks
2.2 降解性能对比分析
本实验采用HA作为单/同轴骨支架的基材,制备出6组单/同轴载药/微球支架。将支架置于含活性蛋白酶的PBS混合液中进行体外降解实验,目的是使实验更接近人的体液环境,从而使数据更具有说服力。从之前的研究中发现,HA降解率较低,故本实验主要考察支架在2~12周内的降解情况。
图4为单轴支架12周降解趋势,从图4可以看出,各单轴支架在2~4周降解速率较快且载SM原药支架降解速率明显高于载SF/SM微球支架,这可能是由于降解初期,药物释放速率大于微球裂解速率,载SM原药支架中的SM药物快速释放使支架表面生成更多的孔隙,增加了支架与PBS混合溶液的接触面积,从而加剧了降解速率,而载GO/SF/SM微球支架降解速率基本与载SM原药支架保持一致,这可能是由于载药微球中的GO具有良好的亲水性和降解性,促进了载药微球的降解;4~12周时载SM原药支架降解趋于平缓,其余两组支架降解速率与降解前期基本一致,这可能是由于载SM原药支架中的SM药物前期已基本释放,而其余两组支架随着载药微球中药物的释放,支架表面孔洞不断增多,增加了支架与PBS混合液的接触面积,并且各载药微球均匀降解,与未降解的载药微球形成动态稳定,使支架仍保持着较为均匀的降解速率;在整个降解过程中,单轴载GO/SF/SM微球支架表现出较优的降解率。

图4 单轴支架12周降解趋势Fig.4 Degradation trend of monaxial scaffolds in 12 weeks
图5为同轴支架12周降解趋势,从图5可以看出,2~4周时,除同轴内芯载SM原药支架,其余两组载SM微球支架在各个降解阶段均表现出较为均匀的降解速率,这可能是由于降解初期,随着支架外芯的SM药物的降解,外芯产生大量孔洞,这些孔洞致使内芯中SM药物随孔洞向外芯扩散,增大了与PBS混合液的接触面积,同时随着外芯HA的缓慢溶解,使支架表面孔洞增多,从而加快了支架整体的降解,而其余两组支架内芯载SM微球的裂解速率低于药物释放速率,所以并无明显的降解现象,保持了平稳的降解速率;4~12周时,由于同轴内芯载SM原药中仅剩部分SM药物和不易降解的HA,使其降解速率又趋于平稳,载SM微球的两组支架中孔洞的增加和微球的降解维持着良好的动态稳定,使其与单轴载药/微球支架情况类似,保持着良好的降解速率。

图5 同轴支架12周降解趋势Fig.5 Degradation trend of coaxial scaffolds in 12 weeks
对比图4、图5可以发现,相同时间内,单轴载药/微球支架的质损量更高。表1为单/同轴载药/微球支架12周降解率。结合表1可对比看出单轴载药/微球支架的降解率略微高于同轴载药/微球支架,降解率差为0.2%~1.36%。而单轴载SM原药支架的降解率较同轴载SM原药支架的降解率低0.33%,这可能是由于载药微球中药物的缓慢释放形成了更多的孔洞,促进了PVA与HA的降解。12周后,单轴载SF/SM微球支架的降解率与同轴载SF/SM微球支架的降解率几乎相同,这可能是因为虽然外芯结构中的HA与PVA较难降解,但由于降解前期,SM原药的扩散致使外芯结构有较多的孔洞,给微球与PBS混合液提供了接触通道,弥补了HA与PVA降解慢的缺陷,这也说明外芯结构的增加并不会降低同轴载药/微球支架的降解速率。

表1 单/同轴载药/微球支架12周后降解率Tab.1 Degradation rate of monaxial/coaxial drug-loaded microspheres scaffolds after 12 weeks
2.3 力学性能分析
表2为单/同轴支架降解2周后力学性能,由表2可得,当单/同轴载药/微球支架降解了2周时,同轴支架的最大抗压强度和弹性模量整体优于单轴支架,其中,最大抗压强度相差2.22~2.67 MPa,弹性模量相差9.84~11.82 MPa,这意味着同轴支架中外芯结构的增加提高了支架的力学性能。
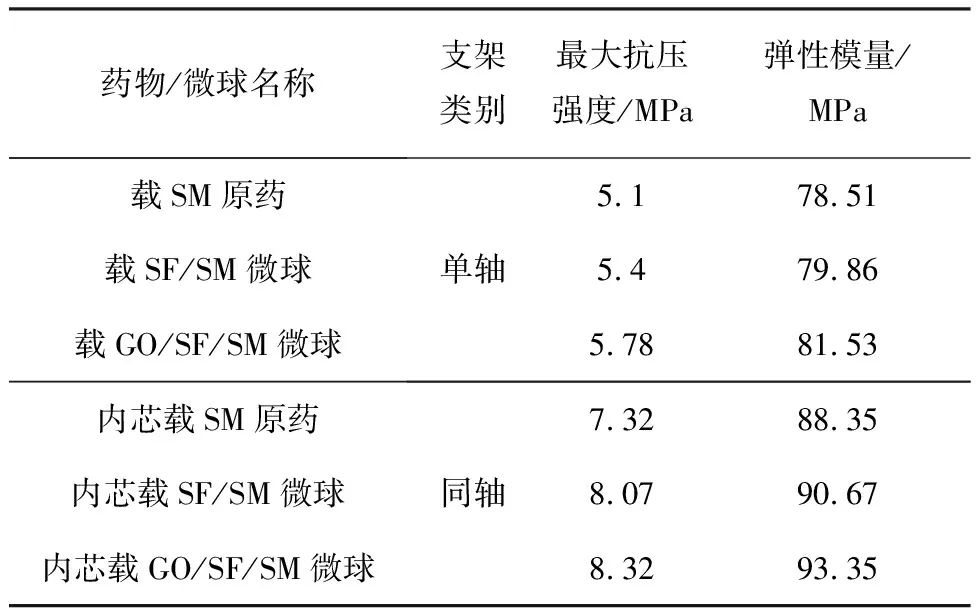
表2 单/同轴支架降解2周后力学性能Tab.2 Mechanical property of monaxial/coaxial scaffolds after 2 weeks of degradation
表3为单/同轴支架降解12周后力学性能,由表3可得,当降解了12周时,各支架力学性能明显降低,这是由于随着支架的降解,支架孔洞的增多,使支架结构变得疏松,力学性能大大降低。与第2周相比,最大抗压强度降低了2.45~3.98 MPa,弹性模量降低了32.07~41.48 MPa,但值得一提的是,由于GO具有优异的理化性能,使同轴GO/SF/SM载药微球支架仍具有较好的力学性能,满足人体松质骨缺损处的力学强度要求。
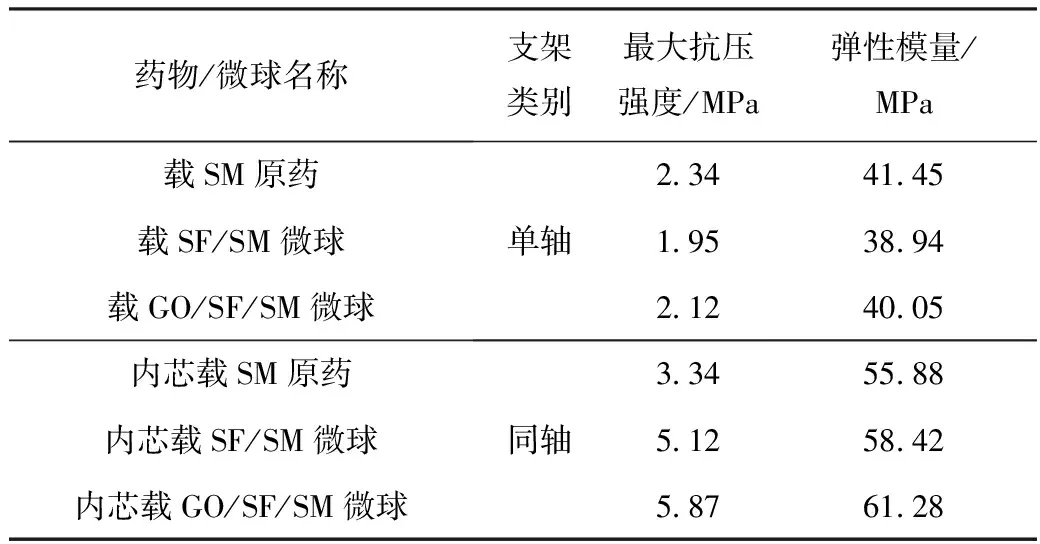
表3 单/同轴支架降解12周后力学性能Tab.3 Mechanical property of monaxial/coaxial scaffolds after 12 weeks of degradation
2.4 释药性能分析
图6为单/同轴支架累积释药率,由图6可知,第0周时,单轴载SM原药支架的累积释药率约为62.07%,同轴载SM原药支架的累积释药率约为58.14%,这说明同轴结构使支架释药率降低了3.93%,优化了药物突释问题;随着释药时间的增加,各支架累积释药率的差距日趋明显,其中,同轴载GO/SF/SM微球支架1周累积释药率达65.85%,与单轴载GO/SF/SM微球支架相比,累积释药率降低了6.72%,12周后,同轴载GO/SF/SM微球支架的累积释药率达75.1%,比单轴载GO/SF/SM微球支架低5.21%,实现了载药微球支架的药物控释和多级梯度缓释:首先,同轴支架外芯的PVA/HA混合材料进行药物缓释,其次,GO/PVA/HA混合材料与未包封于微球的SM药物进行药物缓释,最后,由SF包封的SM载药微球进行药物缓释,这显著地克服了药物突释问题并达到了平稳持续的药物缓释效果。

图6 单/同轴支架累积释药率Fig.6 Cumulative drug-release rate of monaxial/coaxial scaffolds
3 总结与展望
本研究通过乳化法制备载SM微球,利用自制的3D打印成型装置制备单/同轴载SM原药支架、单/同轴载SF/SM微球支架与单/同轴载GO/SF/SM微球支架,通过实验得出以下结论:
1) 通过12周体外降解实验发现,微球的加入加速了支架的降解,同轴支架的外芯结构不会影响支架的降解,同轴载SF/SM微球支架与同轴载GO/SF/SM微球支架有较高的降解率。
2) 通过力学测试发现,同轴载GO/SF/SM微球支架的力学性能最优,虽然12周后力学性能有所下降,但仍满足人体松质骨缺损部位的使用要求。
3) 通过12周释药实验发现,同轴GO/SF/SM载药微球支架优化了药物突释问题,实现了药物控释和多级梯度缓释。
因此,本研究结果表明,同轴GO/SF/SM载药微球支架能够有效解决药物突释问题且具有一定的力学性能,对利用载药骨支架治疗骨结核引起的骨缺损具有一定的借鉴意义。下一步,为使载药微球支架具有更好的力学性能和控缓释药物能力,将利用TPMS法对支架结构进行改良。
