油樟愈伤组织诱导及细胞悬浮培养体系的建立
2023-01-06何秀燕
何秀燕,魏 琴,2,赵 鑫
(1.宜宾学院农林与食品工程学部,四川宜宾 644000;2.四川省油樟工程技术研究中心,四川宜宾 644000)
油樟(Cinnamomum longepaniculatum(Gamble)N.Chao ex H.W.Li)是樟科樟属常绿乔木,为亚热带地区特有树种[1],具有很高的经济价值和生态意义.油樟在宜宾栽培面积大,宜宾素有“油樟王国”的美誉[2-4].油樟叶片利用水蒸气蒸馏法可得油樟精油,种子经压榨亦可得精油(可用作工厂制香皂、润滑油等).油樟精油富含多种植物次生代谢物,化学成分大约100余种.油樟精油1,8-桉叶素成分可达50%~60%,该成分具有抗菌消炎[5]、疏风解热、祛湿解毒、杀虫的作用[6,7],广泛应用于医疗和化工方面.
植物不同部位影响外植体愈伤组织的产生[8].樟科樟属植物龙脑樟组织培养及愈伤组织诱导研究较多.龙脑樟嫩枝通过适宜的培养基可以诱导出愈伤组织,且能够提取出右旋龙脑[9].通过对龙脑樟腋芽诱导,获得无菌苗及愈伤组织[10].不同的培养基激素浓度与配比,影响龙脑樟茎段诱导出芽或愈伤组织[11].通过植物组织培养技术对植物原生质体进行细胞悬浮培养[12],细胞悬浮可产生次生代谢产物,应用于生物制品的研发与开发等[13].植物细胞悬浮培养是将固体培养基上质地疏松、生长旺盛的植物愈伤组织转移至液体培养基,以获取大量均一的植物细胞培养物[14].培养材料、培养成分、培养条件和方式等因素影响林木悬浮体系的建立[15].目前,油樟组织培养研究主要集中在培养基成分、激素种类及浓度等方面.培养基中蔗糖浓度、琼脂含量、细胞分裂素含量等因素对油樟试管苗玻璃化有明显影响[16].培养基中无机盐浓度、抗生素含量及光照处理对油樟愈伤组织生长具有明显影响[17].为进一步提升油樟组培扩繁水平,消毒剂、基本培养基、激素等因素被广泛研究[18].不同培养基及不同激素种类对油樟悬浮细胞的生长及其次生代谢产物有着显著的影响[19].樟属植物叶水浸提液对油樟悬浮细胞生长无明显影响,但对悬浮细胞挥发性物质积累有一定的影响[20].影响植物愈伤组织及悬浮细胞生长的因素很多,基本培养基、外植体类型、激素浓度、光照、pH值和碳含量如何影响油樟愈伤组织产生及细胞悬浮培养目前尚无明确研究.因此,本研究以油樟一年生幼嫩枝条茎段、叶片为材料,结合不同培养基、不同6-BA浓度筛选出适宜愈伤组织诱导的外植体和基本培养基;进一步分析NAA浓度、蔗糖含量、pH值、光照等环境条件对油樟悬浮细胞生长及其代谢产物的影响,筛选出适宜的油樟愈伤组织诱导体系,同时建立油樟细胞悬浮培养体系,可为进一步研究油樟细胞悬浮培养、进一步工业化提取油樟次生代谢产物提供理论依据与研究基础.
1 材料与方法
1.1 材料
分别选取当年生油樟功能叶片、一年生幼嫩茎段(图1)为外植体进行诱导愈伤组织.

图1 油樟外植体
1.2实验方法
(1)诱导油樟愈伤组织最佳外植体、培养基及激素浓度的筛选.将外植体分别接种到B5(NAA 0.01mg/L,6-BA 2mg/L)和MS(NAA 0.01mg/L,6-BA 2mg/L)固体培养基中,每个处理30瓶,重复3次.培养条件为:温度25±2℃,光照(1000~2000)Lx,光照时间16 h/d,培养30 d后统计外植体愈伤组织诱导率及污染率,筛选出适宜诱导愈伤组织的外植体材料及适宜外植体生长的初代培养基:

将筛选出的最适外植体接种于初代培养基,设置三个6-BA激素浓度梯度:0 mg/L、2.0 mg/L、4.0 mg/L.每组接种30瓶,重复3次.培养30 d后记录愈伤组织生长情况,统计其诱导率,筛选出诱导愈伤组织最佳的激素浓度.
(2)油樟悬浮细胞培养最佳NAA浓度筛选.将油樟愈伤组织转接于B5+6-BA(4.0mg/L)液体培养基中进行悬浮培养(转速110 r/min,温度25±2℃,pH值5.8).设 置3个NAA浓 度 梯 度:0 mg/L、0.5 mg/L、1.0 mg/L.每组设置6个重复,每5 d观察一次,记录细胞悬浮生长状态.
(3)油樟细胞悬浮培养体系优化.以B5+6-BA(4.0 mg/L)+NAA(1.0 mg/L)为基本培养基,分别改变油樟悬浮细胞培养基中糖含量、pH值、光照.蔗糖含量设置三个处理:0 g/L、20 g/L、40 g/L;pH值设置3个处理:6.0、6.8、7.2;光照设置两个处理:光照(2000 Lx)、黑暗(0 Lx).每个处理6个重复,培养条件:转速110 r/min,温度25±2℃.每5 d观察一次,记录其生长状态,并用紫外分光光度计测定每次的总酚、类黄酮和总抗氧化的吸光值,以及用电子天平测定其干重和鲜重.
1.3 数据处理
通过SPSS 26.0软件进行单因素方差分析和显著性分析(p<0.05).
2 结果与分析
2.1 油樟愈伤组织诱导及悬浮培养
2.1.1 诱导油樟愈伤组织最佳外植体、培养基及6-BA浓度
将油樟叶片及枝条分别接种于B5、MS培养基,分析培养基对油樟不同外植体诱导愈伤组织的影响.相同培养基条件下,油樟茎段愈伤组织出愈率显著高于叶片,叶片玻璃化严重(图2),因此幼嫩茎段适宜诱导愈伤组织.B5培养基诱导的愈伤组织结构疏松,颜色呈淡黄色,更适宜细胞悬浮培养.MS培养基诱导的愈伤组织质地致密,颜色呈浅绿色,不利于细胞悬浮培养(图2).B5培养基外植体污染率显著低于MS(表1).因此,将油樟幼嫩枝条接种于B5培养基有利于愈伤组织诱导,且污染率低.
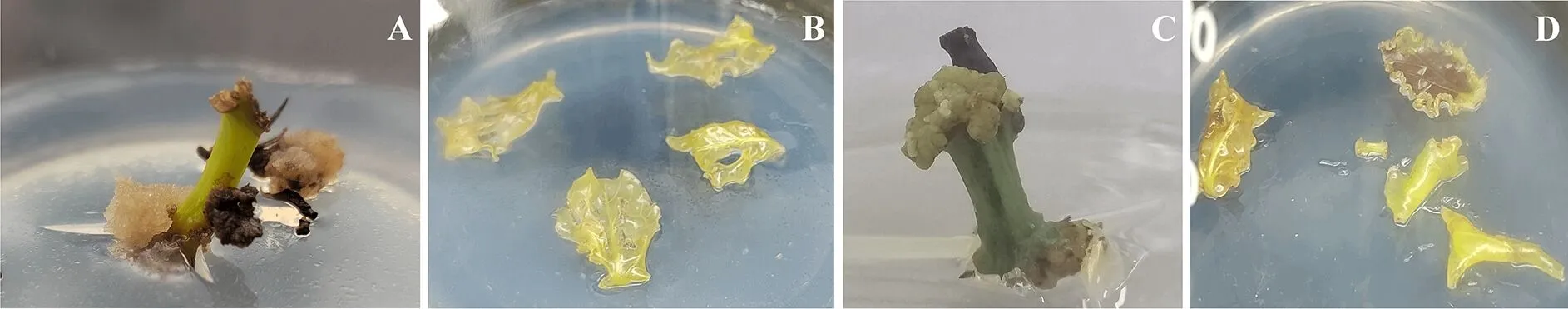
图2 不同培养基诱导油樟愈伤组织

表1 不同培养基和外植体出愈率及污染率
以油樟一年生幼嫩枝条为外植体,B5为基本培养基,分别设置6-BA三个浓度梯度,分析6-BA浓度对油樟愈伤组织形成的影响,发现4.0 mg/L处理下外植体易形成愈伤组织,结构疏松适于悬浮培养,颜色呈淡黄色(图3C),且污染率显著低于其他处理(表2).在0 mg/L处理外植体正常生长,切口处褐化,但愈伤组织诱导率低(图3A),出愈率仅为6.7%,且污染率高达66.7%(表2).2.0 mg/L 6-BA处理外植体虽能产生愈伤组织,但愈伤组织结构紧密、质地坚硬,不易进行悬浮培养(图3B).

图3 不同浓度的6-BA诱导油樟愈伤组织的影响
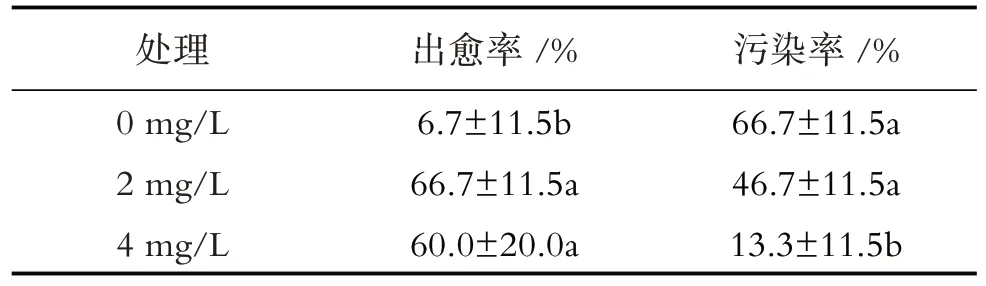
表2 不同浓度6-BA对出愈率及污染率的影响Table 2 Effects of different concentrations of 6-BA on recovery rate and pollution rate
2.1.2 油樟悬浮培养最佳NAA浓度的筛选
将继代培养的油樟愈伤组织转接于不同浓度NAA的B5液体培养基中进行培养,分析NAA浓度对油樟细胞悬浮培养的影响.实验表明,0 mg/L NAA浓度下无明显细胞增殖(图4A),0.5 mg/L NAA浓度下悬浮细胞生物积累量大,但易褐化(图4B).1.0 mg/L NAA浓度下悬浮细胞增殖较快,生物积累量大,生长状态较好且细胞分散程度较均匀(图4C).通过观察悬浮培养液,油樟悬浮细胞呈椭圆形或球形,FDA染色后悬浮细胞表现出荧光强度高且荧光分布均匀,细胞活性强(图5).因此1.0 mg/L NAA的生长素浓度更适合油樟细胞的悬浮培养.

图4 不同的NAA对油樟悬浮培养的影响
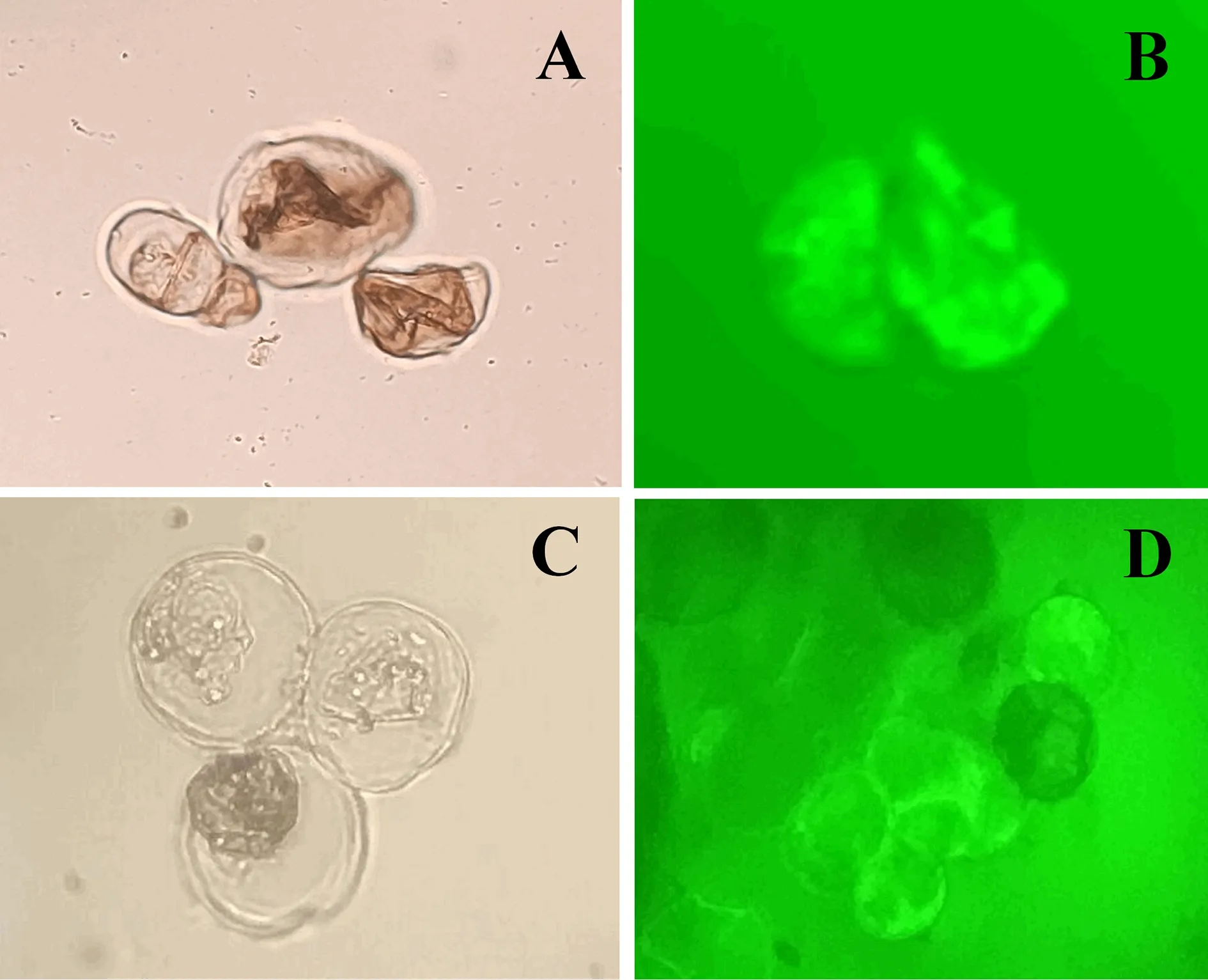
图5 油樟悬浮细胞
2.2 油樟细胞悬浮培养体系优化
2.2.1 蔗糖含量对油樟悬浮细胞的影响
为了进一步优化油樟悬浮培养体系,在B5+6-BA(4.0 mg/L)+NAA(1.0 mg/L)培养基中设置不同蔗糖浓度,分析不同蔗糖对油樟悬浮细胞生长的影响.发现在蔗糖浓度为40 g/L处理下油樟悬浮细胞鲜重高于低浓度处理,干重在第15天时显著高于其他处理(图6A、B).随着蔗糖浓度增大,其总酚含量、类黄酮含量及抗氧化能力越高,蔗糖浓度为40 g/L时,其总酚、类黄酮含量及总抗氧化能力显著高于其他处理(图6C、D、E).
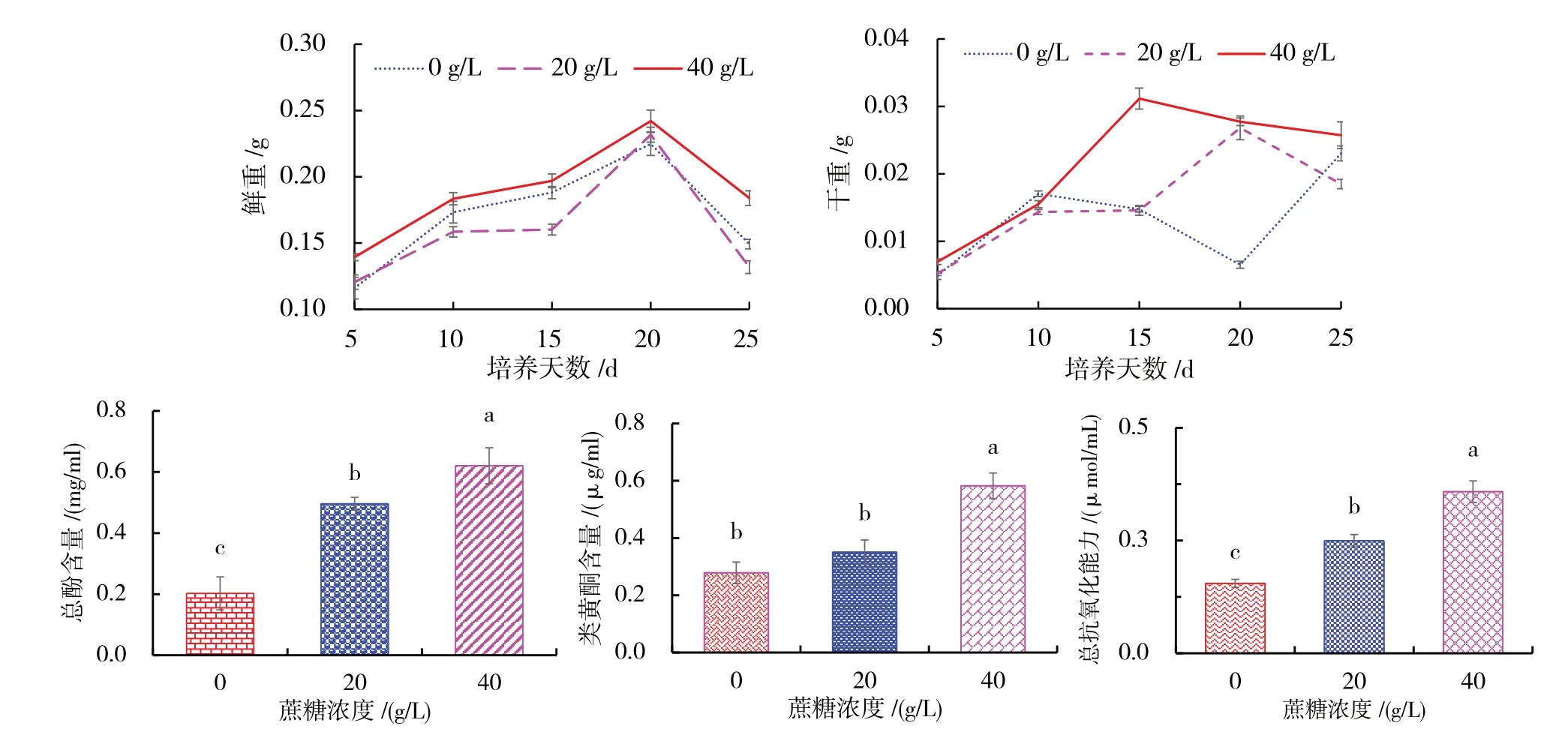
图6 培养基碳含量对油樟悬浮细胞的影响
2.2.2 pH值对油樟悬浮细胞的影响
在B5+6-BA(4.0mg/L)+NAA(1.0mg/L)培养基中设置不同pH,分析pH对油樟悬浮细胞生长的影响.在pH值为6.0,培养10 d时,细胞鲜重达到峰值后逐渐下降且WPA(鲜重0.2443 g)>WPB(鲜重0.2104 g)>WPC(鲜重0.1344 g)(图7A).而在pH6.0处理下第15 d时干重达到最大值,高于其他处理(图7B).随着培养基pH的增加,悬浮细胞总酚、类黄酮及总抗氧化活性反而降低,pH为6.0时总酚、类黄酮及总抗氧化能力显著高于其他处理(图7C、D、E).
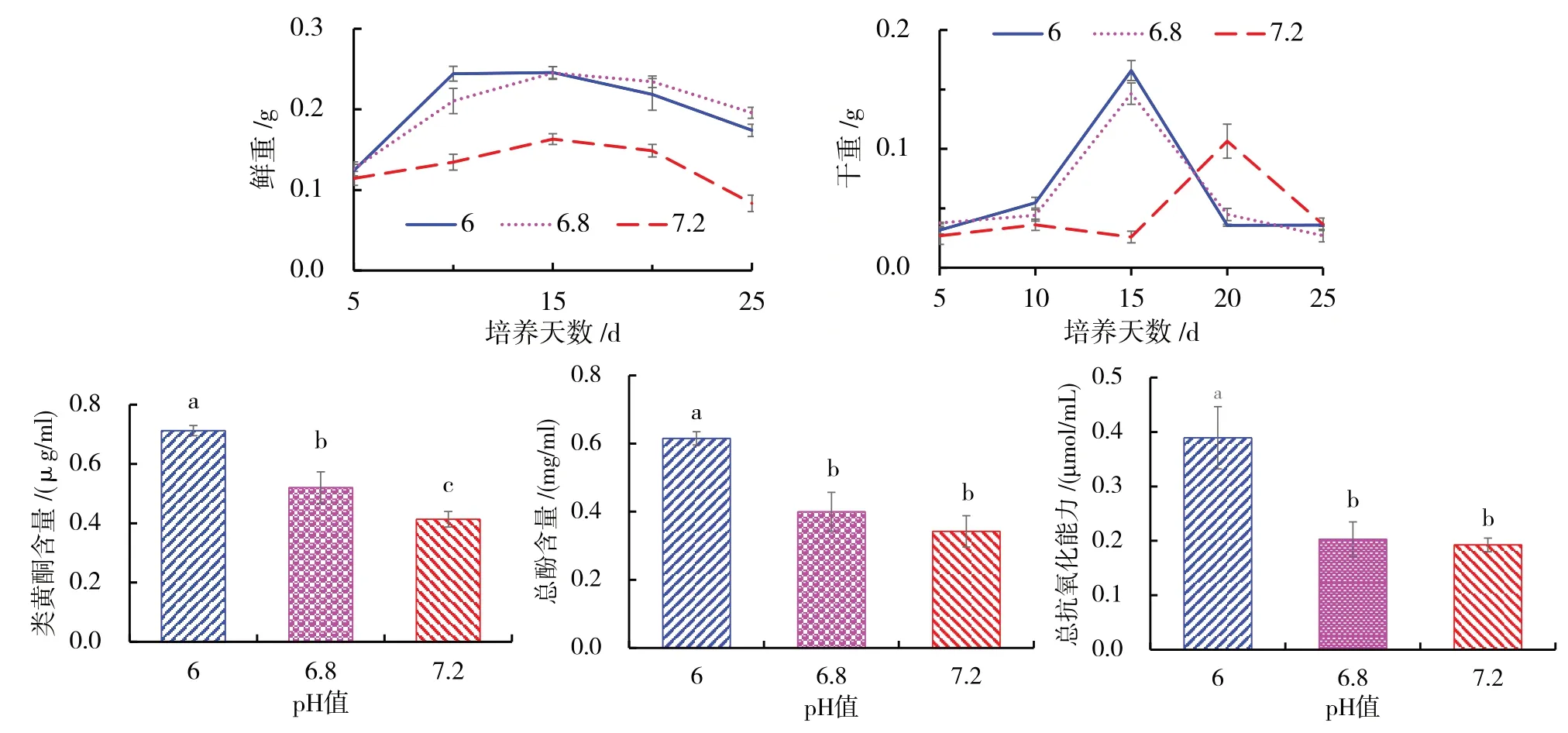
图7 pH对油樟悬浮细胞的影响
2.2.3光照对油樟悬浮细胞的影响
以B5+6-BA(4.0 mg/L)+NAA(1.0 mg/L)为培养基,分别设置光照和黑暗两种培养条件,分析光照对油樟悬浮细胞的影响.实验表明,油樟悬浮细胞干鲜重受光照影响明显,暗培养细胞鲜重高于光照培养(图8A).除第5、15天,暗培养下细胞干重显著高于光培养(图8B).暗培养总酚、类黄酮及总抗氧化能力显著高于光培养(图8C、D、E),悬浮细胞类黄酮含量在暗培养下比光培养高0.1556μg/ml(图8D).
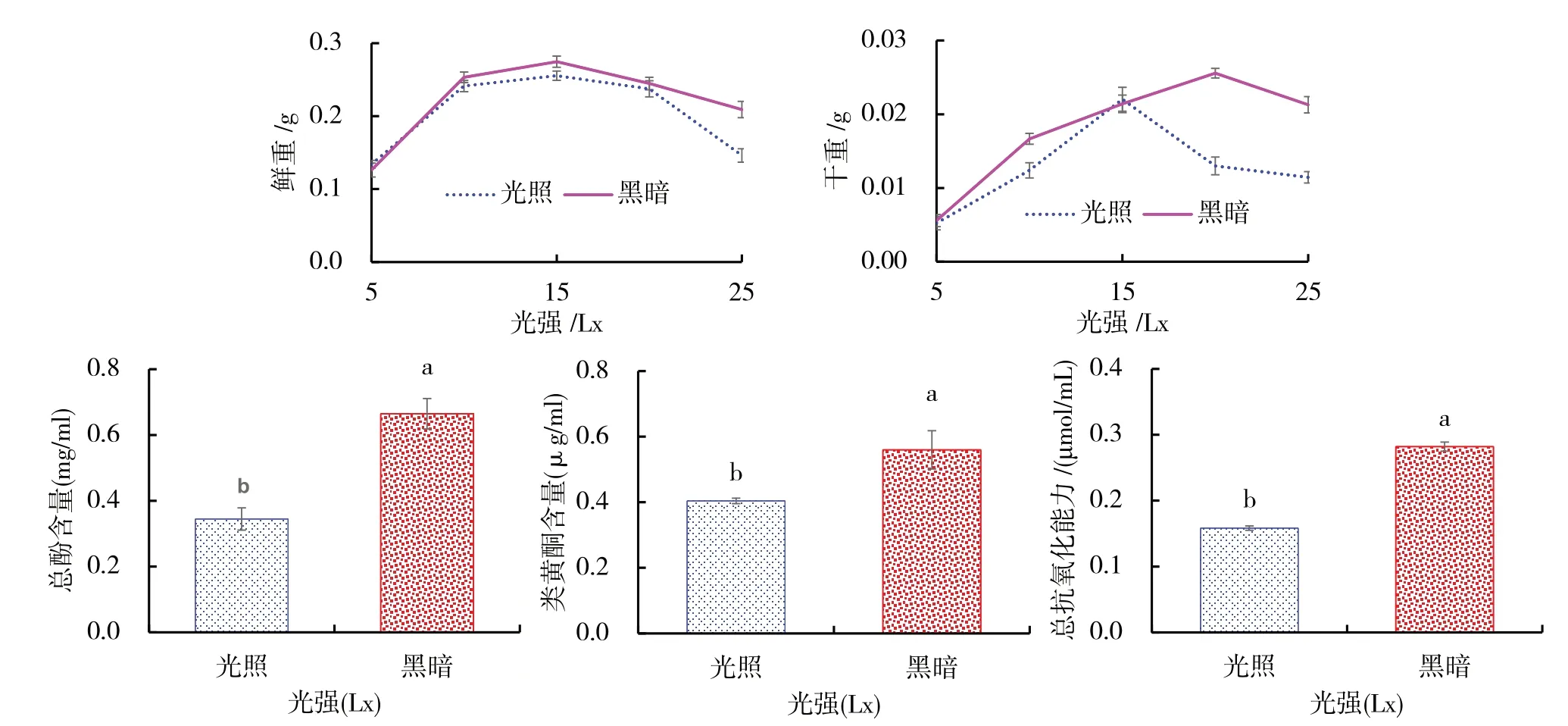
图8 光照对油樟悬浮细胞的影响
3 讨论及结论
植物悬浮细胞培养所需要的愈伤组织应生长旺盛且质地疏松,同时具有较高的次生代谢产物.植物不同组织、培养基、激素等因素影响植物愈伤组织的生长.油樟组培中,两年生茎段比当年生茎段易玻璃化,污染率高[16].植物不同组织、不同器官愈伤组织诱导率不同,桂花花梗愈伤组织诱导率比花瓣高[21],葡萄带芽茎段相比叶片和卷须更易诱导出愈伤组织[22].本研究中以油樟一年生茎段与叶片为外植体,相同条件培养后茎段愈伤组织诱导率高于叶片,叶片在诱导过程中玻璃化严重.激素对植物细胞悬浮培养的影响比诱导愈伤组织更大,外源激素的合理浓度是诱导悬浮细胞增殖的关键[23].生长素NAA浓度高时,诱导出淡黄色且疏松的愈伤组织[24].本研究中较高浓度的NAA(1.0 mg/L)悬浮细胞增殖较快,生物积累量大,细胞活性强.
不同的培养条件,影响植物悬浮细胞培养.培养条件主要包括基本培养基种类、激素种类及浓度、培养基pH值和附加物等.蔗糖作为一种碳源,一般认为较高浓度的蔗糖促进次生代谢物合成,可为呼吸作用提供底物,为细胞新陈代谢提供能量,可以调节细胞培养环境的渗透压[25],为代谢产物的产生提供前体[26],是植物离体培养不可或缺的一类营养物质.因此,油樟悬浮细胞合成次生代谢产物需要蔗糖提供能量,由实验结果可知随着蔗糖浓度增大,其总酚含量、类黄酮含量及抗氧化能力越高,表明培养基中高浓度的蔗糖含量可有效提升次生代谢产物含量.植物悬浮细胞生长受培养基pH的影响.pH除调节细胞膜透性,还会影响植物细胞的离子通道活性、细胞器完整性等方面[27].pH会对橡胶树悬浮细胞[28]、马铃薯愈伤组织[29]有明显影响.培养基的pH值对次生代谢物的分泌很重要,植物的细胞培养都要求一定的pH值,研究发现pH值为5.8~6.5范围内悬浮培养烟草细胞能获得最多的生物量和次生代谢产物量[30].由实验可知油樟细胞悬浮培养的最适pH为6.0,该pH下次生代谢产物量和生物积累量较高.
环境因素,如光照、温度、湿度和气体成分等也能够影响植物悬浮细胞培养.光是植物必需的资源之一,光照对植物生长的直接作用是光能促进细胞的增大和分裂,促进组织和器官的分化,制约器官的生长和发育速度[31].本研究以光照与黑暗对油樟悬浮细胞进行处理,黑暗处理油樟悬浮细胞总酚、类黄酮及总抗氧化能力显著高于光培养,进一步证明了黑暗培养有利于油樟悬浮细胞次生代谢产物的生成[19].蛇足石杉共生蓝藻细胞只能在较低的光照强度下生存[32].但部分植物,如西洋参细胞有无光照对培养西洋参细胞无差别[33].
