烷基铝/氢化铝锂还原体系还原液体端羧基氟橡胶
2023-01-06温佳明常云飞廖明义
温佳明,常云飞,廖明义
(大连海事大学 交通运输工程学院,辽宁 大连 116026)
氟橡胶因为分子结构中有强而稳定的C—F共价键(键能为485 kJ·mol-1),以及氟原子对主链有一定的屏蔽作用[1],所以具有优异的耐老化性、耐候性、耐油性、耐腐蚀性和热稳定性,被广泛应用于电子电气、石油化工、国防军工和航天航空等众多领域[2-5]。固体氟橡胶自身有一定缺陷,如加工性能差、硫化工艺复杂、不易与其他组分混合、难以成型等,不利于加工结构复杂的制品,导致应用受限,而液体氟橡胶克服了固体氟橡胶的缺陷。液体氟橡胶既具有固体氟橡胶的优点,又具有可流动、易于加工成型等优点,因此成为了现代工业不可或缺的重要材料[6-7]。目前,液体氟橡胶主要通过聚合法[8-10]和氧化降解法制备。对比两种方法,聚合法存在生产工艺复杂、产率低、相对分子质量不易控制等问题,而氧化降解法可以直接生成液体端羧基氟橡胶(LTCFs),且生产工艺简单、产率高、成本低。Z.C.ZHANG等[11-13]对氧化降解法制备液体氟橡胶进行了深入的研究。通过氧化降解制备的液体氟橡胶一般都含有端羧基官能团,端羧基官能团会影响橡胶的耐热、耐老化和固化等性能,从而进一步影响相关产品的使用性能。为了改善LTCFs的使用性能,对其进行还原改性(指将端羧基还原为端羟基)具有重要的意义。
在现有的有机还原体系中,羰基的还原体系已经很成熟,可以有效地将酮、醛、酯进行还原[14-17]。相比易还原的羰基,羧基的化学性质稳定,很难被普通还原剂还原[18],一般要用强还原剂或通过加入催化剂提高还原剂的性能来还原。金属氢化物中还原性很强的氢化铝锂(LiAlH4)是还原羧基常用的还原剂,其具有较高的还原率[19]。但是LiAlH4化学性质活泼,易燃、易爆、成本高,不利于大规模应用。二异丁基氢化铝(DIBAl-H)作为还原剂经常用于橡胶的合成,也常用来还原羰基。赵姜维等[20]使用新癸酸钕/DIBAl-H为催化剂进行了液体异戊二烯橡胶的合成。王光胤等[21]利用DIBAl-H作为还原剂对碘代苯丙酮进行单一的还原,成功制备了2-甲氧基对碘代苯甲醇。
本工作提出以还原体系DIBAl-H/LiAlH4和三异丁基铝[Al(i-Bu)3]/LiAlH4还原LTCFs,与传统强还原剂LiAlH4相比,其具有还原能力强、反应温度低、用量小等优点,为LTCFs的还原提供了更加安全、可行的解决方案。
1 实验
1.1 主要原材料
LTCFs,实验室自制;DIBAl-H(分析纯)、Al(i-Bu)3(分析纯)、LiAlH4(分析纯)、氢氧化钾(KOH)和邻苯二甲酸氢钾,上海阿拉丁化学试剂有限公司产品;无水四氢呋喃(THF)、二乙二醇二甲醚(分析纯)、浓盐酸、乙醇(C2H5OH,分析纯)、酚酞指示剂、丙酮(分析纯)和溴百里香酚蓝指示剂,天津科密欧化学试剂有限公司产品。
1.2 LTCFs的制备
通过氧化降解法制备,详见文献[22]。
1.3 液体端羟基氟橡胶(LTHFs)的制备
1.3.1 DIBAl-H/LiAlH4还原LTCFs
称5 g的LTCFs(羧基物质的量为2.8 mmoL),用40 mL无水THF、10 mL二乙二醇二甲醚溶解。待完全溶解后,倒入200 mL反应釜内,在0 ℃下加入LiAlH4搅拌反应0.5 h。在氩气保护下,向反应釜中滴加DIBAl-H,升温至15~60 ℃,反应1~8 h。反应结束后,滴加30 mL浓度为2 mol·L-1的盐酸进行淬灭,产物用去离子水反复洗涤后,在60 ℃下真空干燥至恒质量,得到乳白色粘稠液体。
1.3.2 Al(i-Bu)3/LiAlH4还原LTCFs
称5 g的LTCFs(羧基物质的量为2.8 mmoL),用40 mL无水THF、10 mL二乙二醇二甲醚溶解。待完全溶解后,倒入200 mL反应釜内,在0 ℃下加入LiAlH4搅拌反应0.5 h。在氩气保护下,向反应釜中滴加Al(i-Bu)3,升温至15~60 ℃,反应1~8 h。反应结束后,滴加30 mL物质的量浓度为2 mol·L-1的盐酸进行淬灭,产物用去离子水反复洗涤后,在60 ℃下真空干燥至恒质量,得到乳白色粘稠液体。
1.3.3 LiAlH4还原LTCFs
称5 g的LTCFs(羧基物质的量为2.8 mmoL),用50 mL无水THF溶解。待完全溶解后,倒入200 mL反应釜内,在0 ℃下加入LiAlH4搅拌反应0.5 h。升温至15~60 ℃,反应1~8 h。反应结束后,滴加物质的量浓度为2 mol·L-1的盐酸30 mL进行淬灭,产物用去离子水反复洗涤后,在60 ℃下真空干燥至恒质量,得到乳白色粘稠液体。
1.4 光谱分析
1.4.1 傅里叶变换红外光谱(FTIR)分析
采用美国PerkinElmer公司生产的Frontier型FTIR分析仪进行FTIR分析,衰减全反射(ATR)模式,扫描范围 650~4 000 cm-1,扫描次数 32,分辨率 4 cm-1。
1.4.2 核磁共振(NMR)分析
采用瑞士Bruker公司生产的AC-80型NMR分析仪进行NMR测试。1H-NMR测试频率为500 MHz,标准物为四甲基硅烷(TMS);19F-NMR测试频率为470 MHz,标准物为一氟三氯甲烷(CFCl3)。
1.5 化学滴定定量分析
1.5.1 KOH/C2H5OH标准溶液的配制与标定
根据GB/T601—2016和GB/T603—2002配制物质的量浓度为0.1mol·L-1的KOH/C2H5OH 标准溶液。称邻苯二甲酸氢钾0.20 g,用50 mL去离子水溶解,滴加质量浓度为10 g·L-1的酚酞指示剂2滴,用KOH/C2H5OH标准溶液滴定,当溶液由无色变为粉色,滴定结束,并做空白试验。根据公式(1)对KOH/C2H5OH标准溶液的标定浓度(C)进行计算:
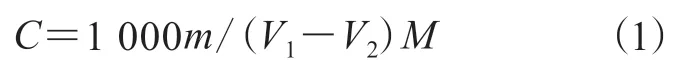
式中:m为邻苯二甲酸氢钾质量的准确数值,g;V1为邻苯二甲酸氢钾溶液消耗KOH/C2H5OH标准溶液的体积,mL;V2为空白样品消耗KOH/C2H5OH标准溶液的体积,mL;M为邻苯二甲酸氢钾的物质的量质量,为204.22 g·mol-1。
1.5.2 端羧基(以下简称羧基)含量的测试
用4 mL丙酮溶解0.15 g的LTCFs或LTHFs,滴加质量浓度为10 g·L-1溴百里香酚蓝指示剂2滴,用KOH/C2H5OH标准溶液滴定,当溶液变为绿色,滴定结束。根据公式(2)计算LTCFs或LTHFs中羧基的物质的量(L):
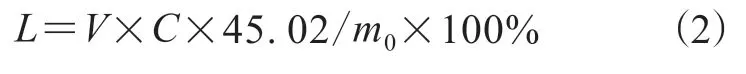
式中:V为样品溶液消耗KOH/C2H5OH标准溶液的体积,mL;m0为测试样品的质量,g。
1.5.3 羟基还原率的测试
采用化学滴定定量法得到LTCFs和LTHFs中羧基物质的量,根据公式(3)进一步计算,得到羧基的还原率(α):
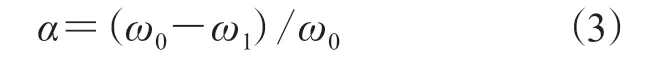
式中,ω0为LTCFs中羧基物质的量,ω1为LTHFs中羧基物质的量。
2 结果与讨论
2.1 DIBAl-H/LiAlH4的还原能力
对影响DIBAl-H/LiAlH4还原能力的因素进行研究,结果如表1所示(COOH为羧基)。
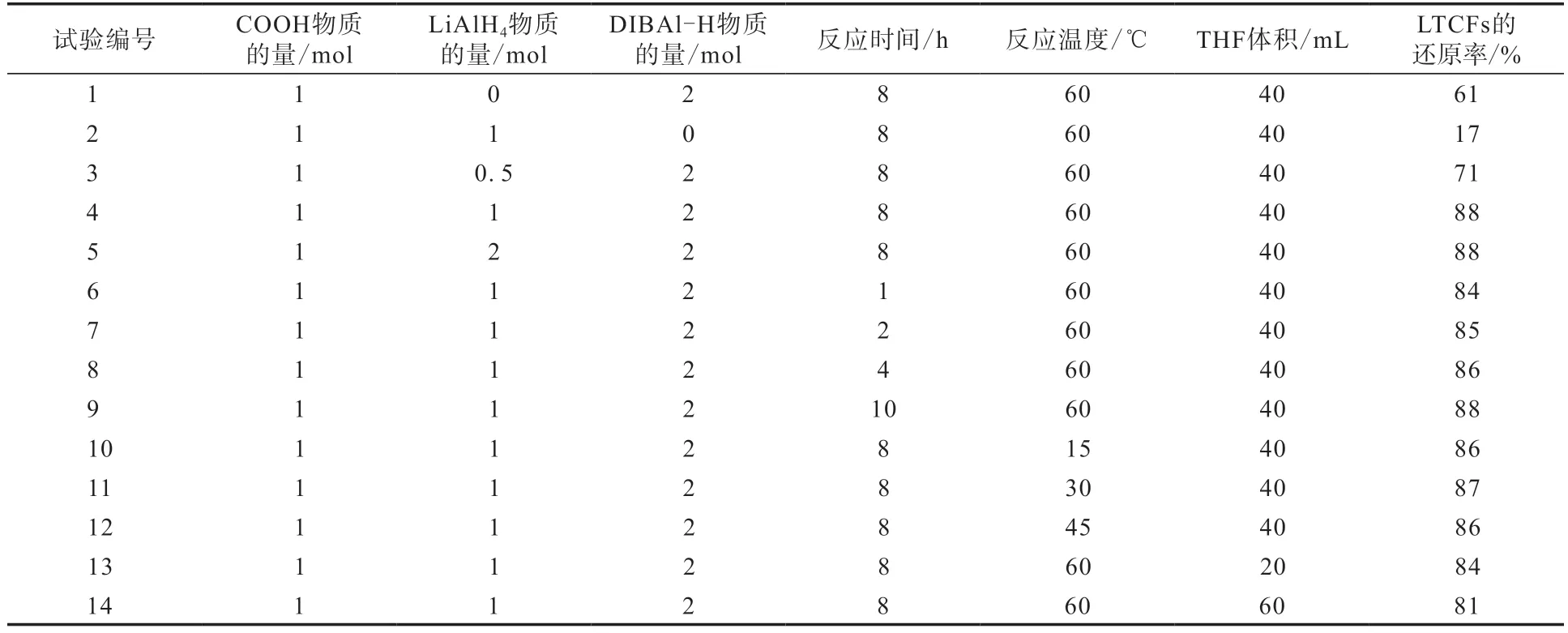
表1 采用DIBAl-H/LiAlH4的LTCFs的还原率Tab.1 Reduction rates of LTCFs by DIBAl-H/LiAlH4
表1中1—5号试验研究反应物料对LTCFs的还原率的影响。从1号和2号试验可知:在未加入LiAlH4、单独使用DIBAl-H做还原剂时,LTCFs的还原率仅达到61%;而未加入DIBAl-H、只使用LiAlH4时,LTCFs的还原率只有17%。当LiAlH4和DIBAl-H组成还原体系,则可以明显提高还原能力,其中4号试验中COOH/LiAlH4/DIBAl-H物质的量比为1/1/2,此时LTCFs的还原率达到最大值,为88%;5号试验COOH/LiAlH4/DIBAl-H物质的量比为1/2/2,LTCFs的还原率也为88%。
表1中4号和6—9号试验对反应时间进行研究,结果显示,一开始随着反应时间的延长,LTCFs的还原率逐渐增大,当反应时间为8 h时LTCFs的还原率达到最大,为88%,之后再延长反应时间,LTCFs的还原率不再增大。
表1中4号和10—12号试验对反应温度进行研究,结果显示,虽然在60 ℃时LTCFs的还原率达到最大,但在较低温度下LTCFs的还原率依然很大,说明还原体系具有很强的还原能力,受反应温度的影响较小。
表1中4号、13号和14号试验对溶剂用量进行研究,结果表明THF体积为40 mL时,对LTCFs的还原效果最好。
2.2 Al(i-Bu)3/LiAlH4的还原能力
对影响Al(i-Bu)3/LiAlH4还原能力的因素进行研究,结果如表2所示。
表2中1—4号试验对反应物料进行研究,结果显示,COOH/LiAlH4/Al(i-Bu)3物质的量比为1/1/2时LTCFs的还原率达到最大值78%。4号和6—9号试验对反应时间进行研究,结果显示,随着反应时间的延长,LTCFs的还原率逐渐增大,8 h时LTCFs的还原率达到最大,再延长反应时间LTCFs的还原率不再增大。4号和10—12号试验对反应温度进行了研究,结果显示,在60 ℃下LTCFs的还原率达到最大。4号,13号和14号试验对溶剂进行研究,结果表明THF体积为40 mL时,对LTCFs的还原效果最好。
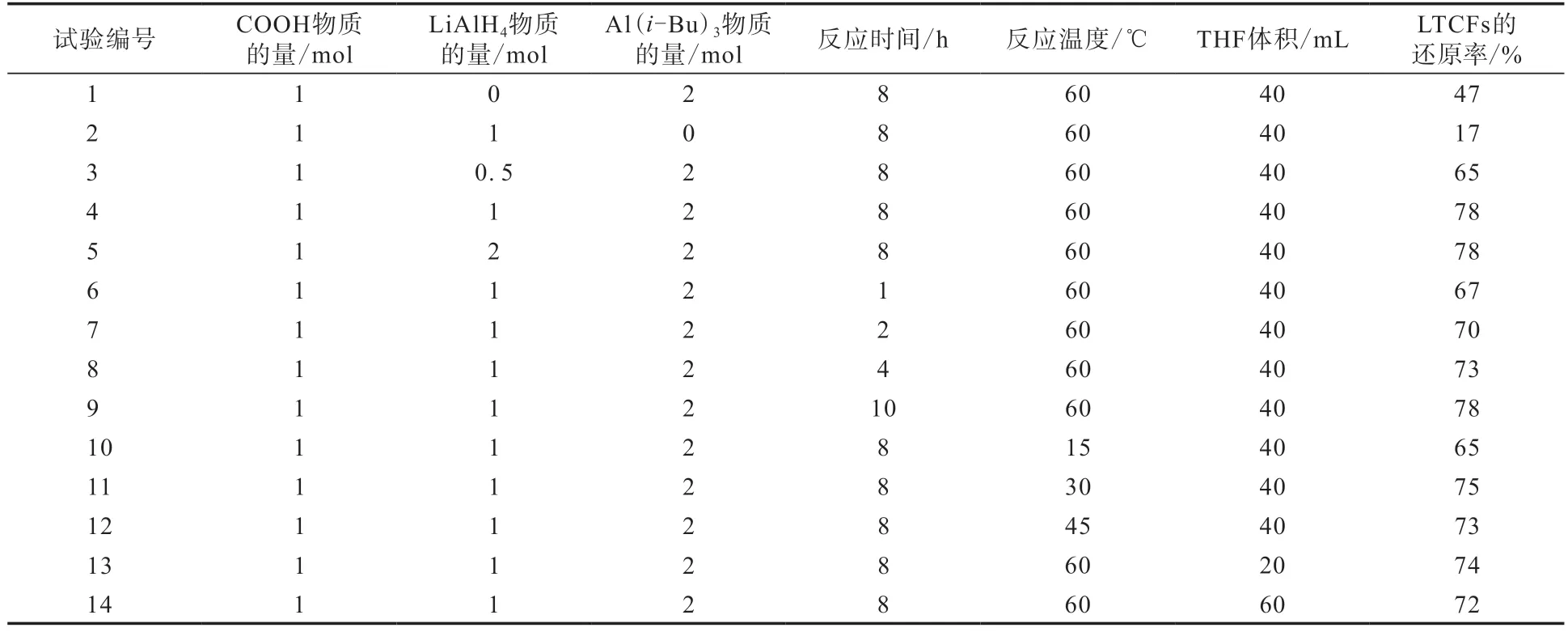
表2 采用Al(i-Bu)3/LiAlH4的LTCFs的还原率Tab.2 Reduction rates of LTCFs by Al(i-Bu)3/LiAlH4
对 比DIBAl-H/LiAlH4和Al(i-Bu)3/LiAlH4两种还原体系,发现前者还原效果更好,受温度影响更小。对该结果进行分析认为,对于DIBAl-H/LiAlH4还原体系,DIBAl-H还原活性高,在羧基的还原过程中更容易分离H-去攻击羰基C。对于Al(i-Bu)3/LiAlH4还原体系,Al(i-Bu)3不含有H-,需要更高的温度使LiAlH4提供更多的H-攻击羰基C。所以,DIBAl-H/LiAlH4还原体系更适合LTCFs的还原。
2.3 DIBAl-H/LiAlH4与LiAlH4的还原能力比较
反应温度对DIBAl-H/LiAlH4和LiAlH4还原能力的影响如图1—3所示。
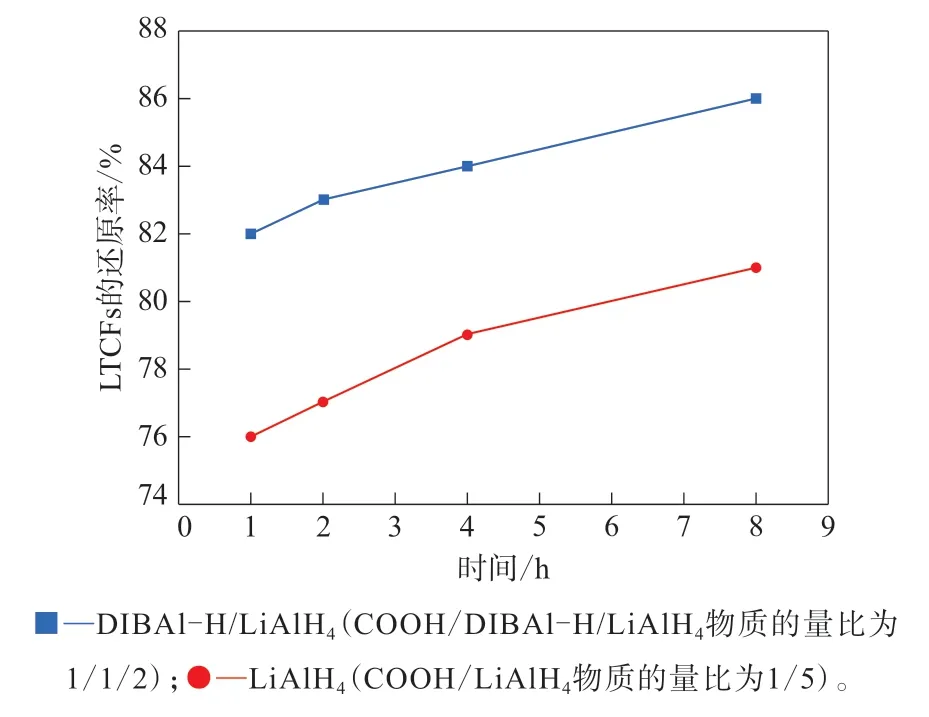
图1 15°C下采用DIBAl-H/LiAlH4与LiAlH4的LTCFs的还原率比较Fig.1 Comparison of reduction rates of LTCFs by DIBAl-H/LiAlH4 and LiAlH4 at 15°C
对 比DIBAl-H/LiAlH4与LiAlH4对LTCFs 的还原率,在较低温度下,DIBAl-H/LiAlH4的还原能力更强:如图1所示,反应温度为15 ℃,不同反应时间下DIBAl-H/LiAlH4对LTCFs的还原效果均明显好于LiAlH4;如图2所示,当反应温度为30 ℃时,DIBAl-H/LiAlH4对LTCFs的还原效果仍优于LiAlH4。当反应温度较高时,如图3所示,反应温度升高到60 ℃,LiAlH4对LTCFs的还原效果略好于DIBAl-H/LiAlH4。综上所述,在较低反应温度下,与LiAlH4相比,DIBAl-H/LiAlH4对LTCFs的还原效果更好,且需要的LiAlH4更少,成本更低,更加适合LTCFs的还原,并有利于减少能量消耗,降低生产成本。
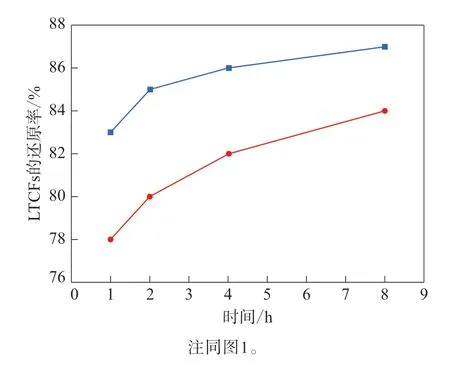
图2 30°C下采用DIBAl-H/LiAlH4与LiAlH4的LTCFs的还原率比较Fig.2 Comparison of reduction rates of LTCFs by DIBAl-H/LiAlH4 and LiAlH4 at 30°C
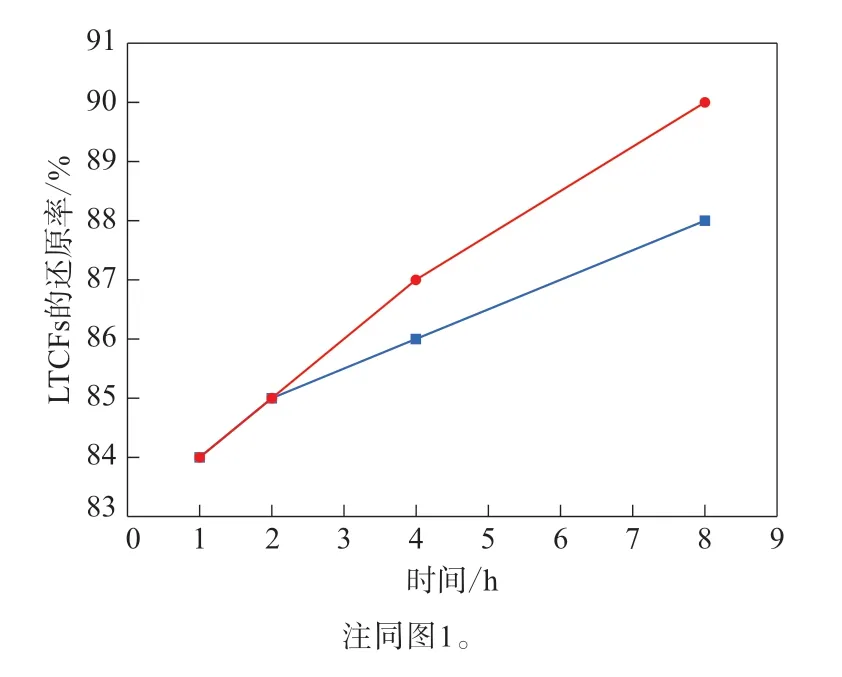
图3 60°C下采用DIBAl-H/LiAlH4与LiAlH4的LTCFs的还原率比较Fig.3 Comparison of reduction rates of LTCFs by DIBAl-H/LiAlH4 and LiAlH4 at 60°C
2.4 分子结构表征
2.4.1 FTIR分析
LTCFs和LTHFs的FTIR谱如图4所示。
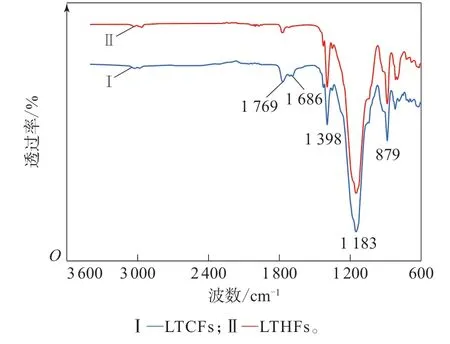
图4 LTCFs和LTHFs的FTIR谱Fig.4 FTIR spectra of LTCFs and LTHFs
从图4可以看出:LTCFs 在1 769,1 686,1 398,1 183和879 cm-1处显示出吸收峰,分别为—CF2COOH,—C=C—,—CFH—,—CF2— 和—CF3的伸缩振动峰[23-24];LTHFs在1 398,1 183和879 cm-1处也显示出吸收峰,但是在1 769 cm-1处的—CF2COOH和1 686 cm-1处的—C=C—吸收峰明显减弱,这说明LTHFs与LTCFs具有相同的主体结构,但其—CF2COOH和—C=C—已经被还原。
2.4.2 NMR分析
LTCFs和LTHFs的1H-NMR谱如图5所示。
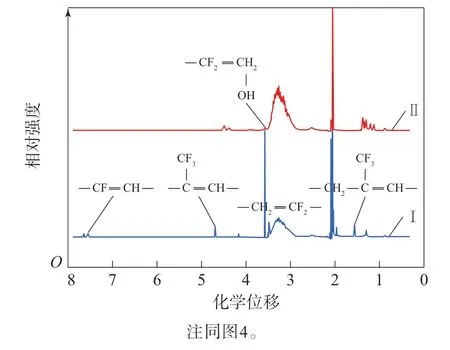
图5 LTCFs和LTHFs的1H-NMR谱Fig.5 1H-NMR spectra of LTCFs and LTHFs
对于LTCFs的1H-NMR谱,化学位移为3.56~2.31处的多重峰为—CH2CF2—的结构特征峰,化学位移为1.54处的峰为—CH=C(CF3)CH2—的结构特征峰,化学位移为4.68 处的峰为—(CF3)C=CH—的结构特征峰,化学位移为7.75~7.45的峰为—CH=CF—的结构特征峰[25-26]。对于LTHFs的1H-NMR谱,在化学位移为1.54,4.68和7.75~7.45的峰均明显减弱,说明LTCFs中的—C=C—可以被DIBAl-H/LiAlH4还原体系还原;在化学位移为3.63~3.73处出现新的峰,它们归属为—CH2OH结构[22]。1H-NMR结果证实了—C=C—的还原和羟基的形成。
LTCFs和LTHFs的19F-NMR谱如图6所示,19F-NMR谱中的具体特征峰归属如表3所示。
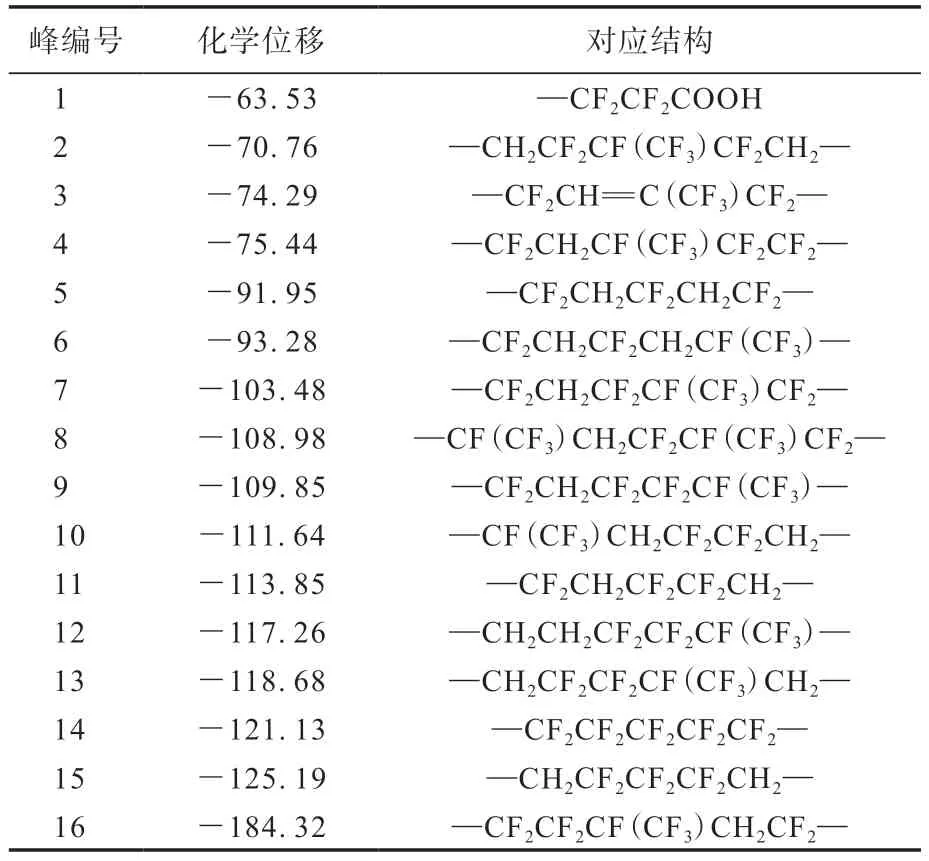
表3 19F-NMR谱中不同峰的化学位移Tab.3 Chemical shifts of different peaks in19F-NMR spectra
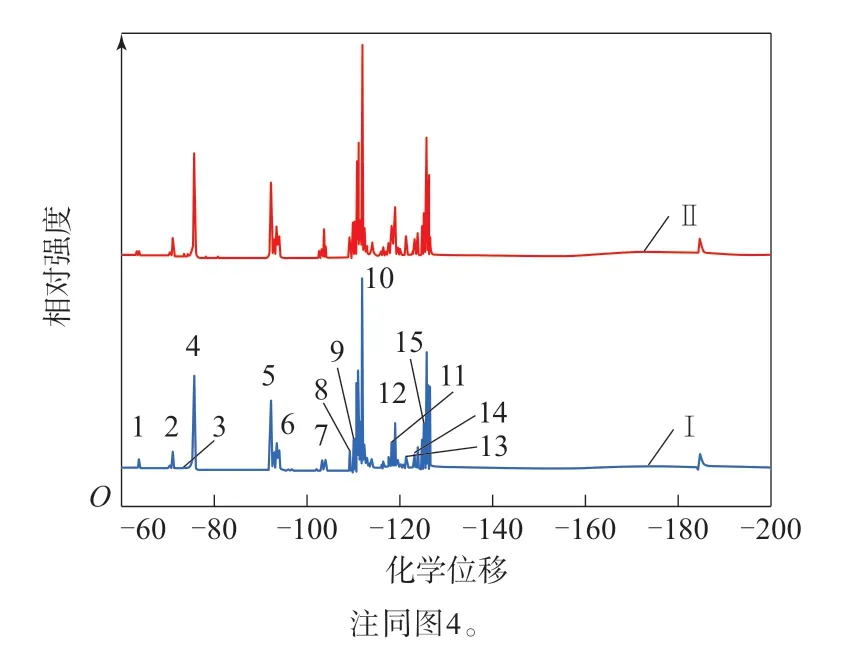
图6 LTCFs和LTHFs的19F-NMR谱Fig.6 19F-NMR spectra of LTCFs and LTHFs
对于LTCFs的19F-NMR谱,在化学位移为-63.53处出现的峰为—CF2COOH的特征峰。对于LTHFs的19F-NMR谱,在化学位移为-63.53处出现的峰明显减弱,结合1H-NMR谱,说明—CF2COOH被成功还原。
FTIR谱,1H-NMR谱和19F-NMR谱分析结果充分表明,DIBAl-H/LiAlH4成功将LTCFs还原为LTHFs。
2.5 还原机理
根据上述研究结果,提出了DIBAl-H/LiAlH4对LTCFs的还原机理,如图7所示。
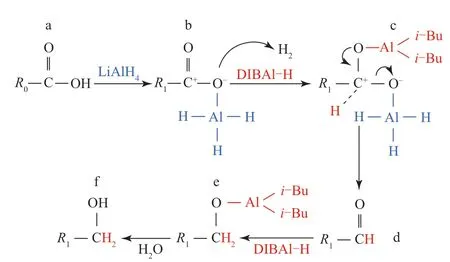
图7 DIBAl-H/LiAlH4对LTCFs的还原机理Fig.7 Reduction mechanism of DIBAl-H/LiAlH4 to LTCFs
从图7来看,首先,LTCFs中的—C=C—被LiAlH4还原,烷基链由R0变为R1。在反应进行到b步时R1COOH与LiAlH4发生酸碱反应,释放氢气,并生成Al—O键,由于Al具有较强的亲电性,通过诱导效应使羰基C的缺电子性增加。而后如c步所示,DIBAl-H中的Al—H键断裂,Al与羰基O形成Al—O键,就导致羰基C的缺电子性进一步增加,这有利于DIBAl-H分离的H-攻击羰基C[27],进而羰基被还原。随后Al—O和C—O键断裂形成醛基如d步所示。再如e步所示,通过DIBAl-H进一步对醛基进行还原,最终成功将羧基还原为羟基。
3 结论
以还原体 系DIBAl-H/LiAlH4和Al(i-Bu)3/LiAlH4还原LTCFs得到LTHFs,并对还原体系进行了研究,得出以下结论。
(1)对于LTCFs的还原,DIBAl-H/LiAlH4的还原效果明显比Al(i-Bu)3/LiAlH4强;对于还原体系DIBAl-H/LiAlH4,在反应温度为60 ℃、反应时间为8 h,COOH/LiAlH4/DIBAl-H物质的量比为1/1/2时,LTCFs的还原效果最好,还原率最大达到88%。
(2)FTIR谱,1H-NMR谱和19F-NMR谱分析结果表明,对于LTCFs,DIBAl-H/LiAlH4作为还原体系,可以有效将其碳-碳双键和羧基分别还原为碳-碳单键和羟基。
(3)与常用强还原剂LiAlH4相比,还原体系DIBAl-H/LiAlH4在保持很强还原能力的同时,大幅降低了还原剂用量,具有成本低、受温度影响小等优点,为羧基还原提供了更多可能性。
