直流生物电刺激活化PTEN/Akt/mTOR信号通路促进人口腔黏膜成纤维细胞增殖的研究
2023-01-06孙兆琦张陈平曲行舟
孙兆琦, 张陈平, 曲行舟
(1.上海交通大学医学院附属第九人民医院·口腔医学院口腔颌面-头颈肿瘤科,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海 200011;2.上海市第八人民医院口腔科,上海 200235)
由于炎症、创伤、肿瘤切除或重度牙槽萎缩会造成附着龈宽度的减少或完全丧失。牙槽低平、附着牙龈不足均成为种植修复的难题。为了种植体长期正常使用,修复前通过手术进行软硬组织增量、恢复解剖结构的方法是目前常用的解决方案。然而,此类修复前外科手术面对的挑战之一是暴露骨创面的修复(图1)。骨面暴露在口腔内过久容易并发骨髓炎等并发症,因此如何促进骨创面的愈合是亟待解决的临床问题。有研究表明,电刺激作为一种辅助治疗的手段,被应用于各种病因的慢性伤口[1-3]。电刺激对口腔颌面部骨组织、软组织、神经等修复均有一定的作用[4],但其用于口腔内黏膜修复裸露骨创面的研究较少。

图1 牙槽嵴成形后裸露的骨创面Figure 1 Exposed bone wound after alveolar ridge shaping
人口腔黏膜成纤维细胞(hOMF)是口腔黏膜固有层的基本细胞成分之一,有合成纤维和更新细胞外基质的功能,固有层对上皮的分化具有调控作用[5]。hOMF在口腔黏膜的愈合过程中是不可或缺的。电刺激可能也影响hOMF的生物学行为,本研究利用自行设计和研发的改良直流电刺激(DCS)装置(专利号:ZL202120693677.3)模拟内源性生物电场,初步探讨了DCS对hOMF增殖、血管内皮生长因子(VEGF)分泌的影响,并进行了初步的机制探究,为探索DCS促进口腔黏膜创面愈合的机制提供一定的理论基础。
1 材料和方法
1.1 主要试剂与仪器
胎牛血清(Gibco公司,美国);DMEM培养液(上海源培生物科技公司,中国);胰蛋白酶(Sigma公司,美国);CCK-8试剂盒(同仁公司,日本);VEGF酶联免疫吸附试验(ELISA)试剂盒(上海朗顿生物科技公司,中国);p-Akt、Akt、p-mTOR、mTOR、PTEN抗体(CST公司,美国);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(Thermo Fisher Scientific公司,美国)。
电子分析天平、恒温CO2培养箱、超净工作台、倒置相差显微镜(Olympus公司,日本);高速冷冻离心机(Eppendorf公司,德国)。
1.2 hOMF的培养
本研究中所用的hOMF由上海市交通大学医学院附属第九人民医院口腔肿瘤生物学实验室提供,来源于人正常口腔黏膜。hOMF为凸起的纺锤形或星形扁平状结构,细胞核呈规则的卵圆形,核仁大而明显(图2)。当细胞生长汇合度达80%~90%时,用含0.02%的乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和0.25%的胰蛋白酶消化后制成细胞悬液,调整细胞密度为2.5×104个/mL,设置2 mL/孔,将其种植于导电6孔板中,置于37℃、5%CO2培养箱中培养12 h,观察到细胞贴壁即可开始实验。
图2 低倍光镜下观察hOMF的细胞形态(×40)Figure 2 The morphology of hOMF under low magnification of optical microscope(×40)
1.3 导电6孔板型内源性生物电场模拟平台的搭建
1.3.1 导电6孔板的制备 培养孔1、4的一侧,培养孔2、5的对侧均开设有通孔,通孔的直径为3 mm,下缘距离孔板底缘2 mm。相邻两通孔以2%磷酸盐缓冲液(phosphate buffered saline,PBS)琼脂封闭,高度大于9 mm,在培养孔1、2、5、4加入培养液后可串联导电。培养孔1、4对应6孔板盖边缘设有孔洞,可插入100/200μL移液枪头,枪头内注满2%PBS琼脂。设定培养孔1为阳极,培养孔4为阴极;培养孔3、6作为对照组。使用紫外线灯(辐射强度大于70μW/cm2)照射30 min以上消毒待用。
1.3.2 内源性生物电场模拟平台的搭建 将直流可控电源、万用电表、保护电阻串联,将阳极、阴极插入琼脂枪头,形成闭合电路。测试直流电路,显示电流稳定,各组件无异常(图3)。
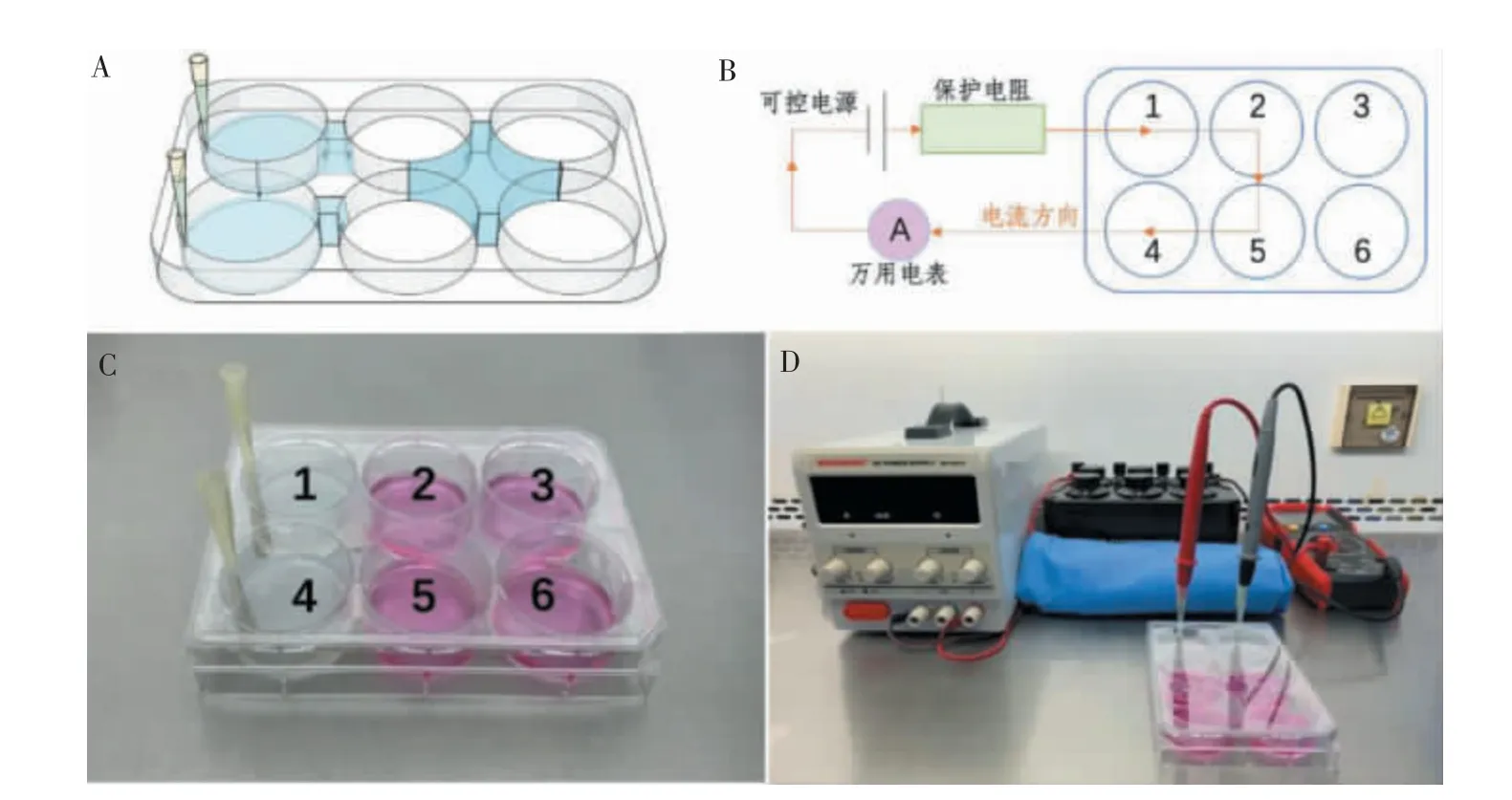
图3 导电6孔板及内源性生物电场模拟平台示意图Figure 3 Schematic diagram of electroconductive six-hole plate and endogenous bioelectric field simulation platform
1.4 方法
1.4.1 实验分组 将hOMF消化后制成细胞悬液,调整细胞密度为2.5×104个/mL,设置2 mL/孔,种植于导电6孔板中,于37℃、5%CO2培养箱中培养12 h,观察细胞贴壁,随机将6孔板分为对照组(对照组不施加任何电刺激,培养条件与DCS组一致)和DCS组后开始实验。
1.4.2 CCK-8细胞增殖测定 成纤维细胞对数增长期的测定:接种细胞,每孔细胞总数一致,加入培养液一致;连续6 d用CCK-8法于450 nm波长处检测对照组和DCS组细胞的吸光度值;选定生长高峰对应天数作为实验测量细胞增殖标准时间,本实验重复独立实验3次。
筛选适宜的DCS条件:控制细胞接种数量、培养条件、培养环境完全一致,观察细胞贴壁后即可开始实验。设立DCS强度梯度(0、10、25、50、100μA,10 min/次,2次/d)、时长梯度(0、5、10、30、60 min,25μA/次,2次/d)、频率梯度(0、1、2、3次/d,25μA、10 min/次)作用于hOMF,每次刺激后更换完全培养液,置于培养箱中;于连续刺激后的第5天测定450 nm波长处的吸光度值,本实验重复独立实验3次。
1.4.3 ELISA试剂盒检测表皮细胞生长因子(EGF)和VEGF的浓度 样品收集:细胞贴壁即可开始实验,设置对照组与DCS组,分别于刺激24、48 h后收集细胞培养上清液,上清液经2 000 r/min 20 min离心后,仔细收集上清液。取出4℃保存的ELISA试剂盒,室温下平衡至少30 min,设置空白孔、标准品孔、样品孔、零孔,依次加入试剂,测定在450 nm波长处的吸光度值,使用ELISAcale软件(上海朗顿生物技术有限公司,中国)进行计算,拟合模型选用logistic曲线(四参数)制定标准曲线,然后根据标准曲线分别计算刺激24、48 h后细胞培养上清液中EGF、VEGF的浓度。
1.4.4 Western blotting检测PTEN/Akt/mTOR通路相关蛋白的表达 吸除对照组和经DCS后的细胞培养液,用PBS冲洗3次,每孔加入200μL全细胞裂解液,旋转刮孔底,使细胞裂解完全,收集至1.5 mL的EP管中,105℃加热10 min,4℃下以8 000 r/min离心3 min。使用PierceTMBCA蛋白定量试剂盒(Thermo ScientificTM公司,美国)测量蛋白浓度,制作浓度标准曲线,计算蛋白上样量,配制上样品。将等量的各组蛋白上样品加入预制胶,电泳分离至溴酚蓝游离出预制胶即可终止电泳。将硝酸纤维素膜置于甲醇激活,通过电转移法转膜。电转后的硝酸纤维素膜在5%脱脂牛奶中封闭1 h,PBS在摇床上洗膜3次,每次10 min,于4℃下一抗孵育过夜。次日将PBST(PBS与吐温Tween-20的混合液)置室温下于摇床上洗3次,每次10 min;加入对应的二抗孵育1 h,再次使用PBST洗膜3次。配制显影液,凝胶成像系统拍照,用Image J图像分析系统(analytical train公司,美国)对蛋白条带进行分析,以GAPDH作为内参,将实验组各目标蛋白灰度值与GAPDH灰度值的比值和对照组各目标蛋白灰度值与GAPDH灰度值的比值相比较,代表蛋白相对表达水平,即蛋白表达升高倍数=(实验组各目标蛋白灰度值/实验组各对应GAPDH灰度值)÷(对照组各目标蛋白灰度值/对照组各GAPDH灰度值)。
1.5 统计学分析
本研究所有数值型数据采用SPSS25.0、Image J和GraphPad Prism 5统计学软件进行数据分析。计量资料采用均数±标准差(±s)进行描述。不同的2组组间比较采用独立样本t检验,3组组间比较采用方差分析,两两比较采用LSD检验。以P<0.05为差异有统计学意义。
2 结果
2.1 DCS对hOMF增殖的影响
根据连续6 d测得的吸光度值可知,对照组和DCS组细胞的增殖情况一致,在DCS后的第5天,对照组和DCS组均出现了吸光度值的跃增。因此,将对数增长期的第5天作为测量细胞增殖情况的标准时间点。hOMF接种后的第5天,在25μA、10 min/次、2次/d的DCS下,细胞明显增殖,与未施加任何刺激的细胞比较,差异具有统计学意义(P<0.01),提示该DCS条件对hOMF的增殖具有促进作用(图4)。
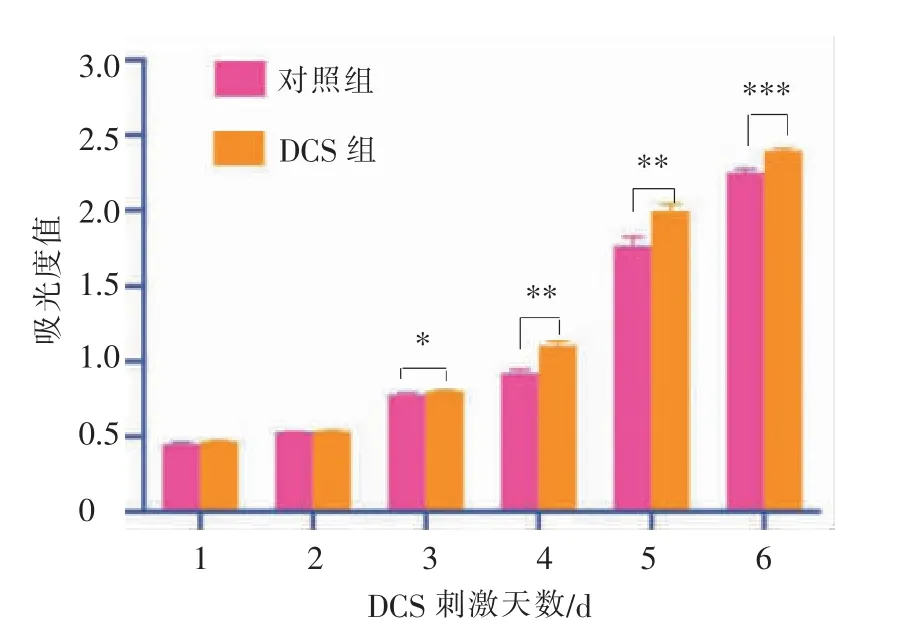
图4 连续刺激6 d的hOMF细胞增殖情况比较Figure 4 Comparison of hOMF proliferation after DCS for 6days
分别将不同刺激条件设定为单变量刺激条件。根据吸光度值可知,DCS的强度、时长、频率均可影响细胞增殖。10、25μA的DCS均可以使hOMF细胞明显增殖,25μA的DCS使细胞增殖更为显著(P<0.01);10 min的DCS条件下,细胞显著增殖(P<0.001),随着刺激时间的延长,细胞由增殖转变为明显凋亡(P<0.001);1次/d的DCS可使细胞轻微增殖(P<0.05),2次/d的DCS条件下,细胞增殖更为明显(P<0.01),而在3次/d的DCS条件下,细胞增殖未见明显变化。详见图5。

图5 不同DSC条件下的hOMF增殖情况比较Figure 5 Comparison of hOMF proliferation under different DCSconditions
2.2 测定DCS后细胞上清液中EGF、VEGF的浓度
检测对照组与DCS组细胞培养上清液中EGF、VEGF的浓度。结果显示,相较于对照组,DCS组24、48 h的细胞培养上清液中VEGF的浓度均有所升高,24 h培养上清液中的VEGF浓度升高更为明显(P<0.01);在24 h时,DCS组上清液中EGF的浓度较对照组略有升高,但差异无统计学意义(P>0.05),48 h时,DCS组与对照组的EGF浓度整体较24 h时降低。详见图6。

图6 DCS组与对照组hOMF培养上清液中EGF、VEGF水平的比较Figure 6 Comparison of EGF,VEGF levels in hOMF culture supernatant between DCSgroup and control group
2.3 Western blotting检测PTEN/Akt/mTOR通路相关蛋白的表达
在不同时长的DCS下,刺激5、10 min后,pmTOR蛋白表达均显著升高(P<0.01);mTOR蛋白的表达水平无明显变化;p-Akt的蛋白表达在刺激5 min后略升高(P<0.05),10 min后的蛋白表达水平显著升高(P<0.01);Akt(pan)的蛋白表达水平无明显变化。相对对照组,各刺激时长对应的PTEN蛋白表达水平均有所降低,刺激5、10 min后的蛋白表达(P<0.001)较刺激30、60 min后的蛋白表达水平(P<0.01)降低得更为明显。详见图7。
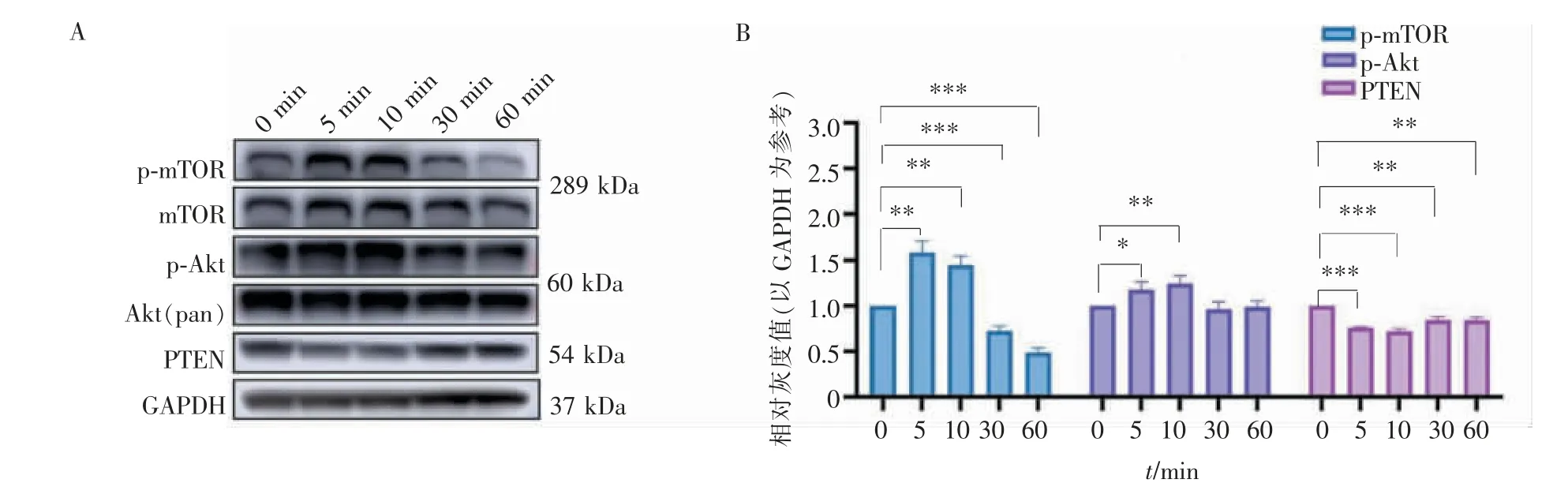
图7 不同DCS时长PTEN/Akt/mTOR通路相关蛋白的表达Figure 7 Expression of PTEN/Akt/mTOR pathway related proteins after different duration of DCS
3 讨论
电刺激作为一种治疗手段最初出现于17世纪,有学者当时尝试用金叶治疗皮肤溃疡[6]。直到19世纪,德国生理学家DuBois Reymond检测到受伤的手臂有电流经过,人类内源性生物电场才得以揭示[7]。研究表明,创面上存在的电流可能通过吸引参与修复的细胞、改变细胞膜的通透性、增加细胞的分泌产物和指导细胞结构的重塑等方式,进而影响创面的愈合[8-9]。2009年,国际压疮指南将电刺激列为唯一有据支持治疗皮肤重度压疮的方式[10]。主要被应用的电刺激包括直流电、低频脉冲电流、高压脉冲电流、脉冲电磁场和交流电。研究表明,电刺激不仅可以增强角质形成细胞[11]和真皮成纤维细胞[12]的迁移速度,而且可以促进成纤维细胞的增殖[13],加速了伤口愈合。口腔黏膜与皮肤同属于上皮组织,电刺激对皮肤创面的有效修复能够对口腔黏膜的创面愈合起到一定的启示作用。本研究数据显示,25μA、10 min的DCS可促进hOMF的增殖,但当刺激时长延长至60 min时,电刺激明显增加了hOMF的凋亡(P<0.001),这可能是由于高强度、长时间的DCS改变了细胞膜通透性,导致离子稳态的丧失,细胞膜电位的改变及细胞凋亡相关生长因子的分泌,进而导致了细胞凋亡。随着研究的进一步深入,可以关注于DCS对hOMF增殖情况的可控性,以达到良好的角质上皮覆盖,促进创面愈合。
VEGF作为一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加,细胞外基质变性,血管内皮细胞迁移、增殖及血管形成等作用。VEGF不但具有抗凋亡特性,也具有抗下调促进细胞增殖的特性。研究表明,使用恒流方波脉冲电刺激提高了神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子 (brain-derived neurotrophic factor,BDNF)、神经细胞黏附分子(neural cell adhesion molecule,NCAM)和VEGF的分泌水平,这些营养因子可与酪氨酸激酶受体结合,激活PI3K/Akt通路[14]。大量研究表明,Akt通过激活细胞增殖并抑制细胞凋亡2种机制诱导细胞存活[15]。电刺激下PI3K/Akt信号通路的激活抑制了细胞凋亡[16-17]。电刺激可以促进卫星细胞增殖,其背后的机制是电刺激激活电压门控钙通道的开放,从而导致Ca2+流入细胞,Ca2激活Akt,促进细胞增殖[18]。PTEN是一种双重磷酸酶,可以编码磷脂磷酸酶活性和蛋白磷酸酶活性,并且可以负向调节PI3K/Akt通路[19]。mTOR信号能与PI3K/Akt通路相互作用,影响细胞增殖。Western blotting检测PTEN/Akt/mTOR通路相关蛋白的表达,在不同时长的DCS下,刺激5、10 min后的p-mTOR的蛋白表达均显著升高(P<0.01),mTOR的蛋白表达水平无明显变化。p-Akt的蛋白表达在DSC刺激5 min后略升高(P<0.05),刺激10 min后蛋白表达水平显著升高(P<0.01),Akt(pan)的蛋白表达水平无明显变化。相对对照组,各刺激时长对应的PTEN的蛋白表达均有所降低,刺激5、10 min后的蛋白表达(P<0.001)较刺激30、60 min后的蛋白表达水平(P<0.01)降低得更明显。p-mTOR和p-Akt作为mTOR和Akt的活化形式,蛋白表达变化一致,而PTEN则与之相反,变化趋势符合PTEN/Akt/mTOR信号通路活化的表现,也与测得细胞增殖情况的吸光度值相一致。
综上所述,从体外实验层面看,DCS可促进hOMF的增殖,诱导VEGF的高表达。DCS促进hOMF的增殖可能是通过VEGF激活了PTEN/Akt/mTOR信号通路实现的,但该结果需要在体内实验得以证实,其深入的机制和临床应用尚需行进一步的研究。
