Mito-OS-Timer:一种靶向监测线粒体氧化应激的荧光秒表
2023-01-05张小妮翁伊纯范奕浩王晓娟赵佳宇张云龙
张小妮 翁伊纯 范奕浩 王晓娟 赵佳宇 张云龙
(东华大学化学化工与生物工程学院,上海 201620)
线粒体是真核细胞的氧化供能中心,进行生物氧化和能量转换时常伴随着“活性氧”的产生,活性氧会造成线粒体内膜通透性加强,膜内外离子浓度的失衡,这种活性氧产生与抗氧化系统失衡状态被称为线粒体氧化应激(mitochondrial oxidative stress,Mito-OS)[1]。 活 性 氧 簇(reactive oxygen species,ROS)包括超氧阴离子自由基(O2-)、羟基自由基(OH-)和过氧化氢(H2O2)等,ROS介导的氧化应激会造成线粒体的结构改变和功能障碍,即线粒体损伤[2]。此外,ROS还可以激活各种转录因子,例如细胞色素C转移酶、BAX、Caspase 等[3]。线粒体功能障碍会破坏细胞、组织和器官功能,进而引发衰老或多种疾病,如癌症、心血管疾病、神经退行性疾病以及肝肾疾病等,因此,线粒体已成为诊治疾病的一个新靶点[4-5]。
探究线粒体氧化应激机理及其相关疾病发生机制,探索氧化损伤预防措施和开发抗氧化应激治疗候选药物等过程,稳定可靠的氧化应激细胞或动物模型是必需条件。目前,氧化应激细胞模型主要通过H2O2诱导构建;而动物模型主要包括两类:一是非特异性模型,即针对动物组织器官造成全身性氧化损伤的模型,如D-半乳糖模型[6]、辐照模型[7]、臭氧损伤模型[8]等;另一类为特异性模型,即针对动物某个组织器官造成靶向损伤,如溴化苯模型[9]、阿霉素模型[10]、四氧嘧啶模型[11]、尼古丁损伤模型[12]和谷氨酸模型[13]等。为了确保模型的稳定性,评价标准尤为重要,现有氧化应激的评价指标主要有直接和间接两种类型:直接指标主要针对氧自由基的产生量,Sánchez等[14]曾利用自由基分析仪检测仔猪断奶应激引起的血清中O2-、H2O2、NO等自由基的产生量;间接指标则针对抗氧化剂的质量浓度或活性,包括总氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)和谷胱甘肽还原酶(GR)等。然而,上述评价方法都是基于氧化应激导致的细胞形态学变化、动物表型变化或特征代谢产物生成情况等进行的,无法实现实时监测动态变化情况,并存在一定的不稳定因素。
绿色荧光蛋白(green fluorescent protein,GFP)的问世为生命科学领域点亮了一盏明灯,随后钱永健等科学家们开发出多种不同颜色的荧光蛋白,借助融合蛋白构造“荧光分子探针”为蛋白质定位、示踪及其相互作用等研究提供技术支持。但单色荧光蛋白在空间定位和示踪方面存在不足。Terskikh等[15]采用易错PCR方法改造红色荧光蛋白drFP583,筛选到一种四聚体的突变体,命名为DsRed1-E5,荧光颜色可随时间推移由绿色(激发光和发射光最大波长:483 nm和500 nm)不可逆地转变为红色(激发光和发射光最大波长:558 nm和583 nm),由于DsRed1-E5初表达产物在激发光下显示绿色荧光,随着Tyr(67)不断氧化。颜色转变速率不受蛋白浓度、pH值和离子强度影响,但温度、光照和氧浓度会影响其红绿荧光比[16]。Hernandez等[17]首次构建了一种靶向线粒体的荧光计时器“MitoTimer”,即将荧光蛋白DsRed1-E5与定位线粒体内膜的细胞色素C氧化酶COX8A亚基融合,初步证实可用于检测线粒体发生。
本文报道了一种真核细胞线粒体氧化应激的荧光报告系统,命名为“线粒体氧化应激荧光监测系统”(mitochondrial oxidative stress fluorescent timer,Mito-OS-Timer),并利用Mito-OS-Timer验证了FLCN基因表达异常可促发线粒体氧化应激,证明该系统可监测线粒体氧化应激的动态变化情况,这为氧化应激细胞模型的评价建立了一种新方法,也为开发动物模型相关评价方法奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与细胞系 E.coli DH5α感受态细胞、人胚胎肾细胞HEK 293T为本实验室备存。重组 质 粒 pLVX-shRNA、pcDNA-3HA-FLCN、pCMVHalo-FLCN为本实验室备存,pLVX-MitoTimer购于优宝生物公司;pLVX-Mito-OS-Timer委托通用生物公司合成。
1.1.2 试剂与设备 DMEM培养基、2,7-二氯荧光乙酰乙酸盐(2,7-Dichlorodi-hydrofluorescein diacetate,DCFH-DA)、鱼藤酮和青霉素-链霉素购自Sigma公司;QuaCellTM特级胎牛血清购于上海益启公司;GAPDH购自Bioss公司;D-PBS、Lipo 8000TM转染试剂购于碧云天公司;H2O2购自国药集团;质粒中提试剂盒购自Magen公司;CO2培养箱购自Sigma公司;Western转膜仪和凝胶成像仪购自Bio-Rad公司;倒置荧光显微镜购自徕卡公司;流式细胞仪购于BD公司。
1.2 方法
1.2.1 重组质粒pLVX-shFLCN构建与扩增 常规PCR方法扩增FLCN基因,上游引物:5′- TATAGA ATTCATGAATGCCATCGTGGCTCTC-3′;下游引物:5′-ATATCTCGAGGTTCCGAGACTCCGAGG-3′,以 pCMVHalo-FLCN为模板。pLVX-shRNA载体与PCR扩增片段用EcoR I和Xho I双酶切后,T4 DNA连接酶进行连接并转化E.coli DH5α感受态细胞,筛选和扩增的阳性克隆,抽提重组质粒并委托上海生工测序,经BLAST分析正确的克隆-80℃贮存备用。
将含pLVX-shFLCN重组质粒的阳性克隆菌接种至含氨苄的3 mL LB培养基进行扩增,37℃,225 r/min过夜摇菌培养至约OD600=0.5,经中提试剂盒抽提质粒,以去除内毒素后,Nano Drop检测定量后备用。
1.2.2 细胞转染 将HEK 293T细胞培养于24孔板内,DMEM培养基(10%胎牛血清,1∶1 000 Penicillin-Streptomycin),待细胞长至60%左右,0.8 μL Lipo8000TM转染试剂、25 μL Opti-MEM与500 ng pLVX-shFLCN重组质粒混匀,室温静置5 min。加入到孔板中转染4 h,换液并添加2 μg/mL强力霉素(doxycyclin,简称Dox)诱导表达,37℃,5% CO2培养48 h。
1.2.3 ROS水平检测 HEK 293T细胞培养于24孔板中,待细胞长至约90%时,采用0、10、50、75、100 μmol/L H2O2避光处理,37℃,5% CO2避光培养6 h,D-PBS洗1次,加入 10 μmol/L DCFH-DA,室温避光孵育20 min。D-PBS洗3次后,为减少荧光淬灭影响实验结果,应立即倒置荧光显微镜(激发光/发射光=488/535 nm)10倍放大率下观察荧光情况。在无细胞区域进行背景荧光校正后获取荧光图。
1.2.4 流式细胞术分析 6孔板培养HEK 293T细胞,待长至70%以上,200 μL Opti-MEM培养基、3.2 μL Lipo8000与2 μg转染质粒混匀,室温静置5 min,将混合试剂滴加在孔板中,使细胞转染质粒4 h,更换完全DMEM培养基(10% FBS,1∶1 000 P/S)培养48 h。弃去培养基,D-PBS洗1次,300 μL胰蛋白酶消化1 min,加入400 μL培养基终止消化。将细胞液转到1.5 mL EP管中1 900 r/min离心5 min,弃去上清,1 mL D-PBS重悬,1 900 r/min离心5 min,弃去上清,加入1 mL 4%多聚甲醛,室温固定10 min,1 900 r/min离心5 min后吸出875 μL的4%多聚甲醛,向剩余溶液中加入375 μL的D-PBS重悬,将样品用流式细胞仪进行分析,选择FITC和PE通道分别筛选绿色与红色荧光信号。
1.2.5 数据处理与分析 采用倒置荧光显微镜和流式细胞仪检测细胞内荧光强度,由于红绿荧光光谱有明显叠加现象,因此计算结果时需要去除干扰值。通过分别转染Mito-DsRed和Mito-GFP,确定红绿荧光间相互干扰值。所有实验均独立重复至少3次,所有值均为x-±s,然后采用GraphPad Prism 6分析制图。
2 结果
2.1 荧光秒表Mito-OS-Timer系统的建立与评价
2.1.1 Mito-OS-Timer实时监测H2O2诱导细胞模型的线粒体氧化应激状态 线粒体氧化应激细胞模型建立首先采用常规H2O2诱导法,如图1所示,经0、10、50、100、200 和 300 μmol/L H2O2诱导线粒体处于氧化应激状态,ROS使用DCFH-DA检测氧化应激水平。为保证采集面积一致,细胞群体的采集指标是视野荧光集合采集。用Image J分析获得平均荧光强度(该区域荧光强度总和除以该区域面积)。据实验结果统计分析,未添加H2O2处理的绿色荧光强度为18.7,随着H2O2浓度的增加绿色荧光强度随之增加,当H2O2浓度达到300 μmol/L时荧光强度升高至22(图1-B)。上述实验结果表明,随着H2O2浓度增加细胞线粒体内产生的ROS水平增加,即成功的构建了线粒体氧化应激细胞模型。
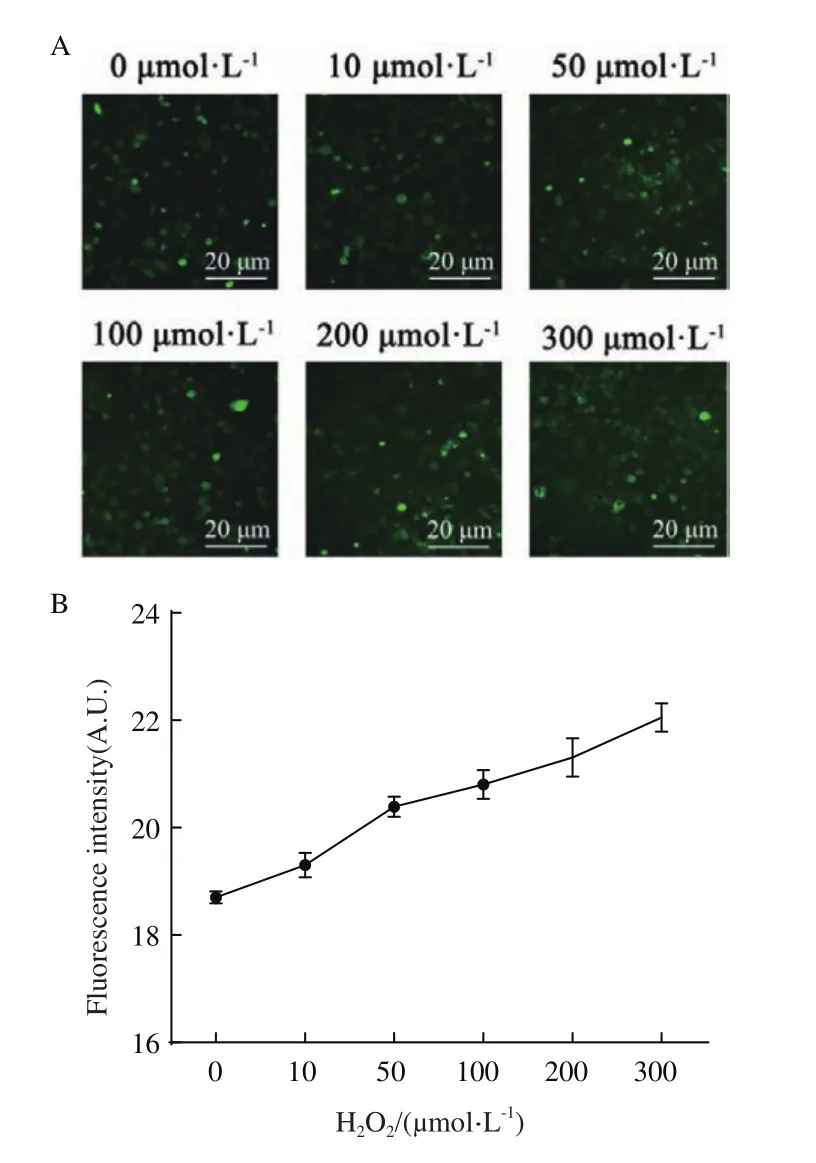
图1 H2O2诱导氧化应激细胞模型的评价Fig.1 Evaluation of H2O2-induced oxidative stress cell model
荧光秒表Mito-OS-Timer系统主要借助于可变色荧光蛋白DsRed1-E5红绿荧光变化与活性氧浓度线性相关,并设计利用线粒体内膜的ATP合酶亚基ATP5PB的定位区域编码基因与DsRed1-E5基因融合,正如图2-A所示,启动序列采用pLVX启动子模块,Timer序列前插入Kozak序列,提升翻译启动效率。Kozak序列通常位于真核生物mRNA 5′端帽子结构下游的一段高度保守序列,通常为GCCACCAUGG,它与翻译起始因子结合而介导mRNA翻译起始,相当于原核生物的SD序列。
将设计合成的pLVX-Mito-OS-Timer表达质粒转染HEK 293T细胞,在强力霉素(doxycyclin)诱导下,Mito-OS-Timer融合基因表达并靶向线粒体,在激发光下显示出绿色荧光,如图2-B所示。细胞在不同浓度 H2O2(0、10、50、100、200、300 μmol/L)避光处理24 h后,采用倒置荧光显微镜观察各组细胞荧光情况。线粒体处于氧化应激状态时,线粒体内产生大量的ROS,其会加快这种氧化速度,进而加快红绿荧光转变速率。在这里使用不同浓度的H2O2使线粒体处于不同强度的氧化应激状态,Mito-OSTimer系统可跟踪监测氧化应激强度的变化。如图2-C、2-D所示,未诱导时,Mito-OS-Timer系统基本以绿色荧光为主,红绿荧光比值为0.18,随着H2O2浓度增加红色荧光强度增加,融合起来的荧光图变成黄色,H2O2浓度到300 μmol/L时基本上都转变成红色荧光,红绿荧光比值增加到1.52。从上述结果可看出,随着H2O2浓度的增加Mito-OS-Timer系统红绿荧光比值增加,Mito-OS-Timer系统成功被构建。
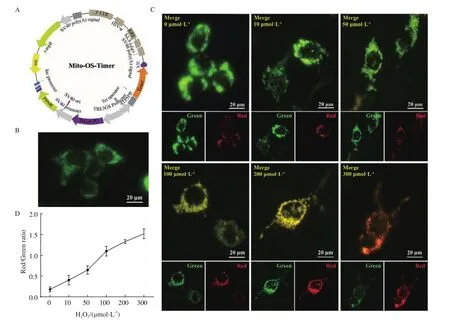
图2 Mito-OS-Timer系统靶向监测H2O2诱导细胞模型的线粒体氧化应激动态变化Fig.2 Mito-OS-Timer targets to monitor the dynamic changes of mitochondrial oxidative stress induced by H2O2 in cell models
2.1.2 Mito-OS-Timer监测鱼藤酮诱导细胞模型的线粒体氧化应激动态变化 虽然H2O2诱导氧化应激细胞建模是常规方法,但存在一定不稳定因素,因此采用其他建模方法进行验证。鱼藤酮是一种线粒体呼吸链抑制剂,主要作用于线粒体呼吸链NADH脱氢酶处抑制电子的传递,阻止NADH的氧化,可促发线粒体产生氧化应激。本实验采用不同浓度的鱼藤酮(0、0.01、0.1、0.5、1和 5 μmol/L)诱导细胞产生不同强度的线粒体氧化应激。未加鱼藤酮时,Mito-OS-Timer系统的绿色荧光很强,红绿荧光比为0.08,随着加入鱼藤酮浓度的增加,绿色荧光减弱,红色荧光增加,当达到5 μmol/L时,红绿荧光比达到0.51(图3-A、3-B)。

图3 鱼藤酮诱导线粒体氧化应激细胞模型评价Mito-OS-Timer系统Fig.3 Evaluation of Mito-OS-Timer system in rotenone-induced mitochondrial oxidation cell model
为了验证结果的可靠性,进一步采用流式细胞术(flow cytometry,FCM)检测红绿荧光比变化情况。未经鱼藤酮处理的细胞,其红绿荧光比值为2.46,而鱼藤酮处理后,红绿荧光比值增加,如图4-A、4-B所示,鱼藤酮处理浓度在0.5-5 μmol/L时的红绿荧光比增加较缓,但当浓度超过5 μmol/L,由于过度诱导则使得细胞线粒体处于凋亡状态,红色荧光强度反而降低,红绿荧光比值开始下降。上述结果表明,随着H2O2和鱼藤酮处理浓度的增加,模型细胞内的红绿荧光比值增加,证实Mito-OS-Timer系统不仅能够监测线粒体的氧化应激状态,而且能实现动态变化的可视化。
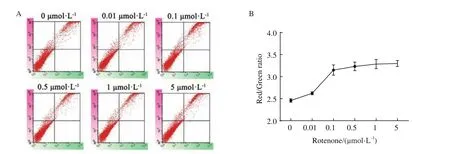
图4 Mito-OS-Timer监测鱼藤酮诱导线粒体氧化应激细胞模型的流式细胞术检测结果Fig.4 Flow cytometry results of rotenone-induced mitochondrial oxidation in rotenone-induced cell models monitored by Mito-OS-Timer
2.2 Mito-OS-Timer系统检测FLCN基因与线粒体氧化应激的信号调控关系
为了进一步验证Mito-OS-Timer系统检测线粒体氧化应激的实效性,构建了pLVX-shFLCN重组质粒并进行电泳鉴定,结果见图5-A、5-B,随后与pcDNA-3HA-FLCN分别转染HEK 293T细胞并诱导表达,Western Blot检测FLCN蛋白表达情况。如图5-C所示,转染pcDNA-3HA-FLCN质粒的细胞中FLCN蛋白表达量比对照细胞(WT)中FLCN蛋白表达量明显增加,转染pLVX-shFLCN质粒的细胞与对照细胞相比,FLCN表达量明显减少。上述验证了FLCN高表达和沉默质粒系统构建成功。随后,转染了Mito-OS-Timer的细胞用作阴性对照,使Mito-OS-Timer分别与pLVX-shFLCN、pcDNA-3HAFLCN重组质粒共转染,利用Dox.诱导表达48 h,将转染Mito-OS-Timer的细胞用0.1 μmol/L 鱼藤酮处理作为阳性对照。经荧光显微镜和流式细胞仪检测结果可看出,转染了使FLCN基因过表达的pcDNA-3HA-FLCN重组质粒的细胞,Mito-OS-Timer红绿荧光强度和红绿荧光比值与仅转染Mito-OS-Timer的几乎一样,说明FLCN基因过表达并不会使线粒体发生线粒体氧化应激,而转染了使FLCN基因沉默的pLVX-shFLCN质粒的细胞,Mito-OS-Timer红绿荧光强度和红绿荧光比值明显增强(图6-D-F),这表明FLCN基因沉默可促发细胞线粒体产生氧化应激现象,这与以往报道相符,结果更具有可视化。
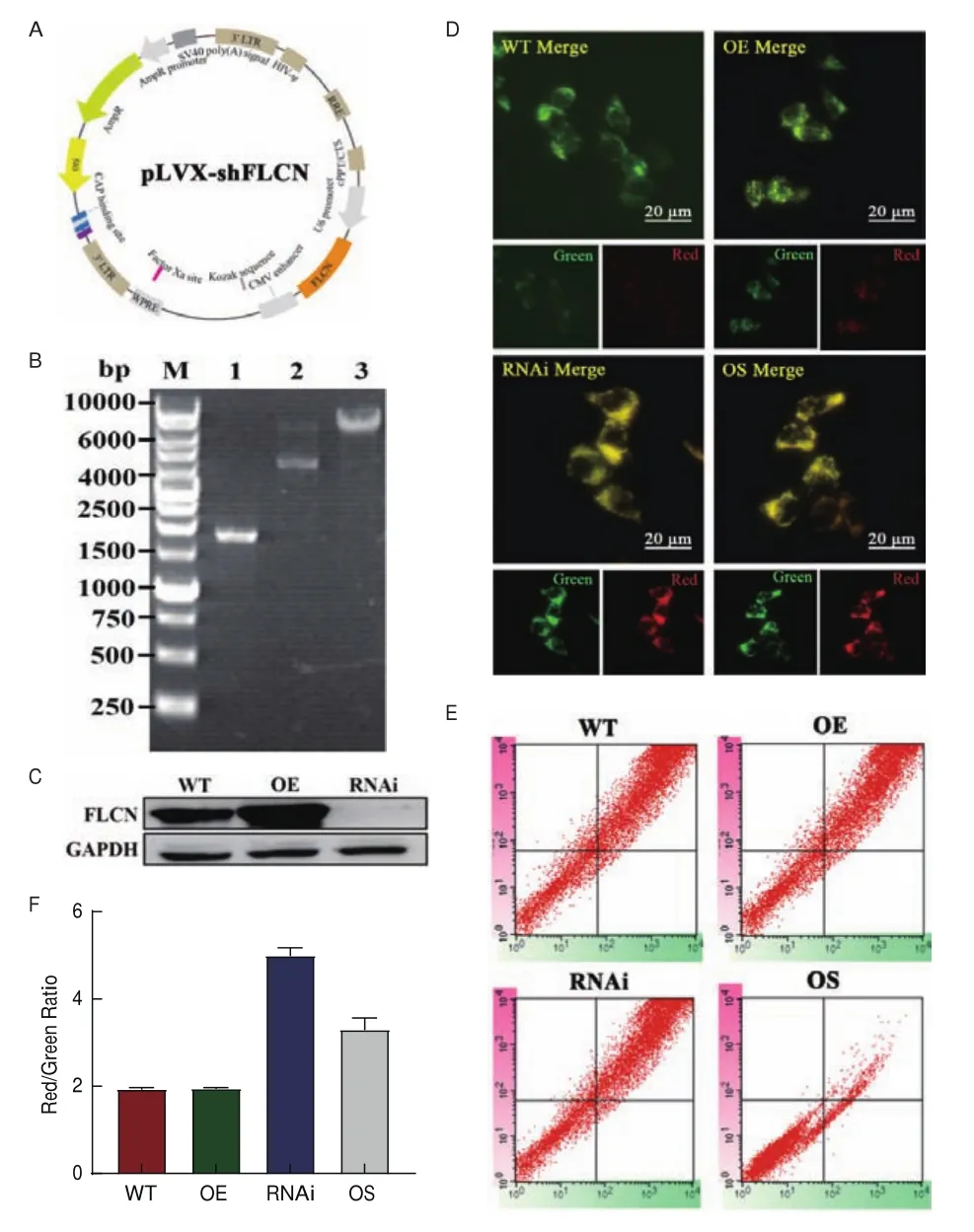
图5 Mito-OS-Timer检测FLCN基因表达与线粒体氧化应激动态变化关系Fig.5 Relationship between FLCN gene expression and mitochondrial oxidative stress dynamic changes detected by Mito-OS-Timer
3 讨论
本文报道了一种评价氧化应激细胞模型的荧光蛋白实时监测系统,即Mito-OS-Timer系统,具有线粒体靶向性和荧光颜色变化与活性氧浓度正相关等特性。实验结果表明,H2O2诱导和鱼藤酮处理的氧化应激细胞模型中,Mito-OS-Timer可借助ATP5PB序列靶向定位线粒体,其红绿荧光比值与诱导剂浓度呈正相关,证实其可作为评估细胞内线粒体氧化应激程度的可视化工具。为了进一步评价该系统的可行性,利用Mito-OS-Timer检测并证实FLCN基因表达沉默可诱发细胞线粒体氧化应激发生,此结果与以往研究基本一致[18]。
氧化应激(oxidative stress,OS)描述了体内氧化和抗氧化作用失衡的一种状态,由德国科学家Helmut Sies首次于1985年提出[19]。随后,经研究发现衰老和糖尿病、癌症等疾病的发生与之相关而备受关注。近年研究表明,氧化应激是一个由细胞内多种细胞器参与的复杂生化过程,包括线粒体、内质网、高尔基体等。因此,针对各种细胞器建立细胞或动物模型探究相关疾病发病机理成为了一种研究策略。线粒体氧化应激细胞模型的构建,通常采用H2O2诱导或呼吸链抑制剂处理等方法。本研究分别利用H2O2和鱼藤酮两种方法构建了氧化应激细胞模型。H2O2是一种性质相对稳定且容易获得的氧化能力较强的活性氧,是构建细胞氧化损伤常用的诱导剂。鱼藤酮有着小而疏水的结构,能够穿透细胞内部并与NADH脱氢酶相结合,阻断了电子由NADH向辅酶Q的传递。这种电子转移的抑制干扰了电化学梯度,影响线粒体膜电位,产生的电子不能被正常传输,会造成超氧自由基和活性氧的大量积累,最终造成线粒体氧化应激[19]。但也有其他建模方法,例如:Zhang等[20]在非酒精脂肪肝病研究中通过抑制NFκB/Orai1信号通路的方法诱发氧化应激,即正常大鼠肝细胞(BRL-3A)经NEFA3、BTP2、Orai 1抑制剂处理,分光光度计测量胞内还原谷胱甘肽(GSH)和丙二醛(MDA)含量,Western Blot和qRT-PCR分析Orai 1等氧化应激相关蛋白表达情况,免疫荧光法检测活性氧(ROS)水平,以明确氧化应激的发生。正如上所述,常规的细胞模型评价方法都是直接或间接检测氧自由基生成量或氧化应激相关因子的表达情况,但这类静态指标的检测方法,操作过程繁琐、实验结果准确性低且费用较高[21]。相较于以往的研究,本研究所提出的Mito-OS-Timer系统能够在细胞水平对整个氧化应激过程进行实时监测,为研究细胞水平氧化应激的发生提供了一种新的研究思路。
为了验证Mito-OS-Timer系统的实用性,基于本课题组前期工作设计了一个线粒体氧化应激检验模型。人源肿瘤抑制因子Folliculin(简称FLCN)的突变或缺失会诱发Birt-Hogg-Dubé(BHD)综合征[22]。Baba 等[23]发现 FLCN 基因敲除小鼠肾脏肿瘤细胞中雷帕霉素复合体(the mammalian target of rapamycin,mTOR)信号被激活。mTOR持续激活可以增强过氧化物酶体增殖物激活受体γ共激活因子1(peroxisome proliferator-activated receptor coactivator-1,PGC-1)的基因表达,从而增加线粒体基因表达和氧耗,进而导致线粒体生物发生和活性氧(ROS)产生加剧,线粒体氧化应激程度加深[22]。Hasumi等[24]发现FLCN的缺乏促发PPARGC1A表达上调,导致线粒体功能异常,氧化代谢增强,推测可能是FLCN缺失肾细胞获得生长优势并驱动增生转化。这些研究表明,明确FLCN缺失或突变与线粒体氧化应激之间关联对于揭示BHD综合征未知的发病机制尤为重要。如图5所示,证实下调FLCN基因表达水平会诱发线粒体氧化应激发生,以一种可视化结果证实以往研究的正确性。
本文报道的Mito-OS-Timer系统虽可评价氧化应激细胞模型,但是细胞模型不能准确反应疾病发生的病理特征,甚至可能获得较为矛盾的结果,课题组正着手利用该系统构建动物模型评价体系,有望与高度敏感、高通量的生物发光成像技术相结合,为氧化应激动物模型提供可视化监测方法。
4 结论
成功构建了一种靶向监测线粒体氧化应激的荧光蛋白系统Mito-OS-Timer。结果表明其红绿荧光颜色转变速率与线粒体氧化应激程度呈正相关,实现了对线粒体氧化应激发生的实时动态可视化监测。研究进一步证实,FLCN基因的沉默能够引起线粒体氧化应激。该系统在细胞模型上成功应用,但在动物模型上的应用有待进一步研究。