噬菌体制剂在家禽生产中的应用及安全性评价
2023-01-05王君雁范秋丽兰瑞霞蒋守群
王君雁 范秋丽 兰瑞霞 蒋守群*
(1.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州510640;2.广东海洋大学,湛江524088)
噬菌体是一类微生物病毒,能感染细菌、真菌、放线菌以及螺旋体等微生物。1915年,英国微生物学家Twort[1]首次证明在葡萄球菌培养液中发现的噬菌体能使金黄色葡萄球菌发生凋亡;1917年,D’Herelle[2]正式提出噬菌体的概念,并成功治疗了疟疾等人类疾病。由于噬菌体具有特异性强、毒副作用小、增殖速度快和成本低等优点[3],成为新型替抗添加剂。目前,国外将噬菌体广泛应用于动物疾病防控、食品源性病菌清除、农作物细菌感染治疗以及生物被膜的抑菌作用等方面,而国内噬菌体的研究尚处于发展阶段。
噬菌体在实际生产中能有效提高动物的繁殖性能和生产性能[4]。目前噬菌体在替抗饲料添加剂方面研究较少,这限制了噬菌体制剂在养殖业中的应用;此外,噬菌体制剂的应用也受限于噬菌体产生的内毒素会对畜禽机体造成损伤。本文结合近年来国内外相关研究进展,从噬菌体特性、在家禽生产中的应用、制剂研发以及安全性评价等方面进行综述,旨在为噬菌体制剂在家禽生产中的科学应用提供参考。
1 噬菌体的结构、特性及分类
1.1 噬菌体的结构
噬菌体长度为24~200 nm,通常由头部和尾部2部分组成,其中头部包含衣壳蛋白和核酸,尾部为长管结构,能帮助噬菌体整合到细菌细胞内[5]。噬菌体结构的稳定性与衣壳蛋白有关,Asija等[6]在3.3Å冷冻E花环结构基础上,使用E环氨基酸E52、E59和E72通过具有P结构域残基R102、R109和K118的衣壳内盐桥来稳定噬菌体P22病毒体衣壳,并分别将谷氨酸残基突变为丙氨酸;结果表明,E花环和P结构域之间的相互作用力能稳定噬菌体P22结构,且基因突变不会破坏噬菌体的稳定性。
1.2 噬菌体数据库
噬菌体广泛存在于自然界中,目前已发现的噬菌体数量总数有1031个[7]。人们为了快速筛选出目的噬菌体,因此建立了噬菌体数据库。最早介绍噬菌体筛选技术的是Smith[8],他用M13丝状噬菌体作为载体,将外源DNA掺入M13丝状噬菌体染色体中,使外源肽融合到M13噬菌体的G3P涂层蛋白上形成融合蛋白,并利用基因产物的抗体进行克隆筛选。Gao等[9]根据噬菌体的特异性,建立了微生物-噬菌体相互作用(microbe versus phage,MVP)数据库,可以对噬菌体进行靶向选择。该数据库从美国国家生物技术信息中心(NCBI)病毒基因组、NCBI原核生物参考基因组数据库、人类肠道组装宏基因组序列以及已发表数据集的病毒和噬菌体序列中,确定了30 321个宿主-噬菌体关联,包含了与9 245种原核生物发生相互作用的18 608个病毒簇。
1.3 噬菌体的分类
噬菌体有多种分类方式,根据尾部形态结构可分为有尾噬菌体和无尾噬菌体;其中,有尾噬菌体约占噬菌体总数的96%,现有的噬菌体有142科和81个亚科[10],可分为短尾噬菌体科、长尾噬菌体科以及肌尾噬菌体科,其中长尾噬菌体科数量最多[11]。根据噬菌体中所含核酸种类可分为单链RNA、双链RNA、单链DNA以及双链DNA。根据蛋白质外壳分类又分为无尾二十面体结构、有尾二十面体结构以及线状体(由壳粒组成的盘旋状结构)[12]。按与宿主的关系可分为温和噬菌体和烈性噬菌体[13]。噬菌体的大致分类如图1所示。
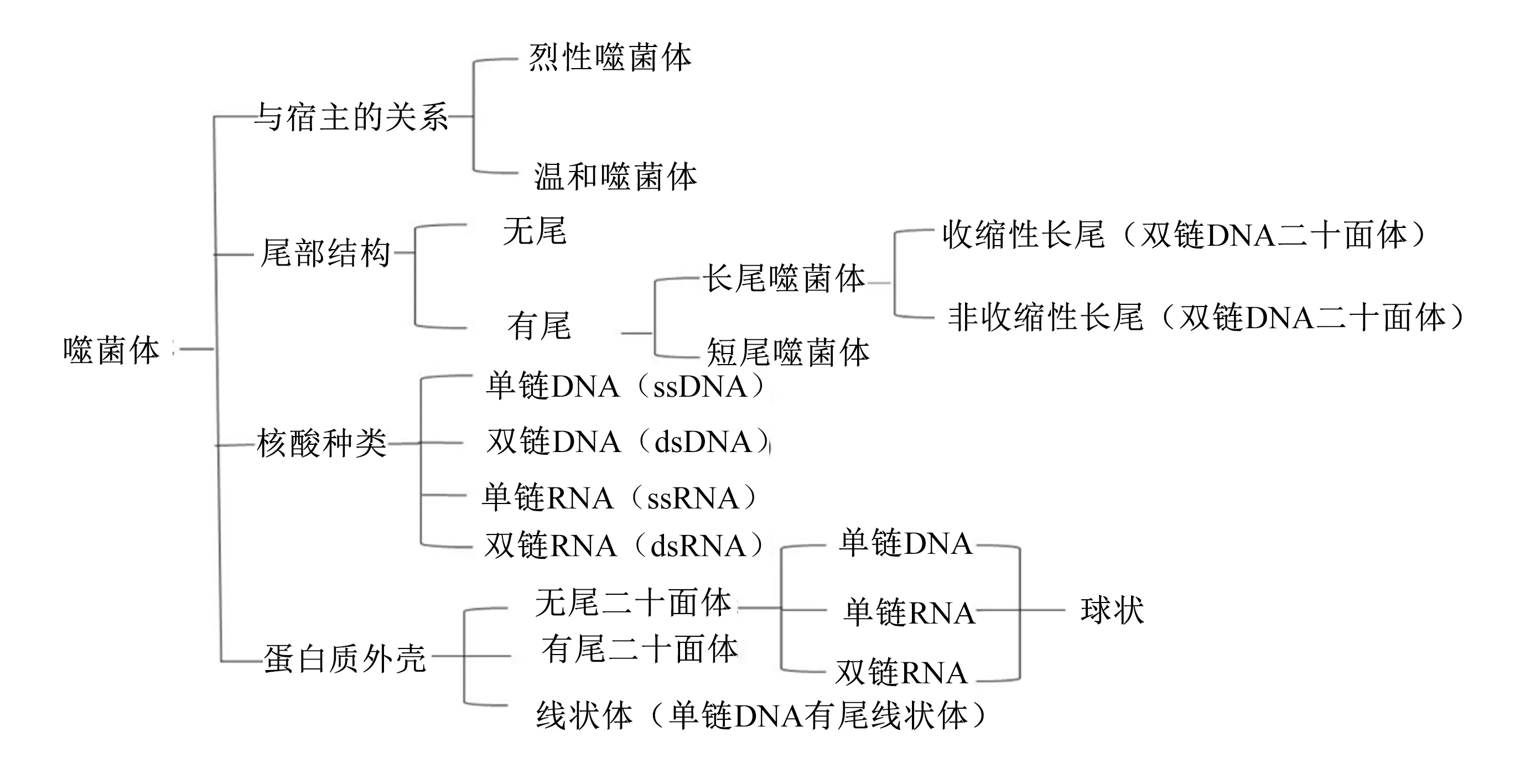
图1 噬菌体的分类
2 噬菌体制剂在家禽生产中的应用
2.1 噬菌体制剂在肉鸡生产中的应用
噬菌体最开始用于治疗畜禽的肠道感染[14]。近年来研究发现,将噬菌体制剂加入饲粮中能显著提高家禽的生长性能,改善肉鸡肠道菌群结构。卓国荣等[15]选取了672只45 g左右的1日龄肉鸡,分别在饲粮中添加0.25和0.50 g/kg的噬菌体和抗生素,观察肉鸡生长性能、血液特征和微生物脱落的情况,结果发现,0.50 g/kg噬菌体能够提高肉鸡早期的饲料转化率和肝脏相对重量,增加肠道乳酸杆菌数量,减少肠道大肠杆菌和沙门氏菌数量。Pantoja-Don等[16]利用600只罗斯(Ross)308肉鸡评估了β-甘露聚糖酶和噬菌体作为添加剂对盲肠微生物的影响,试验进行了肉鸡生长性能和免疫器官指数的测定以及盲肠微生物的分析,结果表明,噬菌体能够提高免疫器官指数,且与β-甘露聚糖酶混合使用具有改善肠道形态结构的潜力。
2.2 噬菌体制剂在蛋鸡生产中的应用
噬菌体制剂不仅能提高肉鸡的生长性能,还会提高种鸡繁殖性能和抗氧化功能,调节肠道菌群结构。Lee等[17]选取32只40周龄的海兰褐蛋鸡,饲喂14 d含噬菌体的基础饲粮,噬菌体效价为108PFU/kg,试验通过记算免疫器官指数、微生物多样性,并采用实时荧光定量PCR来评价噬菌体对蛋鸡肠道菌群及免疫状态的影响,结果表明,噬菌体能够降低组织器官中沙门氏菌的数量,缓解机体的炎症反应。葛龙等[18]选择了2 400只350日龄的海兰褐蛋鸡进行试验,饲喂基础饲粮和在基础饲粮中分别添加100、300和500 g/t的大肠杆菌、沙门氏菌和魏氏梭菌噬菌体复合剂,测定蛋鸡的生长性能、蛋品质以及肠道菌群数量,结果显示,饲粮中添加复合噬菌体制剂能够提高蛋鸡产蛋率,降低料重比,降低不合格蛋率以及肠道有害菌群的数量,且最适添加量为300 g/t。
2.3 噬菌体制剂在细菌性疾病治疗中的应用
大肠杆菌和沙门氏菌是引起家禽腹泻的主要病原体。噬菌体制剂能够代替抗生素成为新型抗菌剂,用于治疗家禽细菌性疾病。杜新永等[19]利用浓度为106CFU/mL的高致病性大肠杆菌E6对50只1日龄的白羽肉鸡进行攻毒,建立肉鸡气囊炎模型,然后将噬菌体制剂与林可霉素、多西环素进行比较,结果表明,噬菌体混合试剂对肉鸡的大肠杆菌治疗效果良好。Kittler等[20]选择了64只Ross 308肉鸡,向饮水中添加噬菌体制剂,结果表明,噬菌体能够有效减少肠道大肠杆菌数量。丁一峰等[21]利用从环境污水样品中分离出的沙门氏菌噬菌体D1-2和Pu20以1∶1混合的方式对胸肌表面的沙门氏菌进行抑菌试验,结果发现,噬菌体混合制剂在感染复数(MOI)为10 000时,3 h内即可完全抑制鼠伤寒沙门氏菌,且抑菌效果优于单个噬菌体。综上所述,噬菌体不仅能在影响免疫细胞的情况下提高家禽的生长性能、繁殖性能以及免疫功能,还能应用于细菌性疾病的治疗,表1列举了噬菌体在家禽中的作用效果[22-27]。
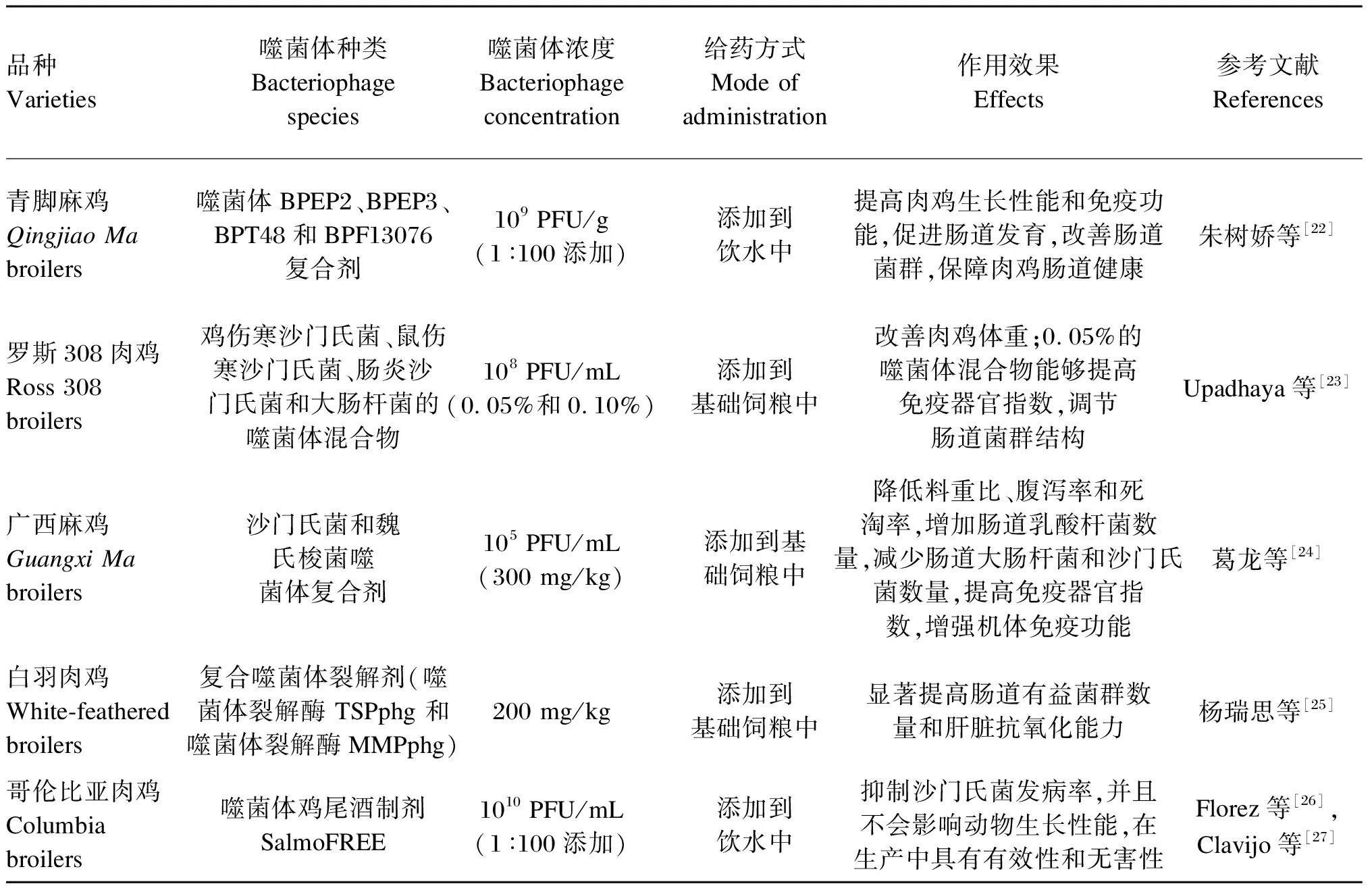
表1 噬菌体在家禽中的作用效果
3 噬菌体制剂的作用机理
3.1 噬菌体对肠道微生物的调控作用
肠道内的微生物能调节家禽生长性能,增强免疫功能。据研究显示,肠道内主要是温带噬菌体,有1 200种基因型可附着于肠道微生物[28]。噬菌体能通过逆转录酶依赖性机制进行靶向突变,产生致病型基因,影响肠道菌群结构[29-31];同时提高肠道黏膜的抗氧化功能,维持动物肠道健康。噬菌体可通过编辑规律间隔成簇短回文重复序列相关蛋白(CRISPR-Cas)限制性修饰系统激活特异性免疫使细菌进行免疫逃逸[32]。Lam等[33]利用M13噬菌体和荧光标记的大肠杆菌菌株构建CRISPR-Cas9噬菌体载体,结果证明,M13噬菌体将DNA呈递给肠道内的大肠杆菌,能利用CRISPR-Cas9进行特异性识别,帮助大肠杆菌进行靶向逃离。Hsu等[34]利用定菌(gnotobiotic)小鼠建立了小鼠肠道微生物-噬菌体模型,通过模型观察到,噬菌体直接与微生物作用会产生级联效应,提高肠道微生物活性,调节肠道代谢活动。
3.2 噬菌体的免疫调节作用
噬菌体除了调节肠道菌群数量,还能与免疫细胞发生反应提高宿主的免疫功能。研究发现,口服噬菌体能治疗多种细菌感染并诱导机体产生抗体[35],影响机体的先天性免疫反应和特异性免疫反应,刺激肿瘤坏死因子(TNF)和白细胞介素(IL)-1α及干扰素(IFN)-γ和IL-27等免疫因子水平升高,但多数仅在群体水平上产生作用。Perea等[36]利用5种丁醇纯化后的噬菌体悬浮液标记健康的单核细胞,与仅含有丁醇缓冲液的样品进行对照,并分别向2组添加多黏菌素B,检测与脂多糖(LPS)识别的单核细胞标记物(CD14)、抗原呈递[人类白细胞抗原DR(HLA-DR)]、共刺激(CD86)以及噬菌体诱导的炎症因子(TNF-α、IFN-α和IL-10)水平,探究噬菌体是否会通过黏膜与单核细胞产生作用,结果显示,丁醇纯化后的噬菌体使单核细胞中IFN-α和IL-10的分泌增高,CD14和CD86的表达降低;所有的噬菌体悬浮液都降低了HLA-DR的表达,且多黏菌素B不能恢复经噬菌体诱导的单核细胞。这证明丁醇纯化后的噬菌体对单核细胞表型和细胞因子产生影响,使其具有耐受性。Leung等[37]建立了一种噬菌体治疗模型,该模型在现有的噬菌体-细菌-免疫系统模型的基础上,根据宿主固有反应的有限能力以及高密度下细菌的免疫逃逸进行改进,结果表明,噬菌体会与宿主先天性免疫反应产生协同作用消灭细菌,且该协同效应更加稳定。当噬菌体经不同途径进入机体后主要在肝脏进行降解,进入机体的噬菌体颗粒经网状内皮系统筛选后会呈递给单核巨噬细胞,进而激活特异性免疫。噬菌体的作用机理如图2所示。
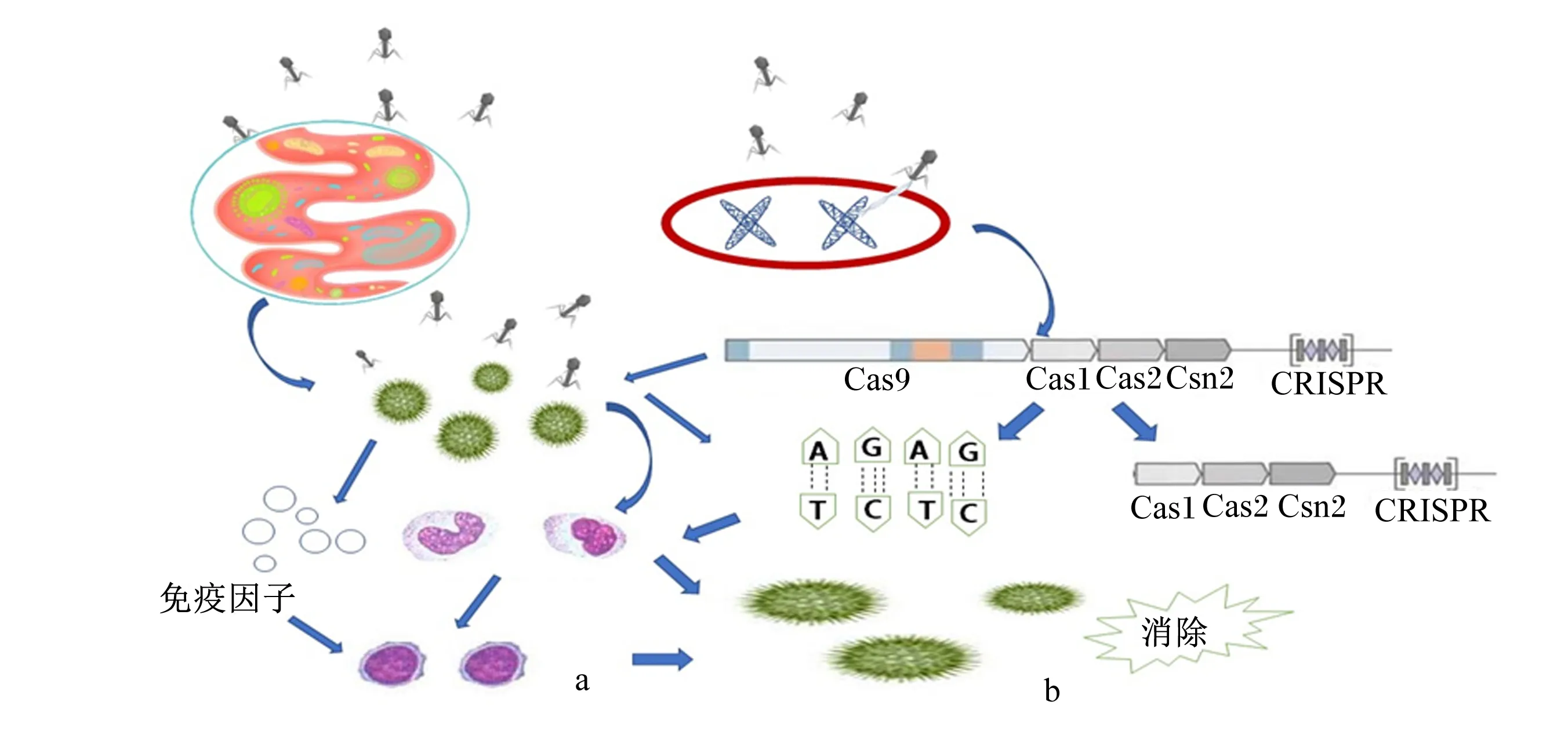
a:噬菌体通过直接或间接的方式激活特异性免疫和非特异性免疫;b:噬菌体整合到细菌DNA上形成前噬菌体,细菌通过CRISPR-Cas系统进行免疫逃逸。
噬菌体的调控机制大体分为2部分:1)前噬菌体能通过CRISPR-Cas系统进行免疫逃逸,激活机体的特异性免疫应答,调控肠道菌群结构,该过程与疫苗免疫过程相似;2)噬菌体能通过直接或间接的方式激活细胞的非特异性免疫和特异性免疫,但噬菌体引起的免疫反应会降低噬菌体的活性和抗菌效果,且只会对单个细菌产生特异性反应。
4 噬菌体制剂的研发与安全性评价
4.1 噬菌体制剂的研发
实际生产中,根据噬菌体的自身性质以及成分,选择合适的赋形剂以保护噬菌体抗逆生长,维持噬菌体活性。目前常用的噬菌体赋形剂包括食品级聚合物、脂质体以及pH应性高的分子材料[38]。虽然噬菌体赋形剂能够保证噬菌体的稳定性,但噬菌体制剂的研发同样存在问题:1)目前耐药菌株克隆体对噬菌体的耐药性还是未知数[39];2)单一噬菌体和多种噬菌体制成的“鸡尾酒制剂”在生产上如何进行选择[40];3)噬菌体中含有的多种孤儿基因(ORFans),其中一部分为不良基因,容易产生内毒素,因此其安全性还需进行评估[41]。
4.2 噬菌体制剂的安全性评价
4.2.1 噬菌体制剂安全性评价方法
噬菌体的给药剂量、给药时间以及给药方式都会对噬菌体制剂的安全性造成影响,临床上主要通过攻毒试验来对噬菌体的安全性进行评价。Saima等[42]利用金黄色葡萄球菌和铜绿假单胞细菌噬菌体对患者进行抗生素协同治疗,结果表明,噬菌体能辅助抗生素进行临床治疗,且具有良好的耐受性。Khalifa等[43]使用粪肠球菌菌株制作粪肠球菌肠道致病模型,并用分离出的噬菌体EFDG1与EFLK1进行治疗及药敏试验,对噬菌体的安全性以及治疗效果进行评价,通过向21~25 g的雌性ICR小鼠腹腔注射粪肠球菌制成小鼠腹膜炎模型,分为4个组,包括对照组、250 μL的2×108PFU/mL EFDG1和EFLK1混合物、250 μL的12.5 mg/kg氨苄西林以及噬菌体和抗生素混合治疗,结果显示,单次注射噬菌体混合物足以完全逆转由耐万古霉素粪肠球菌引起的高死亡率趋势,且不会对肠道内的微生物产生毒副作用。Fong等[44]建立了绵羊鼻窦炎感染模型,并用铜绿假单胞菌噬菌体鸡尾酒制剂进行治疗,结果显示,噬菌体鸡尾酒制剂浓度为108~1010PFU/mL时不会对机体造成损伤。
噬菌体制剂的安全性评价是降低噬菌体制剂在临床产生毒副作用的基础。噬菌体产生的内毒素在家禽体内富集会对组织器官造成损伤,因此解决噬菌体带来的毒副作用是保障噬菌体制剂安全性的重要方法。
4.2.2 噬菌体制剂的脱毒方法
噬菌体产生的内毒素能对机体产生毒害作用,内毒素脱毒是噬菌体研发中保证噬菌体安全的重要环节。细菌内毒素脱毒包括2个方面:1)内毒素检测;2)内毒素脱毒。
目前运用的内毒素生物学检测技术有兔热原试验(RPT)、牛全血试验(bWBA)以及鲎变形细胞裂解物试验(LAL),生物传感器技术包括电化学检测技术和光学检测技术,不同方式的检测技术的检出限见表2[45-47]。

表2 不同噬菌体检测技术特点
细菌内毒素的脱毒方式分为传统的超滤法、氯仿提取和氯化铯梯度超速离心以及替代的吸附法、色谱法和层析法等,且亲和树脂色谱法的效果最佳。吕可等[48]利用沙门氏菌噬菌体(φFelix O1)建立动态浊度法检测噬菌体制剂中的内毒素,后对凝胶层析法、超滤法以及活性炭吸附法脱除内毒素进行比较,结果显示,基于鲎试剂凝胶反应的动态浊度法对噬菌体制剂中的内毒素敏感性较强,通过3种方法的比较,超滤法的效果优于另外2种脱毒方法。Michalik-Provasek等[49]利用1-十二烷醇有机溶剂来萃取噬菌体的内毒素,该方法在保证噬菌体回收率的条件下有效提取出了噬菌体中的内毒素。
噬菌体制剂的脱毒方式,从最开始的传统脱毒方法到后来的替代方法,根据噬菌体的特性在不断优化。虽然传统的脱毒方法对于肠外给药的噬菌体效果最佳,但毒副作用强、副产物难以消除。现阶段对噬菌体脱毒方式的研究要在保证噬菌体回收率的情况下降低副产物的产率。
5 小 结
总而言之,噬菌体作为一种抗生素替代品能降低细菌数量,提高机体的免疫功能,但该过程有一定的局限作用,只有将噬菌体作用于感染部位才能发挥作用。噬菌体能增加肠道内乳酸杆菌的数量,因此推测噬菌体能调控肉品质,增加风味物质的沉积,提高鸡肉的可食用性。噬菌体能增强家禽的免疫功能,通过内皮网状细胞的呈递作用影响动物生长性能、繁殖性能、免疫功能以及机体正常代谢活动。目前,关于噬菌体与细菌的相互作用、噬菌体制剂对家禽的营养调控作用以及对噬菌体制剂毒副作用的研究,将促进噬菌体作为替抗饲料添加剂在生产中的使用。未来随着分子生物学的研究进展,噬菌体制剂作为替抗添加剂对动物生产的调控作用、噬菌体制剂的安全性评价方式、生产中不同添加类型的噬菌体制剂以及选择脱毒方式等都将为噬菌体制剂在实际生产中的使用奠定基础。
