SPHK1基因对上皮性卵巢癌细胞恶性行为影响及相关机制初步探讨
2023-01-05庞义存邢慧敏马晓琳霍翠敏
赵 欢,庞义存*,赵 郡,邢慧敏,马晓琳,霍翠敏
(1.河北医科大学第三医院妇产科,河北 石家庄 050051;2.河北省石家庄妇幼保健院产七科,河北 石家庄 050006;3.河北省第八人民医院妇科,河北 石家庄 050024)
卵巢癌是女性生殖系统恶性肿瘤之一,卵巢癌具有早期症状不明显,发现晚,确诊时多为中晚期,治疗效果不佳,五年生存率低,预后差等特点[1]。尤其耐药及复发率高这两个问题一直以来是卵巢癌诊治方面面临的一大课题。研究表明,卵巢癌的发病、转移、耐药、复发等机制是一个多因素参与的复杂过程[2]。鞘氨醇激酶1(sphingosine kinase 1,SPHK1)是调控细胞内鞘脂类分子代谢的关键限速酶,位于细胞质,它可以催化细胞内鞘脂类分子代谢,生成1-磷酸鞘氨醇(sphingosine1-phosphate,S1P)[3]。S1P可与细胞内的靶分子结合,还可以与相关转运体蛋白特异性结合运输至细胞外间隙,即肿瘤微环境,再与S1P受体(sphingosine1-phosphate receptors,S1PRs)特异性结合,以自分泌或旁分泌的形式促进细胞的活化、增殖和迁移,并抑制其凋亡[3-7]。国内外的研究表明,SPHK1在结直肠癌、膀胱癌、甲状腺癌等恶性实体肿瘤中高表达,其表达的增高意味着肿瘤恶性程度增高和患者预后不良。SPHK1基因参与肿瘤的多种恶性生物学行为,与肿瘤干细胞的形成有关,影响肿瘤耐药性[3-7]。关于SPHK1在上皮性卵巢癌的发生、发展、转移、耐药中作用方面的研究尚较少。NANOG是一个多能潜化因子,据报道,在一些肿瘤中,NANOG阳性的细胞具有很强大分化潜能、自我更新能力以及更强的化疗耐药性[8-12]。NANOG在一些肿瘤当中被认为是肿瘤干细胞标记物。本研究旨在通过体外实验,探讨SPHK1对上皮性卵巢癌细胞生物学行为改变的作用及其相关机制,通过本研究,可为临床工作中上皮性卵巢癌的早期诊断、耐药治疗、靶向治疗等提供新的依据。
1 材 料 与 方 法
1.1材料及主要试剂 SKOV3,人卵巢浆液性囊腺癌(购自中科院上海细胞库),选用10%FBS RPMI 1640培养基常规培养。BCA蛋白浓度测定试剂盒(Pierce公司,美国),Pierce ECL化学发光试剂盒(Thermo Fisher Scientific公司,美国),SYBRPremix Ex Taq Ⅱ(Takara公司),LipofectamineTM2000(Invitrogen公司,美国),Matrigel胶(BD公司,美国),SPHK1兔抗人单克隆抗体(武汉三鹰),NANOG兔抗人单克隆抗体(Abcam公司,美国),E-cadherin兔抗人单克隆抗体(Abcam公司,美国),β-actin 鼠抗人多克隆抗体(Servicebio公司,武汉)。引物由上海生工公司合成。
1.2方法
1.2.1细胞培养及siRNA转染 SKOV3细胞培养于RPMI-1640培养基中(含链霉素100 mg/L、青霉素100 U/mL和10% 胎牛血清),置于含5% CO2的培养箱中,37 ℃恒温培养。取对数生长期的贴壁生长细胞,常规0.25%胰蛋白酶+ 0.02% 乙二胺四乙酸消化后可传代,或收取细胞进行后续实验。
SPHK1 siRNA以及阴性对照siRNA(NC siRNA)购自上海吉玛公司,序列如下:SPHK1-siRNA,sense:5′-GUGCACCCAAACUACUUCU-TT-3′,antisense:5′-AGAAGUAGUUUGGGUGC-ACTT-3′。NC-siRNA,sense:5′-UUCUCCGAAC-GUGUCACGUTT-3′,antisense:5′-ACGUGACA-CGUUCGGAGAATT-3′。转染前24 h,制备单细胞悬液并计数,将细胞铺入六孔板中,使转染时细胞汇合度达到60%,第2天进行细胞转染。细胞分为阴性对照组(NC siRNA)、SPHK1 siRNA转染组。转染步骤参考lipofectamineTM 2000的试剂说明进行。转然后收集细胞用于后续的研究。
1.2.2CCK8(proliferation assay) 在siRNA转染SKOV3细胞24 h后,将SKOV3细胞分为2组: SPHK1 siRNA组、NC组。分别将2组细胞制成细胞悬液,并将细胞接种于96孔板中(单位剂量为3×103个/孔),设置3个复孔;分别培养24、48 h后,加入10 μL/孔的CCK试剂(终剂量为5 g/L),避光培养4 h,使用多功能酶标仪来检测450 nm波长处的各孔的吸亮度(optical density,OD)值。
1.2.3顺铂对SKOV3细胞的最大半数抑制浓度(IC50)测定 为了检测DDP对SKOV3细胞增殖的影响,再分别将SPHK1 siRNA组、NC组两组的对数生长期细胞消化制备成细胞悬液,按照3×103个/孔的单位剂量接种于96孔板,设置5个复孔。待细胞贴壁后,各组分别加入(0.8、1.5、2、3、4)mg/L的DDP作用24、48、72 h后,吸去培养液,更换为无血清培养基,加入10 μL/孔的CCK8试剂(终剂量为5 g/L),避光培养4 h。按上述方法再次计算SKOV3细胞在不同剂量DDP的作用下的存活率,应用SPSS20.0软件计算DDP的IC50值。
1.2.4平板克隆形成实验 细胞转染后24 h,1.5 mL胰蛋白酶消化,加入10%FBS完全培养基制作单细胞悬液。将NC siRNA组以及SPHK1 siRNA组细胞均匀接种于6孔板,每孔1 000个细胞,每组设定3个复孔。以上细胞放置于含5% CO2的细胞培养箱,37 ℃恒温培养14 d,每日观察细胞生长情况,间隔2~3 d细胞换液。终止培养后,甲醛2 mL固定细胞30 min,PBS清洗2遍后,加适量10% Giemsa染色15 min,空气干燥。细胞团中细胞数≥50个判定为克隆形成,通过光学显微镜观察和肉眼计数计算细胞克隆形成情况,依照公式(克隆形成率=克隆数/接种细胞数×100%)计算细胞克隆形成率。
1.2.5Western blot 根据测定的蛋白样品的实际浓度,计算不同组别样品的上样体积,加入5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,98 ℃水浴15 min后置于冰中。SDS-PAGE电泳分离上样蛋白质,在凝胶上铺PVDF膜,并放于两层滤纸之间,行印迹电泳(恒流200 mA,90 min)蛋白转膜。TBST漂洗PVDF膜(10 min),置于5%封闭液中37 ℃恒温2 h。弃封闭液,加1∶500一抗,4 ℃恒温过夜。TBST洗膜3次,加过氧化物酶标记的二抗1 mL,37 ℃恒温作用1.5 h,TBST洗膜10 min 3次。PVDF膜加入等体积的均匀混合的化学发光试剂A和B,作用1 min(暗室环境),Epson V300 Photo凝胶成像系统显色,AlphaEaseFC 4.0软件分析条带灰度,应用以下公式计算蛋白相对表达量:蛋白相对表达量=待检样品蛋白的灰度值/内参的灰度值。
1.2.6qRT-PCR检测 常规提取RNA,并采用分光亮度计测定其浓度及纯度,按照说明书步骤应用TAKARA 试剂盒进行逆转录为cDNA,按照takara试剂盒说明配置扩增体系。引物序列如下:SPHK1 forward,5′-GTGGTCGCCTTCCGCTTGG-3′,reverse,5′-GCTCCACGCAACCGCTGAC-3′;NANOG forward,5′-GCCTCCAGCAGATGCAA-GAACTC-3′,reverse,5′-CCAGGTCTGGTTGCT-CCACATTG-3′,MDR1 forward,5′-GATTGCT-CACCGCCTGTCCAC-3′,reverse,5′-CGTGCCA-TGCTCCTTGACTC-TG-3′,GADPH forward,5′-CAGGAGGCATTGCTGATGAT-3′,reverse,5′-GAAGGCTGGGGCTCATTT-3′。基因表达采用2-△△Ct公式计算。
1.3统计学方法 应用SPSS 20.0统计软件处理数据。计量资料比较采用t检验,应用Probit分析药物的IC50。P<0.05为差异有统计学意义。
2 结 果
2.1SPHK1基因转染效率鉴定 qRT-PCR结果显示,SKOV3细胞转染SPHK1 siRNA后,较对照组的mRNA下降约71%(P<0.05)。Western blot检测结果显示,SPHK1蛋白的表达在SPHK1 siRNA组较阴性对照组也出现明显下降(图1)。上述结果表明所用SPHK1 siRNA序列可以有效干扰SPHK1的表达,阴性序列对SPHK1蛋白表达无明显影响,因此应用可采用该SPHK1 siRNA及NC siRNA完成后续试验。
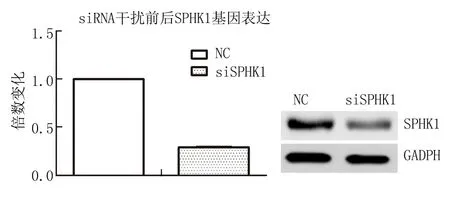
图1 siRNA干扰SKOV3细胞中SPHK1基因及蛋白表达
2.2SPHK1对卵巢癌细胞SKOV3增殖能力的影响 CCK8结果表明,在转染24 h时,SPHK1 siRNA组与NC组的OD值差异无统计学意义(P=0.953),而在48 h,SPHK1 siRNA组的增殖活力较对照组出现下降,差异有统计学意义(P=0.021)(图2)。
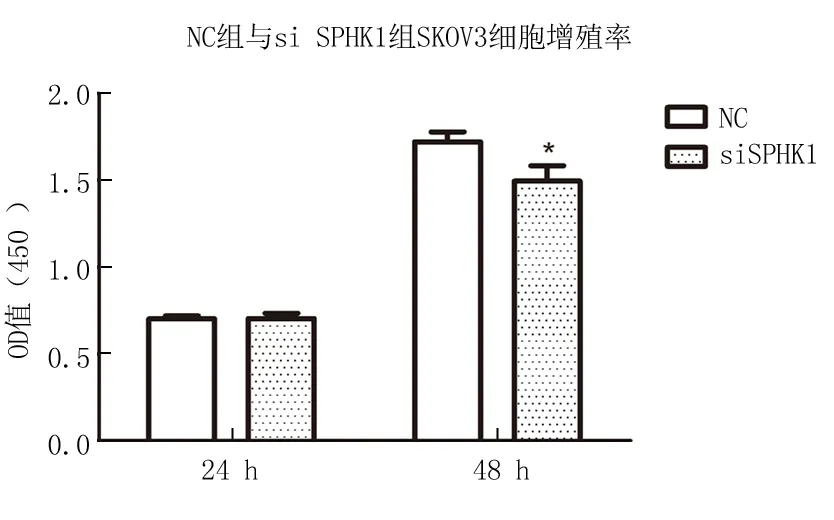
图2 SPHK1基因表达对SKOV3细胞增殖能力的影响
2.3SPHK1对顺铂敏感性影响 分别予以不同浓度(0.8、1.5、2、3、4) mg/L的顺铂作用于SKOV3细胞24、48、72 h。不同浓度顺铂作用于两组细胞后48 h,随顺铂浓度的增加,对于SKOV3细胞的生长抑制作用逐渐加强,随著作用时间的延长,同一浓度的顺铂对于细胞生长的抑制作用也逐渐加强,这表明顺铂对于SKOV3细胞的作用呈时间和浓度依赖性。在下调SPHK1基因表达后,顺铂作用24 h,对SKOV3细胞无明显抑制作用。在48 h及72 h,SKOV3细胞对同一时间点同一浓度的顺铂敏感性强于NC组,SPHK1 siRNA组细胞在顺铂作用48 h和72 h的IC50低于NC组[48 h:(2.53±0.119) mg/Lvs.(3.82±0.127) mg/L,P=0.007;72 h:(0.74±0.059) mg/Lvs.(1.55±0.050) mg/L,P=0.006],差异有统计学意义(P<0.05)(图3)。
2.4SPHK1对卵巢癌细胞克隆形成能力的影响 应用siRNA干扰SPHK1表达后,细胞克隆形成率出现下降,由(26.6±1.08)%降至(17.3±1.16)%,差异有统计学意义(图4)。这表明SPHK1基因下调会引起SKOV3细胞的克隆形成能力下降(P=0.019)。
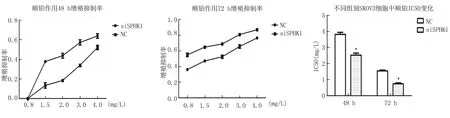
图3 SPHK1基因表达对SKOV3细胞铂耐药的影响
2.5SPHK1对相关分子表达的影响 应用siRNA干扰SPHK1表达后,通过qRT-PCR检测结果显示,干细胞相关因子NANOG表达下降约30%,(P=0.007)耐药相关因子MDR1表达下降约52%,差异均有统计学意义(P=0.014)。同时应用Western blot方法进行相应基因的蛋白表达情况发现NANOG(P=0.010)、MDR1(P=0.021)的表达随SPHK1基因的下调出现下降,这与mRNA的改变是一致的(图5)。这表明SPHK1基因的下调可引起干细胞相关因子NANOG及耐药相关因子MDR1的下降。
3 讨 论
上皮性卵巢癌的发病率虽不是女性生殖系统恶性肿瘤最高者,但其病死率却居女性生殖系统恶性肿瘤之首[13-14],最根本的原因是该类肿瘤具有发现晚,且易出现化疗耐药及复发等特点。研究表明,肿瘤的发生、发展、转移以及耐药是一个多种因素参与的复杂过程,这些过程中涉及多个信号通路及其相关因子[15]。鞘脂是调控细胞生物学功能中的一项重要的调控子,可以调节多种生物学如细胞凋亡、细胞增殖、细胞代谢等过程。S1P是鞘脂代谢的最终产物,同样可参与以上各种细胞过程的调节,S1P是一种信号分子,通过细胞内外机制发挥作用[16]。近年来的研究发现SPHK1在某些肿瘤中表达升高,并且参与肿瘤细胞的形成,但其在上皮性卵巢癌中的相关研究还不多见[17]。
肿瘤干细胞理论认为肿瘤由不同细胞亚群的细胞构成,其中的肿瘤干细胞指的是一小部分特殊类型的细胞亚群,它们具有无限自我更新能力、无限增资能力、多潜能分化能力、较高的致瘤性、对放化疗耐受能力强[18-19]。不同种类的肿瘤具有不同的干细胞标记物,目前的研究表明上皮性卵巢癌的干细胞标记物可包括CD44、CD133、ALDH、NANOG等。其中NANOG是一个多能潜化因子,其与肿瘤细胞的自我更新及放化疗耐药密切相关。
卵巢癌化疗一线方案是以铂类为基础的化疗方案[20],研究表明铂耐药是多因素、多水平、多基因参与的复杂过程,尽管对肿瘤的耐药机制的认识在不断加深,并且随着化疗的规范,对于药物的剂量以及应用方案的调整在随之不断进行,但是铂类药物耐药仍不少见[21],为临床卵巢癌治疗效果造成了负面作用。多药耐药性(multidrug resistance,MDR)是晚期上皮性卵巢癌化疗失败的主要原因之一。这种耐药性与分子活性和药物泵的表达、肿瘤细胞的异常pH、DNA损伤修复能力、药物排毒、凋亡途径以及许多基因的甲基化有关[22-24]。MDR可以降低肿瘤细胞中化疗药物的浓度,从而降低这些肿瘤细胞对药物的敏感性,在细胞发生耐药性后,能够对不同化学药物的各种结构无关的机制作出反应并表现出交叉耐药性,从而导致肿瘤细胞抵抗化疗药物。相关研究发现耐药基因MDR1在上皮性卵巢癌中的表达水平明显高于交界性腺瘤和良性腺瘤,MDR1基因产物P-糖蛋白(MDR1/P-gp)是引起肿瘤细胞发生多重耐药的主要机制之一[25]。MDR1/P-gp作为一种主动转运底物的外排泵,其过度表达可以导致化疗药物从肿瘤细胞中的外排增强,降低肿瘤细胞内有效化疗药物的浓度,从而使肿瘤细胞对化疗药物表现出抵抗性。本研究通过siRNA对上皮性卵巢癌细胞SKOV3中的SPHK1基因进行干扰,降低SPHK1基因的表达,对SKOV3细胞的一些细胞功能及相关因子的表达进行了测定。结果表明,SPHK1的降低会导致细胞增殖能力的下降,也会引起肿瘤细胞克隆形成能力的降低。应用CCK8进行细胞增殖能力试验,反应了细胞的群体增殖能力,而克隆形成实验,反应的则是独立细胞的自我更新及增殖能力。本研究还对下调SPHK1基因后上皮性卵巢癌的铂耐药性进行了检测,结果表明,SPHK1基因的下调会引起SKOV3细胞对铂类药物的敏感性增加。除此之外,对SPHK1基因下调后肿瘤干细胞标记物NANOG以及多重耐药基因MDR1基因及蛋白的表达情况进行了检测,试图初步探讨其内在机制。结果表明下调SPHK1基因的表达会引起肿瘤干细胞标记物NANOG以及多重耐药基因MDR1的表达降低。本研究结果表明,SPHK1基因对于上皮性卵巢癌的恶性生物学行为起到促进作用,其可能通过调节肿瘤干细胞的形成以及通过作用于多重耐药基因而实现的,SPHK1可能成为上皮性卵巢癌发展及铂耐药的一个预测因子,也可能作为上皮性卵巢癌治疗及铂耐药逆转的一个新的靶点。
本研究对SPHK1与卵巢癌细胞的增殖性、克隆形成能力及耐药性之间的关系及其内在可能存在的机制进行了初步的探讨,但是尚有许多不足之处,如:SPHK1基因与上皮性卵巢癌的侵袭性、迁移性等其他生物学行为的关系尚未进行探讨;SPHK1基因与肿瘤的关系有待更多的组织学研究以及体内实验研究;SPHK1基因是如何影响上皮性卵巢癌肿瘤干细胞形成的,尚需进一步探索。
