牛至精油微胶囊的制备及其在抗菌食品包装纸中的应用
2023-01-05潘高峰白亮亮李永辉宁语苹
潘高峰 宋 阳 白亮亮 李永辉 宁语苹
(1.牡丹江恒丰纸业股份有限公司,黑龙江牡丹江,157013;2.东北林业大学,黑龙江哈尔滨,150040)
随着社会的发展,食品行业对产品包装材料的选择越来越重视。由于塑料对人体健康存在潜在威胁,并且具有难降解、污染大等特点,近年来,国内外市场已逐步禁止塑料直接用于食品包装。2020 年1 月,国家发改委、生态环境部发布《关于进一步加强塑料污染治理的意见》,被称为“新限塑令”[1]。食品包装纸作为一种绿色环保的包装材料,成为了塑料等不可降解包装材料的最佳替代品。食品包装纸的主要作用是保护食品不受损坏,以及防止微生物滋生,延长食品的保存期。因此,食品包装纸的绿色可持续性和抑菌作用非常重要[2-3]。抗菌食品包装纸的应用给人们的生活带来了极大便利,能够减少食品因发霉而变质的情况发生[4]。
羟丙基-β-环糊精(HP-β-CD)是β-环糊精的醚化产物。通过在β-环糊精中引入羟丙基,使β-环糊精的分子内环状氢键被破坏,水溶性提高,同时维持了环糊精的空腔。HP-β-CD 具有包合能力强、刺激性小、安全性高等优点,是近年来发展较快的一种绿色包埋材料[5-6]。
牛至精油是从牛至植物的根、茎、叶中提取纯化得到的黄红色或棕红色精油,其主要成分是香芹酚和百里酚[7-8],具有广谱杀菌、生物降解和安全无毒等优点,对金黄色葡萄球菌、大肠杆菌等具有一定的抗菌和杀菌作用[9],但其沸点低、易挥发。因此,可以通过将其微胶囊化,提高稳定性,使其便于生产和应用[10]。
本研究以HP-β-CD为壁材,牛至精油为芯材,通过饱和水溶液法制备牛至精油-HP-β-CD微胶囊及微胶囊复合涂料,涂布制备具有抑菌性能的抗菌食品包装纸。
1 材料与方法
1.1 材料与试剂
HP-β-CD(质量分数97%,上海麦克林生物科技有限公司);牛至精油(质量分数98%,上海源叶生物科技有限公司);壳聚糖(脱乙酰度≥95%,上海麦克林生物科技有限公司);阳离子淀粉(牡丹江恒丰纸业有限公司);戊二醛(质量分数50%,天津市光复精细化工研究所);丙三醇(分析纯,天津市东丽区天大化学试剂厂)。
1.2 仪器与设备
数显恒速搅拌器(S-212型,上海申胜生物技术有限公司);电热恒温水浴锅(DK-98-I型,天津市泰斯特仪器有限公司);冷冻干燥机(SCIENTZ-12N型,宁波新芝生物科技股份有限公司);紫外可见分光光度计(UV-Vis,Carry100型,北京普析通用仪器有限公司);扫描电子显微镜(SEM,QUANTA200型,美国FEI公司),傅里叶变换红外光谱仪(FT-IR,Frontier 型,PerkinElmer 公司);热重分析仪(TG209F3 型,德国耐驰公司);涂布机(K303型,英国RK 公司);电热鼓风干燥箱(GZX-9146MBE型,上海博讯实业有限公司医疗设备厂);电热式压力蒸汽灭菌锅(XFH-40CA型,浙江新丰医疗器械有限公司);Boxum超净工作台(SW-CJ-2型,上海博迅医疗生物仪器股份有限公司)。
1.3 实验方法
1.3.1 牛至精油-HP-β-CD微胶囊的制备
将8 g HP-β-CD 加入至40 mL 蒸馏水中完全溶解,恒速搅拌下,逐滴加入牛至精油的无水乙醇溶液(体积比1∶1),并在一定温度下搅拌一段时间后置于4 ℃冰箱过夜,用少量的乙酸乙酯萃取未包合的牛至精油,样品冷冻干燥24 h,得到牛至精油-HP-β-CD 微胶囊(以下简称微胶囊)[11-12]。
1.3.2 包合率及产率
以无水乙醇为参比样,用UV-Vis 测试牛至精油的最大吸收波长为277 nm。
配制0.5~2.5 μL/mL 牛至精油的无水乙醇溶液,在波长277 nm 处测定牛至精油的吸光度值,得到标准曲线方程为Y=1.341X+0.0101(R2=0.9997)[13-14]。
取0.1 g 微胶囊于30 mL 离心管中,加入10 mL 无水乙醇,超声震荡20 min,静置12 h后,以2500 r/min的速度离心15 min,取1 mL上清液置于25 mL容量瓶中,使用无水乙醇定容,在277 nm 处测定吸光度值,通过标准曲线方程计算得到微胶囊中牛至精油的含量。通过式(1)和式(2)计算包合率及产率[15]。

式中,A表示微胶囊中牛至精油的含量,g;m表示微胶囊的质量,g;B表示HP-β-CD 的添加量,g;M表示牛至精油的添加量,g。
1.3.3 正交实验
选取芯壁比、包合时间、包合温度作为包合条件的主要因素及确定水平范围,以包合率为指标,进行3 因素4 水平正交实验,因素和水平如表1 所示,探讨最佳制备工艺。

表1 正交实验因素水平表Table 1 Orthogonal experiment factor level table
1.4 抗菌食品包装纸的制备
1.4.1 微胶囊复合涂料的制备
向50 mL 质量分数1%乙酸溶液中加入0.5 g 壳聚糖,使其充分溶解,得到壳聚糖溶液;将10 g阳离子淀粉于100 mL热水中糊化,制备淀粉胶黏剂;将壳聚糖溶液和淀粉胶黏剂按体积比1∶2均匀混合,作为涂料胶黏剂。向涂料胶黏剂中加入少量甘油,于50 ℃下均匀搅拌,加入9 g 最优条件下制备的微胶囊,以500 r/min 搅拌20 min,得到具有抗菌性能的微胶囊复合涂料[16]。
1.4.2 抗菌食品包装纸的制备
采用线棒涂布机以3 m/min的速度将涂料均匀地涂布在原纸表面,80 ℃下干燥,制得抗菌食品包装纸。原纸定量52 g/m2,涂布量2.77 g/m2。采用相同实验方法,采用不添加微胶囊的涂料制备的纸张命名为涂布纸。
1.5 微胶囊缓释性能
称量一定质量的微胶囊,采用紫外分光光度法,按式(3)计算微胶囊中牛至精油的保留率(Y)。

式中,v0表示微胶囊中牛至精油的初始含量,g/L;vt表示缓释t时间后微胶囊中牛至精油的含量,g/L。
1.5.1 不同温度下微胶囊的缓释性能
将盛有一定质量微胶囊的称量瓶置于干燥器中,控制环境相对湿度为33%,然后将干燥器分别放在恒温5、26、45 ℃环境中,每12 h 对干燥器进行1 次换气,以排放缓释出的牛至精油,在缓释第5、10、15、20、30、40、50、60、70 天测量微胶囊中牛至精油的保留率。
1.5.2 不同湿度下微胶囊的缓释性能
将盛有一定质量微胶囊的干燥器置于26 ℃控温培养箱中,控制环境达到不同的相对湿度(33%、52%、71%),采用与1.5.1 相同的表征方法和缓释时间测量微胶囊中牛至精油的保留率。
1.5.3 不同储存条件下微胶囊的缓释性能
将盛有一定质量微胶囊的干燥器置于26 ℃、相对湿度33%条件下,采用与1.5.1 相同的表征方法,缓释第5、10、15、20、30、40、50、60、70、80、90和100天测量微胶囊中牛至精油的保留率。
1.5.4 高温下微胶囊牛至精油的保留率
将盛有一定质量微胶囊的称量瓶置于100 ℃的不同烘箱中,分别称量缓释第0、10、20、30、40、50、60、70 min时的质量,由式(4)计算微胶囊中牛至精油的保留率(Y’)。

式中,m0表示样品初始质量,g;mt表示缓释t时间后样品质量,g。
1.6 抑菌实验
1.6.1 微胶囊最小抑菌浓度(MIC)与最小杀菌浓度(MBC)
参照GB/T 21510—2008测试微胶囊的MIC。首先配制14.0、7.0、3.5、1.8、0.9、0.4 和0.2 g/L 微胶囊悬浮液,与营养肉汤的液体培养基按体积比1∶1 混合,然后取0.1 mL 含菌量约105CFU/mL 菌悬液,接种于含有微胶囊的液体培养基试管中,将其作为实验组;加入无菌水和菌液的培养基为对照组;将实验组与对照组置于37 ℃培养箱中,1000 r/min 条件下震荡培养24 h,肉眼观察试管中细菌的生长情况,即观察液体是否浑浊,未出现浑浊的微胶囊悬浮液最低浓度为MIC[17-18]。取100 μL 微胶囊悬浮液转移到营养琼脂的固体培养基上,37 ℃下培养24 h 后,观察菌落生长情况,导致99.9%以上细菌死亡的微胶囊悬浮液最低浓度为MBC[19]。
1.6.2 抑菌圈
参照GB/T 39101—2020及相关文献[20],在无菌条件下,用营养琼脂配制保存菌种的斜面,将金黄色葡萄球菌、大肠杆菌在斜面培养基上进行活化,用生理盐水配制成104CFU/mL 左右的菌悬液,震荡摇匀。取200 μL 菌悬液均匀涂布在倒好营养琼脂的培养皿上。以原纸为对照组,涂布纸和抗菌食品包装纸为实验组,每组做3 个平行样,将实验组与对照组进行2 h 的紫外灭菌后,贴在含菌平板的中央,37 ℃培养箱中培养24 h后,测量抑菌圈直径大小。
2 结果与分析
2.1 正交实验
进行正交实验以分析各因素相互间的影响和优化最佳包合条件,结果如表2 所示。由表2 极差分析可知,各因素对包合率影响顺序是B>C>A,即包合时间>包合温度>芯壁比。获得微胶囊的最佳制备工艺为B3C2A3,即包合时间3 h、包合温度50 ℃、芯壁比1∶8。在此工艺条件下制备微胶囊,进行再次验证,微胶囊的包合率达83.69%。

表2 正交实验结果Table 2 Results of orthogonal experimental test
2.2 微胶囊的表征与分析
2.2.1 形貌表征
对HP-β-CD 及微胶囊进行显微镜及SEM 观察,如图1 所示。由图1(a)~图1(c)可知,包合前HP-β-CD为球状,中空球体较大且尺寸不均匀(直径30~140 μm,多分布在60~80 μm),有较大的内腔,壁厚,球壁具有发达的孔隙。HP-β-CD 固体粉末溶于水后,以7个葡萄糖单元的小分子结构分散在水溶液中。由图1(d)可知,包合芯材后的微胶囊,形态近似球体,失去了原有的表面光滑结构,体积变小,直径10 μm以内。

图1 HP-β-CD及微胶囊的显微镜和SEM图Fig.1 Microscope and SEM images of HP-β-CD and microcapsules
2.2.2 傅里叶变换红外光谱分析
图2 为微胶囊、HP-β-CD 和牛至精油在波数500~4000 cm-1范围内的FT-IR谱图。牛至精油的特征峰主要为3314 cm-1处的O—H键伸缩振动吸收峰,2964 cm-1处的C—H 键伸缩振动吸收峰,1591 cm-1处烯烃C==C 和1421 cm-1处的芳香族C==C[21]。HP-β-CD在3345 cm-1处出现O—H 键伸缩振动吸收峰,2920 cm-1处出现C—H 键伸缩振动吸收峰,1151 cm-1、1079 cm-1、1020 cm-1处出现C—O 键伸缩振动吸收峰。微胶囊的FT-IR 谱图中,HP-β-CD和牛至精油的吸收峰均发生了变化,O—H键伸缩振动吸收峰从3345 cm-1移动到3337 cm-1,C—H键伸缩振动吸收峰从2920 cm-1移动到2924 cm-1,C—O键伸缩振动吸收峰从1020 cm-1移动到1023 cm-1。由于在微胶囊中牛至精油的特征峰受到了一定的遮蔽,微胶囊主要呈现HP-β-CD的FT-IR特征峰。以上分析表明,牛至精油成功被HP-β-CD包合。
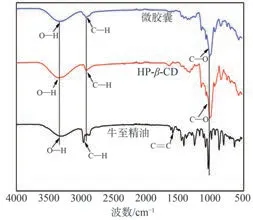
图2 微胶囊、HP-β-CD和牛至精油FT-IR谱图Fig.2 FT-IR spectra of microcapsules,HP-β-CD and oregano essential oil
2.2.3 热稳定性分析
图3 为微胶囊和HP-β-CD 的热重分析曲线。由图3 可知,微胶囊和HP-β-CD 的热质量损失主要分为4 个阶段:①30~100 ℃之间,微胶囊和HP-β-CD均发生不同程度的热质量损失,主要是样品中水分蒸发;②100~300 ℃之间,HP-β-CD 的质量损失较小,微胶囊的质量损失较明显,主要是所包合的牛至精油随着温度的升高而挥发;③300~350 ℃之间,主要是HP-β-CD 分子的共价键遭到破坏,聚合物分子链部分断裂,HP-β-CD 分子开始热降解,造成大量的质量损失;④350~600 ℃之间,HP-β-CD 继续热降解,由于其结构疏松,热降解比较彻底,残留质量非常少;而微胶囊由于芯材组成和结构复杂,高温下焦化程度不同,或与壁材有热反应,使其残余量较单纯壁材增多。热质量损失的过程说明HP-β-CD 对牛至精油具有很好的保护作用,尤其100 ℃内,对防止其挥发非常有效,形成微胶囊后牛至精油的稳定性得到了提高。

图3 微胶囊、HP-β-CD热重分析图Fig.3 Thermogravimetric analysis of microcapsules and HP-β-CD
2.3 牛至精油微胶囊的缓释性能
2.3.1 温度对微胶囊缓释性能的影响
图4(a)为温度5 ℃、26 ℃、45 ℃下,微胶囊中牛至精油的保留率随时间变化的趋势。由图4(a)可以看出,温度对微胶囊中牛至精油的释放具有一定的影响。微胶囊在温度5 ℃、26 ℃和45 ℃条件下,缓释70天后,微胶囊中牛至精油的保留率分别为82.04%、79.37%和77.01%。由上述结果可知,温度影响分子的布朗运动,温度越高,分子的布朗运动越剧烈,加快了牛至精油从微胶囊逸出的速度。温度越高,对HP-β-CD 的破坏越大,加快微胶囊中牛至精油的释放,使其保留率降低。因此微胶囊应保存在较低温度环境中。

图4 不同因素对微胶囊保留率的影响Fig.4 Effect of different factors on the retention of microcapsules
2.3.2 相对湿度对微胶囊缓释性能的影响
图4(b)相对湿度为33%、52%、71%的条件下,微胶囊中牛至精油的保留率随时间变化的趋势。由图4(b)可以看出,相对湿度对微胶囊中牛至精油的释放影响较大。微胶囊在相对湿度33%、52%和71%条件下,缓释70 天后,微胶囊中牛至精油的保留率分别为79.37%、75.67%和72.48%。由上述结果可知,相对湿度越大,微胶囊中牛至精油的保留率越小。这是由于HP-β-CD具有一定的吸湿性,易吸水膨胀,减少了对微胶囊中牛至精油的保护,导致微胶囊中牛至精油的保留率逐渐降低。因此微胶囊应保存在干燥环境中。
2.3.3 储存时间对微胶囊缓释性能的影响
图4(c)为温度26 ℃、相对湿度33%条件下微胶囊中牛至精油随时间释放的保留率曲线。由图4(c)可以看出,随着缓释时间的延长,微胶囊中牛至精油的保留率逐渐降低。微胶囊中牛至精油在缓释0~20 天时释放速率较快,这可能是HP-β-CD表面少量的牛至精油快速挥发;缓释20 天后,微胶囊中牛至精油挥发较慢,缓释效果较好;缓释100天后,微胶囊中牛至精油的保留率为72.14%。因此微胶囊化对于牛至精油的保存极为有利,可以抑制牛至精油的挥发,起到了缓释的效果和作用。
2.3.4 微胶囊高温稳定性
图4(d)为100 ℃下牛至精油和微胶囊的保留率曲线。由图4(d)可以看出,在高温条件下,牛至精油的挥发速率与时间几近线性增加,前40 min微胶囊中牛至精油的挥发速率较快,可能是壁材表面的牛至精油挥发所致,40 min后微胶囊中牛至精油的挥发速率趋于平缓和稳定。70 min 时,牛至精油的保留率达4.33%,微胶囊中牛至精油的保留率41.52%。因此,微胶囊化对牛至精油具有显著的缓释和保护作用,并提高了牛至精油的热稳定性。
2.4 抑菌性能分析
2.4.1 微胶囊抗菌活性
微胶囊对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度实验结果如图5 所示。从图5 可以看出,微胶囊对金黄色葡萄球菌的最小抑菌浓度为3.5 g/L,最小杀菌浓度为3.5 g/L;对大肠杆菌的最小抑菌浓度为7.0 g/L,最小杀菌浓度为7.0 g/L。微胶囊对金黄色葡萄球菌和大肠杆菌均具有良好的抑菌效果。

图5 最小抑菌浓度Fig.5 Minimum inhibitory concentration
2.4.2 抑菌圈
抑菌圈的直径大小从一定程度上代表抑菌能力,本研究制备材料的抑菌圈实验结果如图6所示。由图6 可知,制备的抗菌食品包装纸对金黄色葡萄球的抑菌圈为3 mm,对大肠杆菌的抑菌圈为2 mm,原纸对金黄色葡萄球菌和大肠杆菌均未出现明显的抑菌圈,可能是由于涂布配方中壳聚糖的加入量较少的原因。本研究制备的抗菌食品包装纸对2种目标菌均有较好的抑制作用,对金黄色葡萄球菌效果更好。

图6 纸张对金黄色葡萄球菌和大肠杆菌的抑菌圈Fig.6 Bacterial inhibition circles of paper against S.aureus and E.coli.
3 结论
本研究以羟丙基-β-环糊精(HP-β-CD)为壁材,牛至精油为芯材,通过饱和水溶液法制备牛至精油-HP-β-CD 微胶囊,与涂料复合涂布制备抗菌食品包装纸。探究了微胶囊制备的最佳工艺条件,以及制备的微胶囊和抗菌食品包装纸对金黄色葡萄球菌和大肠杆菌的抑菌性能。
3.1 牛至精油-HP-β-CD 微胶囊的最佳制备条件为芯壁比1∶8、包合温度50 ℃、包合时间3 h,此条件下制备的微胶囊达到最大包合率,为83.69%。
3.2 微胶囊具有良好的缓释性能和高温稳定性,在相对湿度33%、温度26 ℃下,缓释70 天后微胶囊中牛至精油的保留率为79.37%;储存100 天后微胶囊中牛至精油的保留率为72.14%。牛至精油微胶囊化具有显著的缓释作用和效果。
3.3 微胶囊对金黄色葡萄球菌和大肠杆菌均具有一定的抑制作用,对金黄色葡萄球菌的最小抑菌浓度为3.5 g/L,最小杀菌浓度为3.5 g/L;对大肠杆菌的最小抑菌浓度为7 g/L,最小杀菌浓度为7 g/L。制备的抗菌涂布纸对金黄色葡萄球菌和大肠杆菌的抑菌圈分别是3 mm和2 mm,具备良好的抑菌效果。
