阿昔莫司对脂多糖诱导脓毒症大鼠心肌损伤及Nrf2/HO-1 信号通路的影响
2023-01-03黄泓轲罗健玮冉华
黄泓轲,罗健玮,冉华
心脏是脓毒症最主要的受累器官,有超过70%的脓毒症动物发生心功能障碍,并导致死亡[1-2]。研究认为,脓毒症心肌损伤的发病机制涉及心肌细胞凋亡、自主神经失调、能量代谢及心肌抑制因子等多种因素[3]。革兰氏阴性菌细胞壁中的脂多糖可作脓毒症的主要致病因素,引起全身炎症反应,造成机体多组织、多器官继发性损伤[4]。目前研究发现,脂多糖刺激机体组织后,组织供能失衡引起脂质代谢紊乱、脂质毒性物质释放及积累,可激活氧化应激及炎症反应途径,加剧心肌组织细胞损伤及凋亡[5]。研究发现,阿昔莫司联合瑞舒伐他汀可改善心肌酶谱[6]。研究证实,阿昔莫司发挥抗炎、抗氧化应激、抗凋亡的重要通路核因子E2 相关因子2(Nrf2)/血红素加氧酶-1(HO-1),参与心肌组织细胞损伤后修复过程[7]。但阿昔莫司能否改善脓毒症心肌损伤及相关作用机制还未见明确报道。基于此,本研究应用脂多糖诱导建立了大鼠脓毒症模型,初步探究阿昔莫司对脓毒症大鼠心肌损伤的影响及Nrf2/HO-1 通路在此过程中扮演的角色,以期为阿昔莫司在脓毒症领域的治疗应用提供实验依据。
1 材料与方法
1.1 实验动物
50只SD大鼠,雌雄不限,清洁级,体重200~220 g,6~8 周龄,购自四川省人民医院实验动物研究所。本实验经本院动物伦理委员会批准[批准号:IACUC-01(20200102)],严格遵循3R 原则。
1.2 主要试剂及仪器
阿昔莫司(规格100 mg)购自上海乔羽生物科技有限公司;脂多糖(来源于大肠杆菌 0111:B4)、Nrf2通路抑制剂全反式维甲酸(ATRA)(HPLC ≥98%)购自美国Sigma 公司;肌酸激酶(CK)、乳酸脱氢酶(LDH)、心肌肌钙蛋白Ⅰ(cTnⅠ)ELISA 试剂盒分别购自无锡云萃生物科技有限公司、上海研生实业有限公司与上海赛可锐生物科技有限公司;总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、游离脂肪酸(FFA)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)ELISA 试剂盒均购自江西艾博因生物科技有限公司;丙二醛(MDA)、活性氧簇(ROS)ELISA 试剂盒分别购自上海冠导生物工程有限公司和上海圻明生物科技有限公司;Nrf2、HO-1、核因子-κB(NF-κB)、磷酸化NF-κB(p-NF-κB)、脂蛋白脂肪酶(LPL)、超氧化物歧化酶2(SOD2)、过氧化氢酶(CAT)、A 类清道夫受体(SR-A)、过氧化物酶体增殖物激活受体α(PPARα)等兔抗大鼠抗体均购自美国Abcam 公司;DM2500 荧光显微镜购自德国徕卡。
1.3 大鼠脓毒症模型建立及分组给药
取40 只大鼠,参照文献[8]经大鼠腹腔注射脂多糖5 mg/kg 建立脓毒症模型,造模成功大鼠随机分为模型组、阿昔莫司组、ATRA 组、阿昔莫司+ATRA 组,每组10 只。另取10 只大鼠,腹腔注射等量生理盐水,作为正常对照组。
各组大鼠均于脂多糖注射6 h 后,开始给药(记为给药第0 天),阿昔莫司组参照文献[9]灌胃给予32 mg/kg 阿昔莫司;ATRA 组腹腔注射给予ATRA(0.2 mg/kg,给药3 d)[10];阿昔莫司+ATRA 组灌胃给予阿昔莫司的同时,腹腔注射ATRA,阿昔莫司与ATRA 剂量同前;模型组及正常对照组灌胃并腹腔注射给予等量生理盐水。连续给药3 d 后,统计大鼠成活只数,并同时取血和获取心肌组织。
1.4 ELISA 法检测大鼠血清心肌损伤标志物及血脂水平变化
取各组大鼠腹主动脉血6 ml,血液生化分析仪检测心肌损伤标志物CK、LDH、cTnI 水平;按ELISA 法测血脂相关指标TC、HDL-C、LDL-C、TG、FFA 水平。
1.5 ELISA 法检测大鼠心肌组织氧化应激及炎症因子水平
大鼠处死,摘取心肌组织剪碎后匀浆,匀浆液ELISA 法测心肌组织中氧化应激产物MDA、ROS 水平及炎症因子IL-6、TNF-α 水平,剩余心肌组织,一部分置于-80 ℃冰箱保存备用;另一部分置于多聚甲醛中固定,制成石蜡切片,备用。
1.6 苏木素-伊红(HE)染色及TUNEL 染色法测心肌组织损伤及心肌细胞凋亡情况
取已制备石蜡切片,进行染色封片后置于光镜下观察拍照。用Image-Pro Plus 6 软件系统测TUNEL 染色切片中单位面积内被染成红棕色的凋亡细胞数目,细胞凋亡率(%)=凋亡细胞数目/总细胞数目×100%,统计分析细胞凋亡情况。
1.7 免疫荧光染色法检测心肌组织的细胞核中Nrf2阳性表达水平
取已制备石蜡切片,脱蜡、水化、透化及抗原修复后,加入一抗,4 ℃孵育过夜后,加入二抗孵育2 h,4',6-二脒基-2-苯基吲哚(DAPI)核染后,Image-Pro Plus 5.0 图像分析系统分析单位面积内Nrf2 在细胞核中阳性染色的平均光密度值。
1.8 蛋白免疫印迹法检测细胞HO-1、NF-κB、p-NF-κB、SOD2、CAT、LPL、PPARα、SR-A 蛋白表达
取冰箱中保存的心肌组织,裂解、匀浆,轴提胞浆蛋白及核蛋白,BCA 法测蛋白浓度,取50 μg蛋白行电泳、转膜反应,加入一抗,内参β-肌动蛋白(β-actin),4 ℃孵育过夜,辣根过氧化物酶二抗(1:800)室温孵育1 h,增强化学发光法显影曝光,化学发光成像仪拍照,Image J 分析系统进行半定量分析。
1.9 统计学方法
采用GraphPad Prism 8 及SPSS 24.0 进行统计分析。数据用均数±标准差表示,多组间比较及进一步两两比较分别用单因素方差分析及SNK-q 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般行为
正常对照组大鼠无死亡,饮食、活动及精神状态正常。模型组大鼠死亡2 只,饮食及活动量减少,呼吸加快、竖毛、精神萎靡、稀水样排便行为增加。阿昔莫司组大鼠无死亡,饮食及活动量有所增加,大部分呼吸较为平缓,竖毛、精神萎靡症状缓解,粪便较为浓稠。ATRA 组死亡4 只,饮食及活动量进一步减少,精神萎靡及稀水样排便症状进一步加重。阿昔莫司+ATRA 组死亡2 只,饮食、活动量、精神萎靡、竖毛、呼吸加快、稀水样排便症状重于阿昔莫司组,但轻于ATRA 组,并与模型组相近。
2.2 各组大鼠心肌损伤标志物、血脂指标、氧化应激产物及炎症因子的比较
与正常对照组相比,模型组大鼠血清CK、LDH、cTnI 水平升高,TC、HDL-C、LDL-C 水平降低,TG、FFA 水平升高,MDA、ROS、IL-6、TNF-α水平升高,P均<0.05。与模型组相比,阿昔莫司组大鼠血清CK、LDH、cTnI 水平降低,TC、HDL-C、LDL-C 水平升高,MDA、ROS、IL-6、TNF-α 水平降低,P均<0.05;ATRA 组大鼠血清CK、LDH、cTnI 水平升高,TC、HDL-C、LDL-C 水平进一步降低,MDA、ROS、IL-6、TNF-α 水平进一步升高,P均<0.05。与阿昔莫司组相比,ATRA 组、阿昔莫司+ATRA 组血清CK、LDH、cTnI 水平升高,TC、HDL-C、LDL-C 水平降低,MDA、ROS、IL-6、TNF-α 水平升高,P均<0.05。与ATRA 组相比,阿昔莫司+ATRA 组血清CK、LDH、cTnI 水平降低,而TC、HDL-C、LDL-C 水平升高,MDA、ROS、IL-6、TNF-α 水平降低,P均<0.05,见表1。
表1 各组大鼠心肌损伤标志物、血脂指标、氧化应激产物及炎症因子水平及Nrf2 下游抗氧化、抗炎、脂质代谢相关通路蛋白表达的比较()
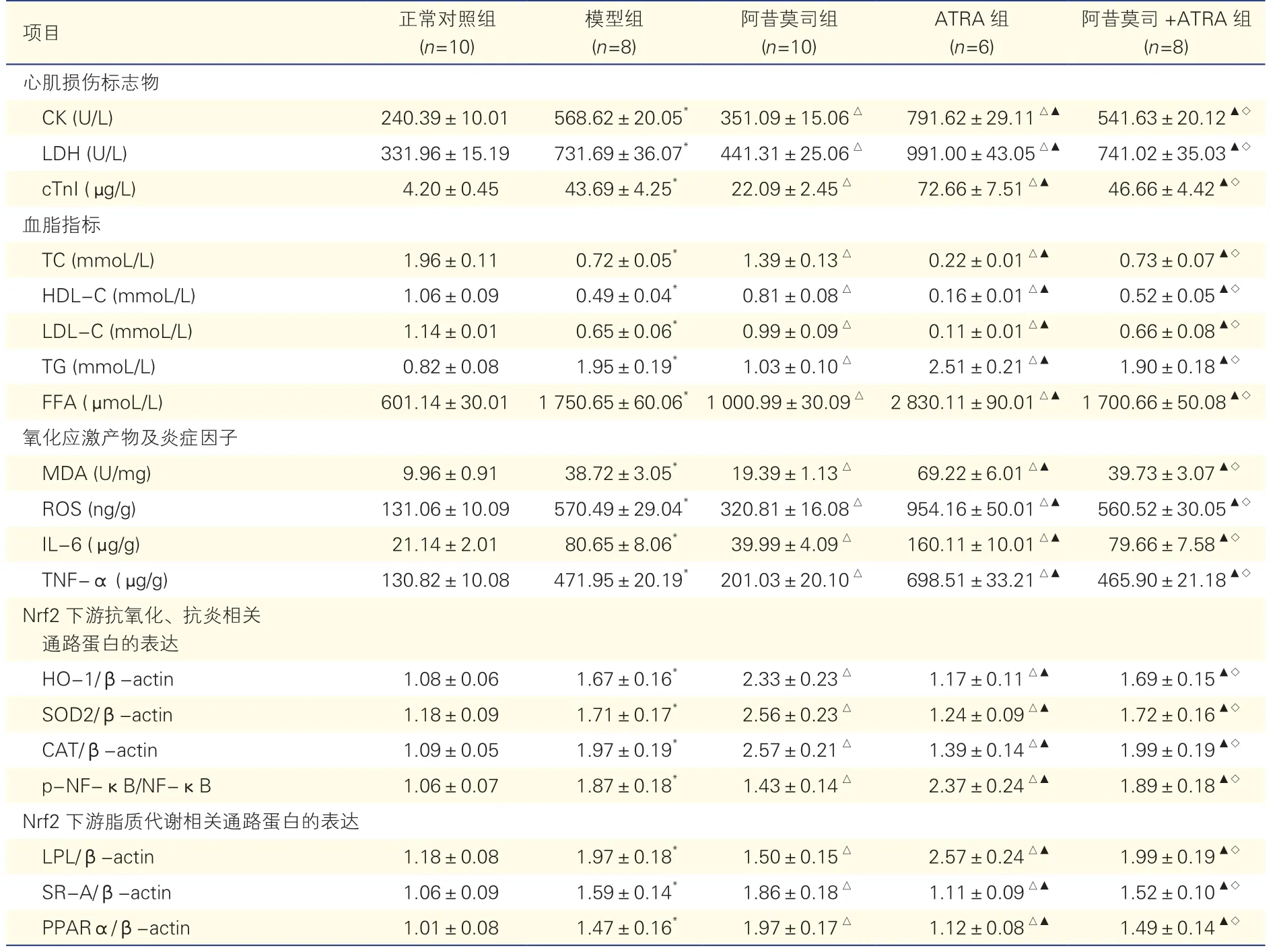
表1 各组大鼠心肌损伤标志物、血脂指标、氧化应激产物及炎症因子水平及Nrf2 下游抗氧化、抗炎、脂质代谢相关通路蛋白表达的比较()
注:Nrf2:核因子E2 相关因子2;ATRA:全反式维甲酸;CK:肌酸激酶;LDH:乳酸脱氢酶;cTnI:心肌肌钙蛋白I;TC:总胆固醇;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;TG:甘油三酯;FFA:游离脂肪酸;MDA:丙二醛;ROS:活性氧簇;IL-6:白细胞介素-6;TNF-α:肿瘤坏死因子-α;HO-1:血红素加氧酶-1;SOD2:超氧化物歧化酶2;CAT:过氧化氢酶;p-NF-κB:磷酸化NF-κB;NF-κB:核因子-κB;β-actin:β-肌动蛋白;LPL:脂蛋白脂肪酶;SR-A:A 类清道夫受体;PPARα:过氧化物酶体增殖物激活受体α。与正常对照组比*P<0.05,与模型组比△P<0.05,与阿昔莫司组比▲P<0.05,与ATRA 组比◇P<0.05
2.3 各组大鼠心肌损伤及心肌细胞凋亡情况(图1)

图1 各组大鼠心肌组织苏木素-伊红染色及TUNEL 染色图(×400)
HE 染色可见,正常对照组大鼠心肌组织细胞排列整齐,横纹清晰,结构正常;模型组大鼠可见心肌纤维断裂、间隔增宽、红细胞渗出明显。TUNEL 染色可见,正常对照组大鼠心肌细胞仅有少量被染成红棕色,细胞凋亡较少;模型组大鼠可见细胞红棕色染色加深,细胞凋亡增加。
与正常对照组相比,模型组大鼠心肌纤维断裂、炎性细胞浸润等病理损伤加重,心肌细胞凋亡率升高[(0.20±0.00)% vs.(1.69±0.25)%,P<0.05]。与模型组相比,阿昔莫司组上述病理损伤缓解,心肌细胞凋亡率降低[(1.69±0.25)% vs.(1.09±0.45)%,P<0.05];ATRA 组心肌损伤进一步加重,心肌细胞凋亡率进一步升高[(1.69±0.25)%vs.(2.66±0.51)%,P<0.05]。与阿昔莫司组相比,ATRA 组[(1.09±0.45)% vs.(2.66±0.51)%]、阿昔莫司+ATRA 组[(1.09±0.45)% vs.(1.66±0.42)%]心肌细胞凋亡率升高(P均<0.05),心肌损伤加重。与ATRA 组相比,阿昔莫司+ATRA 组心肌损伤减轻,心肌细胞凋亡率降低[(2.66±0.51)% vs.(1.66±0.42)%,P<0.05]。
2.4 各组大鼠心肌组织的细胞核中Nrf2 表达(图2)

图2 各组大鼠心肌组织细胞Nrf2 免疫荧光染色图(×400)
免疫荧光染色可见,Nrf2 在正常对照组大鼠心肌组织的细胞核中呈弱阳性表达,在模型组呈强阳性表达且高于正常对照组[(1.02±0.10)mm2vs.(0.26±0.01)mm2],在阿昔莫司组阳性表达进一步升高且高于模型组[(1.89±0.18)mm2vs.(1.02±0.10)mm2],在ATRA 组阳性表达减弱并低于模型组[(0.42±0.04)mm2vs.(1.02±0.10)mm2]与阿昔莫司组[(0.42±0.04)mm2vs.(1.89±0.18)mm2],在阿昔莫司+ATRA 组阳性表达也减弱且低于阿昔莫司组[(1.03±0.09)mm2vs.(1.89±0.18)mm2],P均<0.05。
2.5 各组大鼠心肌组织Nrf2 下游抗氧化、抗炎相关通路及脂质代谢相关通路相关蛋白的表达(图3~4、表1)

图3 各组大鼠心肌组织HO-1、SOD2、CAT、p-NF-κB、NF-κB 蛋白表达免疫印迹图
与正常对照组相比,模型组大鼠心肌组织HO-1、SOD2、CAT、p-NF-κB/NF-κB 及LPL、SR-A、PPARα 的蛋白表达均升高(P均<0.05)。与模型组相比,阿昔莫司组大鼠心肌组织中HO-1、SOD2、CAT 及SR-A、PPARα 的蛋白表达进一步升高(P均<0.05),p-NF-κB/NF-κB、LPL 的蛋白表达降低(P均<0.05);ATRA 组大鼠心肌组织中HO-1、SOD2、CAT 及SR-A、PPARα 的蛋白表达降低(P均<0.05),p-NF-κB/NF-κB、LPL的蛋白表达升高(P均<0.05)。与阿昔莫司组相比,ATRA 组、阿昔莫司+ATRA 组大鼠心肌组织中HO-1、SOD2、CAT 及SR-A、PPARα 的蛋白表达降低(P均<0.05),p-NF-κB/NF-κB、LPL 的蛋白表达升高(P均<0.05)。与ATRA 组相比,阿昔莫司+ATRA 组大鼠心肌组织中HO-1、SOD2、CAT 及SR-A、PPARα 的蛋白表达升高(P均<0.05),p-NF-κB/NF-κB、LPL 的蛋白表达降低(P均<0.05)。

图4 各组大鼠心肌组织LPL、SR-A、PPARα 蛋白表达免疫印迹图
3 讨论
研究证实,脂多糖刺激后,心肌组织发生氧化应激及炎症反应是脓毒症的主要病理机制[11-13]。Wang 等[14]及李波等[15]通过体内外实验研究发现,脂多糖可诱导心肌细胞还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶系统激活,并促进ROS 在心肌细胞内释放及积聚。本研究发现,模型大鼠心肌组织中发生氧化应激、炎性反应及细胞凋亡现象。Wang等[16]认为血脂水平的改变是引起脓毒症全身炎症反应增加的潜在因素;许青宗等[17]认为胆固醇下降可引起炎性反应失控及组织损伤加重,进而加剧脓毒症病情恶化进程。LPL 能够水解细胞外TG释放出FFA,使胞内FFA 增加,而加剧心肌损伤。本研究结果提示脓毒症心肌损伤大鼠出现脂质代谢紊乱现象。
鉴于脓毒症心肌损伤大鼠存在脂质代谢紊乱现象,推测阿昔莫司可能通过改善脂质水平,缓解脓毒症大鼠心肌损伤。本研究发现,模型大鼠阿昔莫司干预治疗后,心肌损伤及心肌细胞凋亡缓解,心肌组织氧化应激产物及炎症因子释放减少,证实阿昔莫司或可用于脓毒症心肌氧化应激、炎症、血脂水平异常的治疗。
细菌、ROS 及炎症因子等应激刺激条件下,均可促进Nrf2 与Kelch 样环氧氯丙烷相关蛋白Keap1解离并活化转录入核,启动下游HO-1 转录,诱导CAT、SOD2 等抗氧化物酶活性增加,而清除ROS积累并发挥抗氧化作用[18]。另外,NF-κB 通路中NF-κB 磷酸化入核活化与炎症的发生密切相关,其可促进炎症发展,同时引起机体氧化应激异常,而机体对炎症和氧化应激的调节可通过Nrf2 通路活化实现,活化的Nrf2 可促进抗氧化酶HO-1 表达,而HO-1 参与调控促炎因子产生,HO-1 表达增加可阻断NF-κB 磷酸化活化,从而发挥抗炎、抗氧化应激作用,抑制细胞损伤和凋亡[19-20]。Tao 等[21]及Li 等[22]发现,Nrf2/HO-1 通路活化缓解肝组织氧化应激损伤的同时,还能上调脂肪酸激活的转录因子PPARα,启动脂肪酸代谢相关基因SR-A 表达来抑制脂肪酸及TG 等引起的脂质堆积,维持脂质代谢稳态,发挥组织保护作用,预示Nrf2/HO-1 通路激活,也可改善组织脂质代谢异常,发挥抗组织损伤作用。本研究表明,脂多糖可能通过调控Nrf2/HO-1/NF-κB 通路诱导心肌组织氧化应激、炎症反应和脂质代谢异常,而此时Nrf2、HO-1、SOD2、CAT、SR-A、PPARα 表达增加可能是体内应对氧化应激、炎症和脂质代谢异常刺激的一种代偿反应。进一步分析发现,阿昔莫司作用于脓毒症大鼠后,心肌组织中Nrf2/HO-1 通路进一步活化,提示阿昔莫司发挥抗脓毒症心肌氧化应激、炎症反应、细胞凋亡、血脂水平异常的作用,可能与激活Nrf2/HO-1 通路有关。而用Nrf2 通路抑制剂ATRA 阻断心肌组织中Nrf2 入核活化后,脓毒症大鼠心肌组织中HO-1 表达降低,其下游抗氧化应激相关指标SOD2、CAT表达及脂质代谢相关指标PPARα、SR-A 表达亦降低,而NF-κB 磷酸化水平升高,大鼠心肌组织损伤及细胞凋亡进一步加重,炎症因子、氧化应激产物分泌增加,血脂水平及脂质代谢异常也进一步加重,大鼠死亡增加,提示阻断Nrf2/HO-1 通路活化,可加重脓毒症大鼠心肌氧化应激、炎症、血脂水平异常等反应,从而加剧病情的发展。此外,本研究发现,阿昔莫司+ATRA 组对脓毒症大鼠的作用效果介于ATRA 组和阿昔莫司组之间,说明ATRA 一定程度上抵消了阿昔莫司对脓毒症大鼠的作用,这也恰好证明了阿昔莫司发挥抗氧化应激、抗炎、抗凋亡和改善血脂水平异常,从而缓解脂多糖诱导脓毒症大鼠心肌损伤的作用是通过激活Nrf2/HO-1 通路实现的。但本研究结果与Jia 等[23]研究发现的巨噬细胞中HO-1 的功能丧失可保护脂多糖诱导的心肌损伤结果貌似矛盾,原因可能是:HO-1 在不同细胞中发挥的功能可能略有差别,而本研究检测的是整个心肌组织中HO-1 表达,而在脂多糖诱导的脓毒症心肌损伤中,心肌组织中的多种细胞共同参与。
综上所述,阿昔莫司能激活Nrf2/HO-1 通路介导的抗炎、抗氧化应激及抗脂质代谢异常等途径,缓解脂多糖诱导建立的脓毒症大鼠心肌氧化应激、炎症、脂质堆积等引起的损伤。这可能为阿昔莫司在脓毒症领域的应用提供一定参考。但脓毒症心肌损伤机制复杂,还涉及心血管内皮细胞损伤、自噬等,脓毒症脂质代谢途径涉及的通路也相对复杂,阿昔莫司在脓毒症领域的应用,还需进一步探究及验证。
利益冲突:所有作者均声明不存在利益冲突
