1株猪源ST-35型肺炎克雷伯菌的致病性和药物敏感性分析
2023-01-03李华明卢文兵雷连成张付贤
李华明,项 维,卢文兵,刘 峰,雷连成,3,张付贤*
(1.长江大学动物科学学院,荆州 434023;2.天门市动物疫病预防控制中心,天门 431700;3.吉林大学动物医学学院,长春 130062)
肺炎克雷伯菌(Klebsiellapneumoniae, Kp)作为一种人兽共患传染病病原体,在动物体表和自然环境中广泛分布[1],可引起人和动物的肺、肝、脑﹑眼部的炎症[2],其中,以尿路和呼吸道的发病率最高[3]。猪肺炎克雷伯菌也可寄居动物体内引发各种疾病,猪感染肺炎克雷伯菌表现出气喘、呼吸困难等症状;剖检以化脓性纤维素性肺炎为主要病理变化,常伴有肝、肾、脾等脏器肿大和出血[4];病猪呼吸困难,精神不振,食欲迅速下降、甚至废绝,常在短时间内发生死亡,严重危害生猪养殖生产。当前临床分离的肺炎克雷伯菌呈现复杂的多重耐药,存在无药可治的风险,对生猪健康养殖具有潜在的危害[5]。掌握细菌的毒力和耐药性是开展针对性治疗的基础。近年来,不同动物源的肺炎克雷伯菌被成功分离和鉴定,并在不同程度上对其毒力、耐药性进行了分析,研究成果对肺炎克雷伯菌的防控具有重要意义[5-7]。本研究从病猪肺组织中分离到1株ST-35型肺炎克雷伯菌,并进行了生物学特性、致病性、耐药性和药物敏感性分析,为临床上肺炎克雷伯菌感染的精准施治和合理用药提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 主要试剂 LB培养基(Tryptone、Yeast extract购自英国Oxoid公司;NaCl购自上海沪试化工有限公司);琼脂糖、革兰染色试剂购自北京索莱宝生物科技有限公司;PCR检测套装和DNA Marker购自北京聚合美生物科技有限公司;组织和细菌基因组提取试剂盒购自北京天根生化科技有限公司;抗生素纸片购自杭州微生物试剂有限公司;中药购自长春市同仁堂大药房。
1.1.2 实验动物 试验选择健康SPF昆明系小鼠(雌),共64只,体重18~22 g,购自湖北宜昌三峡大学实验动物中心。
1.1.3 样品来源 自2021年6月—2022年3月不定期无菌采集贵州地区同一规模化猪场具有呼吸道症状病猪的口鼻拭子(31份)、病死猪的肺组织(17份),低温运输至实验室。
1.1.4 菌株来源 鼠伤寒沙门菌ATCC14028、金黄色葡萄球菌ATCC25923均由长江大学动物科学学院动物重大病原生物学实验室保存。
1.2 方 法
1.2.1 细菌分离培养及染色 将口鼻拭子加入适量无菌PBS,无菌条件下使用接种环在LB固体平板上进行划线分离;将采集的肺组织剪碎后加入适量无菌PBS,使用研磨器进行研磨,无菌条件下使用接种环在LB固体平板上进行划线分离,其后将平板置于37 ℃恒温培养箱培养18 h;观察平板上的菌落形态,挑取典型菌落再次划线、培养,重复3次后涂片,进行革兰染色观察。
1.2.2 生化鉴定 无菌挑取分离菌株的纯培养物接种于LB液体培养基,37 ℃ 180 r·min-1培养过夜,吸取10 μL细菌培养物至细菌微量生化鉴定管内,继续培养12~16 h,观察和记录生化鉴定管的反应变化。
1.2.3 PCR鉴定和16S rRNA基因测序 根据肺炎克雷伯菌特有的khe基因合成特异性引物[8-9],以细菌纯培养物为模板进行PCR检测;采用细菌基因组DNA提取试剂盒提取分离菌株DNA,以通用引物27F与1492R进行扩增,纯化后的PCR扩增产物进行测序分析;结合NCBI BLAST比对结果,利用MEGA11构建系统进化树。
1.2.4 多位点序列分析(MLST) 根据MLST官网提供的肺炎克雷伯菌信息,合成其7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)的引物并进行扩增、测序,上传至MLST网络数据库获取等位基因信息,通过eBURST程序分析并绘图。
1.2.5 生物被膜形成能力测定 将分离菌株KP-0728的单菌落接种于LB培养基中进行培养,待菌液浓度达到0.5麦氏浓度(1.5×108CFU·mL-1)时取200 μL菌液转移到无菌96孔板中置于37 ℃静止培养24 h,设置6个重复,并以鼠伤寒沙门菌ATCC14028作为对照菌株,以LB培养基为空白对照。培养结束后,弃除培养基,PBS洗涤3次以清除杂质和浮游菌,弃液后加入0.1%的结晶紫200 μL染色5 min,并使用无菌蒸馏水洗去残余染液,洗至无色时每孔加入200 μL无水乙醇,酶标仪测定波长590 nm处的吸光度值。结果判定时,依据临界的ODc值(ODc等于空白孔的平均值)将生物被膜形成能力分类如下:OD≤ODc为无(-);ODc
1.2.6 毒力基因扩增 提取分离菌株的基因组,利用特异性PCR方法检测分离菌株的7种毒力基因:wabG、菌素、magA、kfu、fimH、rmpA、uge[10-13]。
1.2.7 小鼠致病性试验 32只小鼠随机分为4组,每组8只;取冻存于-80 ℃冰箱的分离菌株KP-0728,无菌条件下使用接种环在LB固体平板上进行划线并置于37 ℃培养箱中恒温过夜培养,随机挑取平板上的单菌落进行PCR鉴定,待鉴定正确后挑取单个菌落置于LB液体培养基中37 ℃ 180 r·min-1培养;培养至对数生长期(OD600 nm为0.6)时取分离菌株菌液用于攻毒试验,3 500 r·min-1离心5 min收集菌体,并使用生理盐水洗涤两次,经梯度稀释后平板计数,最后使用生理盐水将菌液浓度分别调整为3.0×108、3.0×107、3.0×106CFU·mL-1;试验组小鼠分别腹腔注射0.2 mL不同稀释度的菌液,即攻毒剂量分别为6.0×107、6.0×106、6.0×105CFU·鼠-1,对照组注射0.2 mL生理盐水。观察感染小鼠的临床状症,剖检死亡小鼠并无菌采集病变组织;死亡小鼠的病变组织和器官经研磨匀浆后,在LB固体培养基上进行细菌的分离培养,以肺炎克雷伯菌的特异性引物对脏器的分离菌株进行鉴定。
1.2.8 药敏试验 采用抗生素纸片法检测分离菌株对常见抗生素的敏感程度。在超净工作台,取对数生长期的菌液均匀涂布在LB固体平板上,在平板的合适位置均匀放置不同抗生素的药敏片,37 ℃恒温培养培养24 h,测定并记录抑菌圈直径大小,并参照试剂盒说明书判定分离菌株对不同抗菌药物的敏感性。试验同时以金黄色葡萄球菌ATCC25923作为质控菌株进行平行试验以确保试验有效性。
1.2.9 耐药基因扩增 参考文献合成肺炎克雷伯菌常见的抗生素耐药基因的引物,采用PCR方法筛查分离菌株的耐药基因[14-18]。
1.2.10 中药体外敏感试验 称量连翘、金银花、桂枝、甘草、麻黄、茯苓、荷叶、黄芩、薄荷9味中药材,分别制备成终浓度为1 g·mL-1的中药药液[19-20];无菌条件下,取分离株的菌液均匀涂布在LB固体平板上,在牛津杯中加入不同的中药药液,以加入灭菌水的孔作为空白对照。37 ℃恒温静置培养,测定不同中药药液的抑菌圈直径。试验重复3次,取平均值作为该中药的抑菌圈直径。判定标准[20]:抑菌圈直径≥20 mm,判定为菌株对药物高度敏感,标注“++”;抑菌圈直径介于10~20 mm判定为菌株对药物中度敏感,标注“+”;无抑菌圈或者抑菌圈直径<10 mm,判定为菌株对药物耐药,标注“-”。
1.2.11 中药体内治疗试验 将32只小鼠随机分为4组:头孢氨苄组、茯苓组、甘草组、PBS组,每组8只。取冻存于-80 ℃冰箱的分离菌株KP-0728,经活化和鉴定后使用接种环在LB固体平板上进行划线并置于37 ℃培养箱中恒温过夜培养;挑取单个菌落置于LB液体培养基中37 ℃、180 r·min-1培养至对数生长期(OD600 nm为0.6),3 500 r·min-1离心5 min收集菌体,并使用生理盐水洗涤两次,调整菌量到2.28×106CFU对所有小鼠进行腹腔注射构建KP-0728感染模型。感染6 h后,参照药敏结果选取敏感抗生素头孢氨苄、敏感中药茯苓以及非敏感中药甘草对小鼠进行灌胃治疗。抗生素头孢氨苄水溶后以30 μg·鼠-1的剂量灌胃小鼠(参照药敏片药物含量);中药药液制备同“1.2.10”,每次灌胃200 μL·鼠-1;对照组以同样剂量的PBS进行灌胃;连续灌胃3 d。治疗3 d后,无菌采集小鼠肺称重、研磨,组织悬液稀释后进行平板计数,统计各组小鼠肺载菌量。
2 结 果
2.1 细菌分离鉴定及MLST序列分析
对所采集的病料样本进行增菌并扩大培养,当在LB固体培养基上划线培养,可见白色、光滑、圆形凸起的菌落(图1A);革兰染色后,在显微镜下可见呈单个、成双或链状排列、红色杆状菌(图1B),判断分离菌为革兰阴性菌;生化特性分析发现,分离菌株具有赖氨酸脱羧酶活性,不具有鸟氨酸脱羧酶活性;能够发酵阿拉伯糖、鼠李糖、麦芽糖、蔗糖、D-葡萄糖;能够利用甘露醇、山梨醇,而H2S试验为阴性,分离菌的生化特性与《伯杰氏细菌鉴定手册》(第8版)中肺炎克雷伯菌的生化特性一致。以肺炎克雷伯菌khe基因引物对菌株进行PCR鉴定,结果如图1C所示,PCR扩增产物在428 bp处有特异性扩增条带,与预期片段大小一致,表明分离菌株为肺炎克雷伯菌。在48份病料样本中,经PCR检测肺炎克雷伯菌阳性的样品有17份,检出率为35.42%,其中,8份来源于口鼻拭子,9份来源于肺组织。采用相同的方法对阳性样品进行细菌的分离、纯化和鉴定,最终获得3株肺炎克雷伯菌,均来自肺组织;经16S rRNA测序发现,3株分离菌株序列一致,判断其处于同一进化分支;测序结果显示,分离菌株与GenBank中肺炎克雷伯菌参考株(KX636139.1)的16S rRNA序列的相似性达99%以上;对由同一猪场分离的3株菌进行生化特性以及生物学特性研究时发现,3株菌具有相类似的特征,因此本研究随机选择了2021年7月28日从肺组织中分离的菌株作为后续研究的试验菌株。构建系统进化树发现,分离菌株与肺炎克雷伯菌处于同一进化分支(图1D)。结合分离菌株的生物学特性和16S rRNA序列分析,确定分离菌株为肺炎克雷伯菌,命名为KP-0728。
对肺炎克雷伯菌KP-0728的7个管家基因进行测序,通过数据库比对分析,如表1所示,KP-0728的7个等位基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)编号分别为2、1、2、1、10、1、19,与现有数据库中的ST-35型相匹配;在数据库中下载相关分离株MLST信息,分析绘图,发现ST-35型与ST-875型汇聚在一支(图1E),具有较近的亲缘关系。
根据结晶紫染色法测得分离菌株KP-0728的OD590 nm为0.079 8,如图2所示,鼠伤寒沙门菌ATCC14028的OD590 nm为0.066 8,分离菌株的生物被膜形成能力强于鼠伤寒沙门菌生物被膜形成能力;而ODc的值为0.045 1,分离菌株的590 nm处的OD值为ODc~4ODc,依据判断标准,分离菌株KP-0728具有中等的生物被膜形成能力,这一数据或提示该菌株具有较强的抵抗外界环境和抵抗抗生素杀菌作用的能力。

表1 中国ST-35型肺炎克雷伯菌部分信息

A.分离菌株菌落形态;B.分离菌株革兰染色(1 000×);C. PCR鉴定(M. DL2000 相对分子质量标准;-.阴性对照;1.分离株)D.分离菌株16S rRNA基因序列的系统进化树;E. MLST分析A. Colony morphology of isolated strains; B. Gram staining of isolated strains (1 000×); C. Identification by PCR (M. DL2000 marker; -. Negative control; 1. Isolated strains); D. Phylogenetic tree of 16S rRNA gene sequences of the isolate; E. MLST analysis图1 分离菌株形态学观察、PCR鉴定结果及序列分析结果Fig.1 Morphological observation, PCR identification and sequence analysis of isolated strains
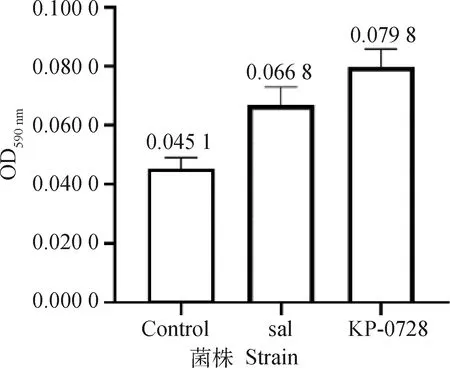
图2 生物被膜形成能力Fig.2 Biofilm-forming ability
2.2 分离菌株致病性分析
对肺炎克雷伯分离株KP-0728携带的毒力基因情况进行分析,结果如图3A~D所示,7种毒力基因中肺炎克雷伯分离株KP-0728共检测出4个毒力基因:uge(535 bp)、wabG(683 bp)、fimH(550 bp)和kfu(797 bp)。
为进一步了解该菌株的致病性,本研究采用腹腔注射的方式感染小鼠。结果发现,试验小鼠经腹腔注射菌液后,小鼠出现活动性减弱、嗜睡、被毛凌乱等临床症状;腹腔注射菌液24 h后,6.0×107CFU·鼠-1组小鼠全部死亡,6.0×106CFU·鼠-1组的小鼠死亡1只;48 h后,6.0×106CFU·鼠-1组的小鼠死亡3只,其余小鼠症状有所缓解;72 h后,其余小鼠均恢复正常。在攻毒期间,6.0×105CFU·鼠-1组的小鼠在48 h后出现1只死亡的情况,其余小鼠仅表现为轻微的精神沉郁,对照组小鼠未见异常(图4A)。死亡小鼠的肺病变最为显著,出现明显肿大、出血现象;肝和脾也有不同程度的肿大,局部有出血;从死亡小鼠的肺、肝和脾组织均可分离出透明、光滑的菌株,经PCR鉴定分离菌株与攻毒菌株一致(图4B)。根据攻毒后小鼠死亡情况,计算出分离菌株KP-0728的半数致死量(LD50)为4.56×106CFU。
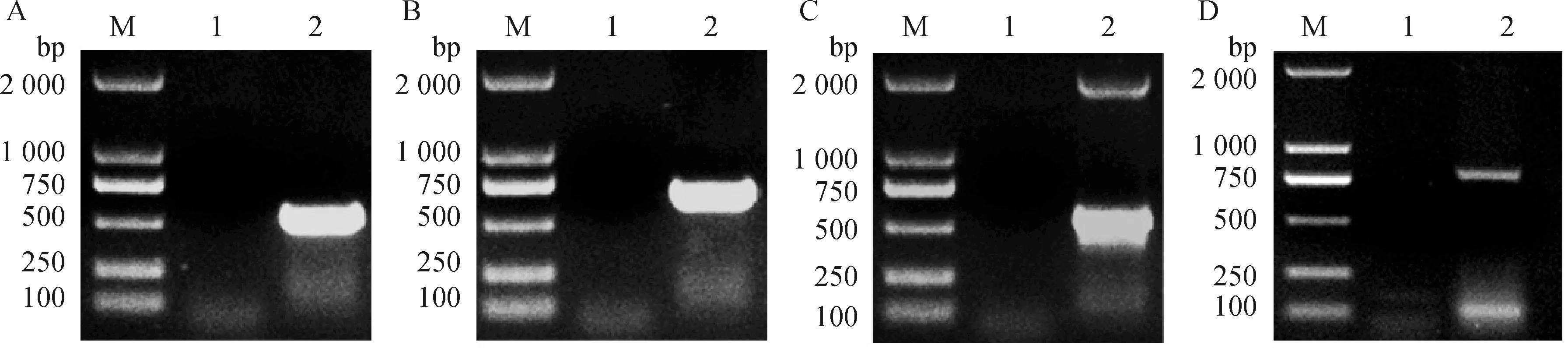
A~D. 毒力基因uge、wabG、fimH和kfu的PCR鉴定结果;M. DL2000 相对分子质量标准;1.阴性对照;2. KP-0728A-D. PCR identification results of virulence genes uge, wabG, fimH and kfu, respectively; M. DL2000 marker; 1. Negative control; 2. KP-0728图3 毒力基因检测结果Fig.3 Detection results of virulence genes
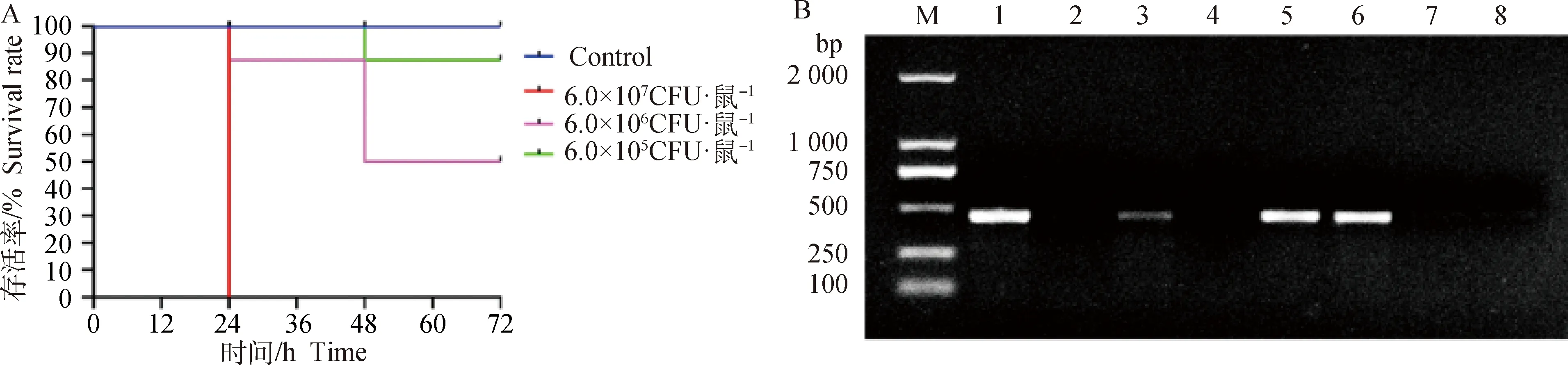
A.小鼠生存曲线;B.感染小鼠各脏器的病原分离和鉴定(M. DL2000 相对分子质量标准;1.阳性对照;2. 阴性对照;3.脾;4.心;5.肺;6.肝;7.肾;8.肠)A. Mouse survival curve; B. Isolation and identification of pathogens infecting various organs of mice (M. DL2000 marker; 1. Positive control; 2. Negative control; 3. Spleen; 4. Heart; 5. Lung; 6. Liver; 7. Kidney; 8. Intestinal)图4 小鼠生存曲线及感染小鼠各脏器的病原分离和鉴定结果Fig.4 Mouse survival curve and isolation and identification of pathogens infecting various organs of mice
2.3 药敏试验结果
2.3.1 常用抗生素药敏结果 以质控菌株金黄色葡萄球菌(ATCC25923)和分离菌株KP-0728一起进行药敏试验,质控菌株的药敏试验结果在质控规定范围内。进一步药敏试验结果显示,分离株KP-0728对氨苄西林、亚胺培南、庆大霉素、四环素、复方新诺明耐药;对头孢曲松、头孢氨苄、头孢美唑、阿奇霉素、氧氟沙星、多黏菌素B、替考拉宁敏感;对丁胺卡那和克林霉素中度敏感(表2)。

表2 分离菌株的药敏试验结果
2.3.2 耐药基因检测结果 分离株KP-0728的耐药基因检测结果显示,分离株KP-0728携带sul2(722 bp)、bla-SHV(713 bp)、tetA(730 bp)和aadA1(282 bp)4种耐药基因(图5),具有一定的耐药性。

A~D. 耐药基因sul2、bla-SHV、tetA和aadA1;M. DL2000 相对分子质量标准;1.阴性对照;2. KP-0728A-D. Resistance genes sul2, bla-SHV, tetA and aadA1; M. DL2000 marker; 1. Negative control; 2. KP-0728图5 耐药基因扩增结果Fig.5 Detection results of resistance genes
2.3.3 中药抑菌试验结果 9味中草药对肺炎克雷伯菌的抑菌效果如表3所示,茯苓对该肺炎克雷伯菌分离株的抑菌效果最好,抑菌圈达10 mm以上,为中度敏感;其次是黄芩,抑菌圈直径为8 mm;金银花、麻黄对肺炎克雷伯菌也有一定的的抑菌作用;连翘、桂枝、甘草、荷叶以及薄荷这5味中药对肺炎克雷伯菌分离株抑菌圈直径均为0,无抑菌作用。

表3 9味中草药对肺炎克雷伯菌抑菌效果的检测结果
2.3.4 中药对肺炎克雷伯菌感染小鼠肺载菌量的影响 分离菌株KP-0728腹腔注射小鼠后6 h,感染小鼠均出现活动性减弱、被毛凌乱等明显的临床症状;在使用抗生素和中药对感染肺炎克雷伯菌的小鼠治疗3 d后,4组小鼠仍表现出不同程度的嗜睡、被毛凌乱等临床症状,以PBS组小鼠的临床症状最为严重;PBS组出现1只小鼠死亡的情况,其他组小鼠未出现死亡。统计各组小鼠肺载菌量情况发现,如图6所示,头孢氨苄组小鼠肺的载菌量最低,PBS组小鼠的肺载菌量最高;与PBS对照组相比,头孢氨苄治疗组小鼠的肺载菌量极显著降低(P<0.01),中药茯苓治疗组和甘草治疗组小鼠的肺载菌量均低于PBS组,且茯苓治疗组小鼠的肺载菌量较PBS组显著降低(P<0.05)。试验结果表明,中药茯苓在小鼠体内具有抑制KP-0728的作用。

*. P<0.05,**. P<0.01,ns. P>0.05图6 药物治疗后小鼠肺载菌量Fig.6 Bacterial load in mice lung after treatment of drugs
3 讨 论
目前,猪场分离的肺炎克雷伯菌通常表现为多重耐药和较强的致病性,对公共卫生和畜牧养殖业具有潜在威胁[24-26],因此厘清肺炎克雷伯菌的毒力基因、耐药性、致病力和药物敏感性等对于肺炎克雷伯菌感染的防控具有重要指导意义。本研究从具有呼吸道症状病猪的组织中分离到肺炎克雷伯菌,经形态观察、生化鉴定和16S rRNA基因测序分析得到确认,进一步通过多位点序列分析确定分离株为ST-35型。如表1所示,国内分离到的肺炎克雷伯菌ST-35型均来源于人和环境样品,本研究首次分离到猪源的肺炎克雷伯菌ST-35型,提示肺炎克雷伯菌作为一种人兽共患病病原,在人、动物和环境中均可传播,而为防止其对人及动物造成进一步的危害,对其进行深度、系统性研究尤为重要。
本研究分离的猪源肺炎克雷伯菌ST-35型菌株的毒力基因筛查发现,其携带参与脂多糖合成的毒力基因uge和wabG,以及参与黏附素合成的毒力基因fimH和kfu;人工感染试验发现,猪源肺炎克雷伯菌ST-35型菌株可致小鼠出现肺、肝出血等多器官损伤,高剂量感染(6.0×107CFU·鼠-1)可导致小鼠死亡,半数致死量(LD50)为4.56×106CFU;同时从死亡小鼠的脾、肺、肝等器官中均可分离到攻毒菌株,印证了肺炎克雷伯菌分离株KP-0728与贵州地区猪场暴发的呼吸道疾病的关联性。
鉴于养殖场呼吸道疾病抗生素治疗效果不理想的情况,本研究通过药敏试验发现肺炎克雷伯菌KP-0728是1株多重耐药菌,对氨苄西林、亚胺培南、庆大霉素、四环素、复方新诺明均耐药;耐药基因检测分析发现,其对磺胺类药物的耐药性可能与sul2基因有关、对β-内酰胺类药物的耐药性可能与bla-SHV基因有关、对四环素类药物的耐药性可能与tetA基因有关、对氨基糖苷类药物耐药可能与aadA1基因有关。研究发现,生物被膜的形成与细菌耐药有着密切关系,生物被膜的特殊屏障渗透作用使得肺炎克雷伯菌对多种抗生素产生强的耐药性[27]。在本研究中通过结晶紫染色法发现肺炎克雷伯菌KP-0728具有中等的生物被膜形成能力,这与其在药敏试验中表现的多重耐药情况相符;同时,肺炎克雷伯菌KP-0728表现出的耐药情况与许多国内学者报道的肺炎克雷伯菌耐药性不尽相同,这可能是用药习惯不同以及地域差异等原因造成的[26-28],也与关键蛋白的缺失、基因突变等因素相关[29-30]。总之,肺炎克雷伯菌的复杂耐药机制有待进一步深入、系统地研究。
如何预防和治疗肺炎克雷伯菌感染是养殖生产亟待解决的问题。研究表明,应用中药药物治疗细菌性疾病其最大的优点在于避免细菌耐药性的产生[31]。目前,对于中药药物治疗细菌或病毒性疾病的研究依旧处于初步探索的阶段,已知应用中药治疗肺炎克雷伯菌感染的研究也停留在体外试验[32]。本研究通过体外试验发现,肺炎克雷伯菌对中药茯苓敏感;进一步构建肺炎克雷伯菌感染的小鼠模型,通过体内试验初步证实中药茯苓能够显著减少感染小鼠肺的载菌量,具有良好的治疗肺炎克雷伯菌感染的效果。虽然中药茯苓在小鼠模型中的抑菌效果不如抗生素,但这仅仅是茯苓单味中药的作用效果。在中兽医临床用药中,中药药剂多以复方的形式依据“君、臣、佐、使”进行组合配伍,起到兼顾多方面、系统性提高药效的作用。中药的种类繁杂,更多能发挥抑菌作用的中药有待进一步发掘和组方验证,为抗菌中药联合抑菌作用分析、抗耐药菌感染的治疗和中西联合用药等研究提供依据和新的思路[33]。本研究经药物敏感性试验证实,中药茯苓对肺炎克雷伯菌KP-0728有一定的治疗效果,因此临床上针对肺炎克雷伯菌感染的治疗方案,应充分考虑细菌的流行特点、致病性和耐药性,兼顾抗生素和中药的使用,做到合理用药和综合施治。
4 结 论
本试验分离出1株猪源ST-35型肺炎克雷伯菌,该菌携带uge、wabG、fimH和kfu4种毒力基因,可致感染小鼠多个器官的不同程度出血,甚至死亡;其携带sul2、bla-SHV、tetA和aadA1 4种耐药基因,对氨苄西林、亚胺培南、庆大霉素、四环素、复方新诺明耐药,对头孢曲松、头孢氨苄、头孢美唑等抗菌药敏感;中药茯苓在体外、体内试验中对分离菌株KP-0728均具有显著的抑菌作用。
