microRNA-33a对分化骨髓间充质干细胞移植治疗大鼠肾缺血-再灌注损伤的影响
2023-01-03许明伟孙晓松石洪波曾东扬
许明伟 孙晓松 石洪波 曾东扬
肾缺血-再灌注损伤(renal ischemia-reperfusion injury, RIRI)是泌尿外科围手术期致肾损伤的常见病因。RIRI表现为肾脏血流量急骤减少或中断,导致肾小球滤过率急剧下降,继发氧化应激损伤;再灌注这一病理生理过程中陆续激活的炎症因子可进一步导致肾脏各级血管对扩张血管药物的敏感性下降,从而加重氧化应激所致损伤[1-2]。虽然围绕RIRI的发病机制已有系列基础研究及针对性的处理策略,但RIRI的预后仍然未见显著改善,其肾功能受损率及死亡率不容忽视。
在此背景之下,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)移植治疗成为了RIRI治疗的研究热点[2-4]。BMSCs来源于骨髓细胞间质,具有多向分化的潜能,可接受外源性基因并可稳定性表达相应的基因产物,现已被逐步应用于组织工程、创伤修复、细胞替代治疗方面。但如何通过改进BMSCs的相关特性诸如靶向稳定性、旁分泌能力,以期进一步增强BMSCs治疗RIRI的效果,已成为泌尿外科领域急需解决的问题[3,5]。
微小核糖核酸(microRNA, miRNA)是内源性的非编码RNA,其可通过识别并结合在它们目的基因3′-末端未翻译区(3′-untranslated regions, 3′-UTR)的互补序列而在转录后水平上抑制该基因的表达。其中,miRNA-33a在肾脏组织中表达丰富,高度保守,广泛参与包括氧化应激损伤在内的多种生物学功能过程,可在转录后调节炎症反应及氧化应激等多个目的基因的表达[6-8]。由此推测,miRNA-33a能在RIRI的各项病理生理进程中发挥调控作用。此外,有研究发现miRNA-33a在各类间充质干细胞中广泛表达,尤其显著表达于BMSCs[9]。但miRNA-33a对于BMSCs的具体影响以及对于RIRI的病理生理进程是否产生干预作用,还不得而知。有鉴于此,本研究拟通过建立细胞及体外RIRI损伤模型,研究miRNA-33a对RIRI的干预作用,并探寻其可能机制,从而为进一步改进RIRI的诊疗提供研究思路。
材料与方法
一、实验材料
miRNA-33a mimic、miRNA-33a inhibitor及其阴性对照均购自武汉迈辰生物科技有限公司;CCK-8试剂盒购自武汉爱博泰克生物科技有限公司;超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)、乳酸脱氢酶(lactate dehydrogenase, LDH)活性检测试剂盒购自上海碧云天公司;逆转录试剂盒购自瑞典Roche公司。
二、制备BMSCs
实验使用的BMSCs取材自SPF级雄性SD大鼠的BMSCs,采用颈椎脱臼法处死大鼠,去除股骨两端骨骺,吸取IMDM培养液后,从股骨一端反复冲洗骨髓腔,收集骨髓细胞。反复吹打、离心、接种,当传代细胞生长密度达到70%~80%时,按1∶3的比例传代至第3代供后期实验用。
三、动物实验
另选取SPF级雄性SD大鼠50只,饲养环境为清洁级,温度维持在20~22 ℃。动物分笼饲养,每笼2只,每周换垫料、消毒笼具2次,饲养至体重220~250 g,动物实验、饲养、处死均符合伦理要求。将其编号后依照随机数字表法分为5组:假手术组(sham组)、RIRI组、BMSCs组、BMSCs+miRNA-33a mimic组(BMSCs+mimic组)、BMSCs+miRNA-33a inhibitor组(BMSCs+inhibitor组),每组10只。
所有实验动物均按照80 mg/kg、1%戊巴比妥钠行腹腔注射麻醉,常规固定消毒,腹正中切口;sham组仅对大鼠进行麻醉、开腹、游离肾脏操作;RIRI组游离双侧肾脏后,暴露肾蒂,用微血管钳夹闭双侧肾蒂40 min后开放,观察到肾脏颜色由紫色转为红色后,逐层缝合,关闭腹腔,约1 h后经尾静脉注入RPMI-1640细胞培养液0.5~1.0 ml;BMSCs组于尾静脉注入含3代BMSCs(1×106/个)的RPMI-1640细胞培养液,剂量相同,其余操作均同RIRI组;BMSCs+mimic组/BMSCs+inhibitor组分别于尾静脉注入含有相应BMSCs细胞的培养液,其余操作均同RIRI组。
于术后次日,抽取大鼠尾静脉血,经全自动生化分析仪测定血清肌酐(Scr)和尿素氮(BUN)含量;使用比色法检测细胞SOD、CAT、GPx等抗氧化酶含量,参照相应试剂盒说明书进行。
随后以颈椎脱臼法处死所有实验动物,取出肾脏制成蜡块,随机采样3个视野,分别行HE和Masson染色,倒置相差显微镜,每张切片随机选取10个皮质区视野观察各组肾脏病理组织学的形态差异,并通过Image Pr0 Plus测量Masson染色切片的间质胶原容积积分(collagen volumetric fraction, CVF)。另对肾组织蜡块行增殖细胞核抗原(proliferation cell nuclear antigen, PCNA)免疫组化染色,高倍镜下于皮髓质交界随机取5个不重复视野,记录阳性细胞的分化增殖情况。
四、统计学方法
使用SPSS 17.0软件对数据进行处理,设定双侧P<0.05为差异具有统计学意义。对于计量资料进行Kolmogorov-Smirnov检验,符合正态分布的计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析、两两比较采用SNK法;不符合正态分布的计量资料以中位数及四分位数(Q25,Q75)表示,两组间及多组间比较采用秩和检验。
结 果
一、BMSCs细胞生物学特性
将第3代BMSCs接种于96孔板,接种次日,细胞胞体呈圆形或类圆形,偶见少许呈条索形,贴壁尚不稳固、细胞密度低;接种3 d后细胞呈集落样生长,并逐渐向两端延伸出短棒样凸起;至接种6~7 d,大部分BMSCs呈梭形或多角形,细胞基本覆盖满板底,如图1A、B所示。将BMSCs按照不同浓度梯度接种于7个时间点(7 d),MTT法检测结果显示,BMSCs生长曲线呈S型,细胞接种后的前3 d为潜伏期,第4天细胞开始进入对数期,第7天细胞生长达到平台期,生长曲线如图1C所示。
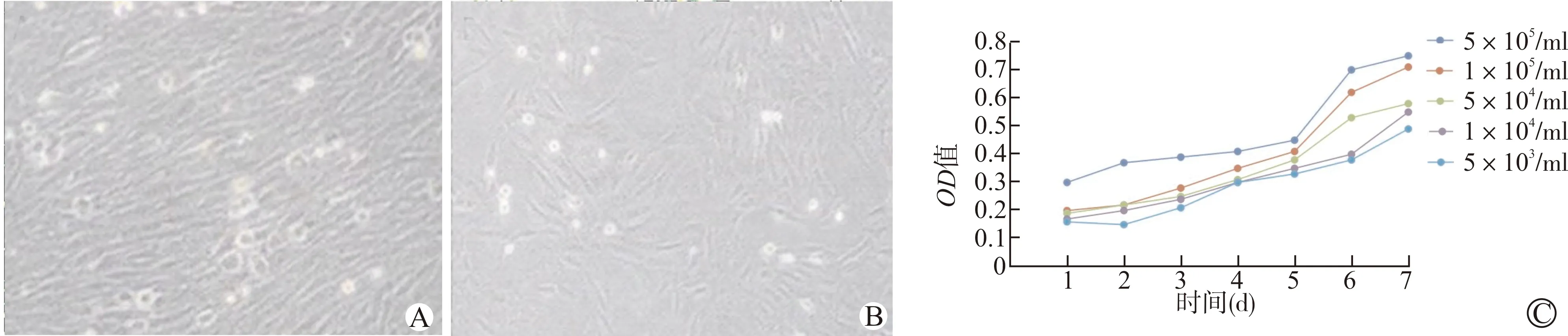
A:接种次日(×200);B:接种第7天(×200);C:生长曲线图1 BMSCs细胞生物学特性
二、动物实验建模情况
动物实验造模后,sham组及BMSCs组各有1只大鼠未能苏醒,其余实验动物基本于2 h内苏醒并自如活动;RIRI组及BMSCs+mimic组各有2只大鼠于术后2 d内死亡,综合后续的细胞因子检测及形态学检测判定,总体造模成功率为88%。
三、各组实验动物肾功能及抗氧化酶指标情况
至造模术后次日,各组肾功能及抗氧化酶含量情况见图2。①Scr、BUN水平:相比于sham组,RIRI组的Scr、BUN显著升高(P<0.05);BMSCs组相比RIRI组则显著降低(P<0.05),但仍显著高于sham组(P<0.05);BMSCs经过miRNA-33a mimics/inhibitor干预后,BMSCs+mimic组的Scr、BUN相比BMSCs组显著升高(P<0.05),BMSCs+inhibitor组的Scr、BUN相比BMSCs组则显著降低(P<0.05)。②SOD、CAT、GPx含量:相比于sham组,RIRI组SOD、CAT、GPx含量显著下降(P<0.05);BMSCs组相比RIRI组则显著回升(P<0.05),且已恢复至与sham组相同的水平(P>0.05);BMSCs经过miRNA-33a mimics/inhibitor干预后,BMSCs+mimic组的SOD、CAT、GPx含量相比BMSCs组显著下降(P<0.05),BMSCs+inhibitor组的SOD、CAT、GPx含量相比BMSCs组则未见显著差异(P>0.05)。
四、各组实验动物肾脏病理组织学结果
HE染色结果如图3所示,与sham组相比,RIRI组肾组织可见明显肾小管上皮细胞水肿、肾小管扩张、细胞趋于扁平,周围炎症细胞浸润,BMSCs组的肾小管上皮细胞水肿程度较轻,未见显著炎症反应;BMSCs经过miRNA-33a mimics/inhibitor干预后,相比BMSCs组,BMSCs+mimic组肾小管扩张程度及炎性细胞浸润趋势更为明显,BMSCs+inhibitor组的肾小管上皮细胞肿胀坏死程度则基本缓解。其结果进一步证实RIRI主要损伤部位为肾小管。
Masson染色结果如图4所示,sham组肾脏间质胶原纤维极少,RIRI组肾脏间质则可见明显纤维化改变及胶原沉积,BMSCs组纤维化程度略有减轻,BMSCs+mimic组的纤维化及胶原沉积程度略严重于BMSCs组,但BMSCs+inhibitor组相比BMSCs组则未见明显缓解。各组间CVF差异与上述趋势相同,相比sham组,RIRI组的CVF显著升高(P<0.05);经BMSCs治疗后,其CVF相比RIRI组显著下降(P<0.05),但仍高于sham组(P<0.05);BMSCs+mimic组的CVF显著高于BMSCs组(P<0.05),BMSCs+inhibitor组的CVF与BMSCs组相比则未见显著差异(P>0.05)。
另对肾组织蜡块行PCNA免疫组化染色,结果如图5所示。相比于sham组,RIRI组PCNA阳性细胞未见显著改变(P>0.05);而相比RIRI组及sham组,BMSCs组阳性细胞计数则显著升高(P<0.05);BMSCs+mimic组的阳性细胞计数相比BMSCs组显著下降(P<0.05),BMSCs+inhibitor组相比BMSCs组则未见显著改变(P>0.05)。见表1。
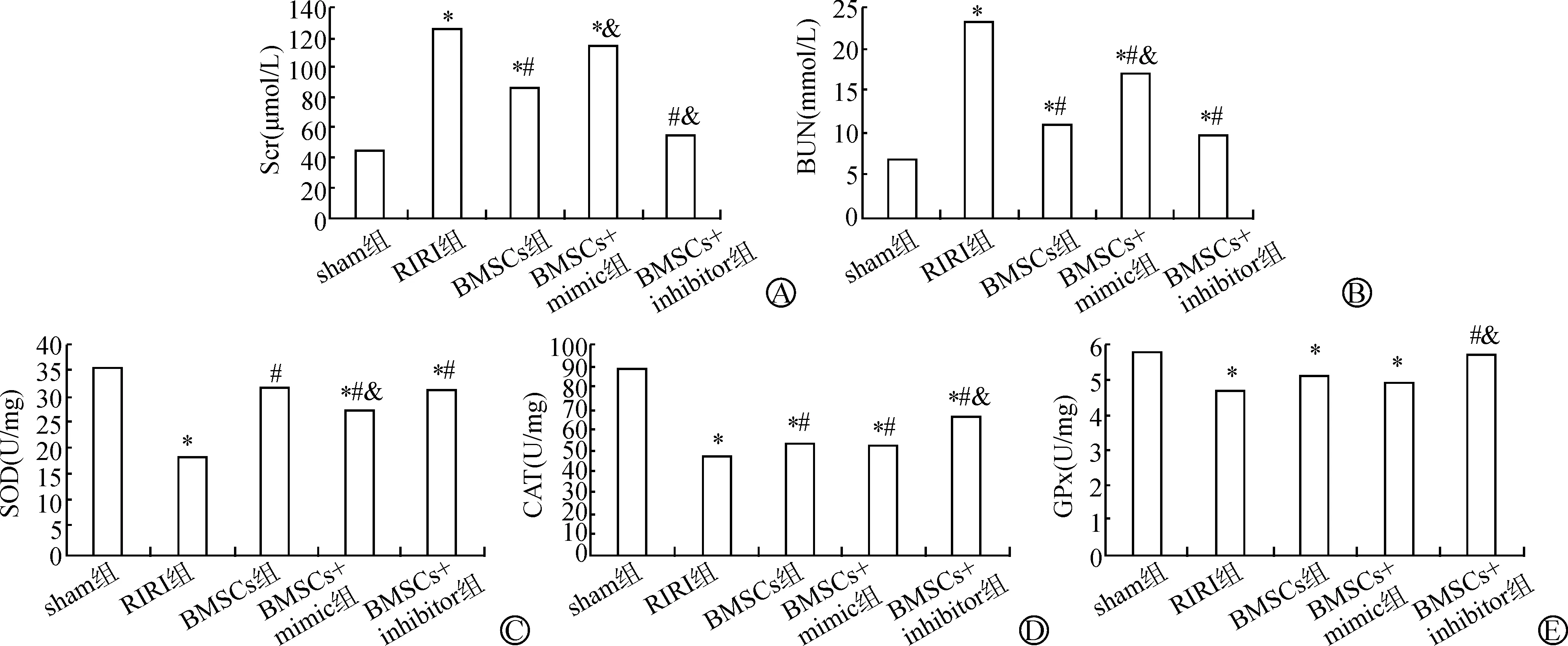
A、B:肾功能指标;C、D、E:抗氧化酶含量(与sham组相比 *P<0.05;与RIRI组相比 # P<0.05;与BMSCs组相比 & P<0.05)图2 造模术后次日各组肾功能及抗氧化酶含量差异
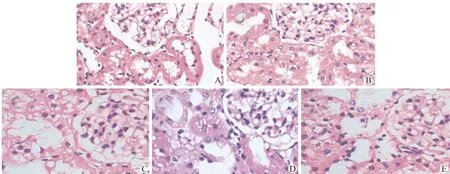
A:sham组;B:RIRI组;C:BMSCs组;D:BMSCs+mimic组;E:BMSCs+inhibitor组图3 各组肾脏组织HE染色(×200)

A:sham组;B:RIRI组;C:BMSCs组;D:BMSCs+mimic组;E:BMSCs+inhibitor组图4 各组肾脏组织Masson染色(×200)

A:sham组;B:RIRI组;C:BMSCs组;D:BMSCs+mimic组;E:BMSCs+inhibitor组图5 各组肾脏组织PCNA染色(×200)

表1 各组肾脏组织病理组织学相关参数差异
讨 论
肾缺血损伤可引起肾小管扩张、渗出及肾小管上皮细胞水肿、核浓缩坏死等系列病理变化;当病因去除、肾脏血流恢复,由于再灌注时间不同决定了不同比例的肾小管上皮细胞增殖、修复,而另一部分肾小管上皮细胞则被破坏,基底膜断裂,丧失完整性,进入纤维化阶段,直至发生肾功能不可逆性损伤[10]。
间充质干细胞因其不存在类似胚胎干细胞的伦理学争议,近年来被逐步用于各种由缺血-再灌注损伤导致的疾病研究。许多组织中都存在间充质干细胞,如骨髓、骨骼、肌肉、肺、肝等组织以及脐带血,其中以BMSCs得到广泛研究[3]。随着对相关干细胞研究的不断深入,其再生修复能力为各类不可逆的缺血性损伤疾病,诸如RIRI的治疗提供了新的思路和方法[11]。既往已有动物实验研究提示,全骨髓移植不能改善肾脏缺血模型的肾功能,但选择BMSCs移植则有一定效果[12]。究其原因可能为BMSCs通过分化为血管内皮细胞、肾小管上皮细胞等外胚层细胞,通过改善局部供血,促进组织修复,从而缓解肾脏缺血再灌注的系列病理进程;而全骨髓细胞的BMSCs含量较少,无法缓解肾脏损伤。但对于移植BMSCs治疗RIRI的病理机制和干预靶点尚未完全探明。Zhang等[13]的研究显示,BMSCs可能是通过抑制Wnt/β-catenin通路增强抗纤维化作用,从而在RIRI过程中保护肾功能。microRNAs是一类长约19~24个核苷酸的非编码RNA,常通过碱基互补配对方式与靶基因3′-UTR上种子区域完全或部分结合,在转录后水平调控靶基因表达。近年来研究提示microRNAs在氧化应激和细胞凋亡等进程中发挥广泛调控作用。其中,既往有关miRNA-33a的研究大多局限在肿瘤领域,但越来越多的研究提示,miRNA-33a作用较为广泛,在正常组织细胞如心肌细胞、肾小管上皮细胞中呈高表达[6-7]。有研究显示,miRNA-33a与心肌纤维化、血管重构、调节脂质代谢有关[8],其在肾脏中的作用研究较少。
本研究通过诱导BMSCs分化为上皮细胞并转染不同类别miRNA-33a构建细胞学模型,夹闭大鼠双侧肾蒂40 min以建立急性RIRI动物模型。试图探明miRNA-33a对于BMSCs分化的肾小管上皮细胞是否存在干预及表达,继而明确能否通过干预移植的BMSCs来发挥对RIRI病理进程的调节作用。我们将转染miRNA-33a mimic/inhibitor的BMSCs作为干预手段,输注至RIRI动物模型后,在移植分化的BMSCs对于RIRI存在治疗作用的基础上,进一步发现miRNA-33a可加快BMSCs氧化应激进程、损伤肾功能;通过抑制miRNA-33a含量可减缓BMSCs氧化应激进程,对于肾功能有一定的保护作用。
各组病理组织学结果亦提示,miRNA-33a可刺激肾小管扩张、增加炎性细胞浸润,加速肾脏组织纤维化及胶原沉积,抑制miRNA-33a对于肾小管上皮细胞肿胀有一定程度的缓解。而作为DNA聚合酶的辅因子,PCNA为DNA复制和合成所必需,因此PCNA阳性细胞计数可用于评判细胞增殖活性,继而反映肾脏修复的情况[14]。本研究中的PCNA免疫组化染色趋势与上述结果基本一致,予以BMSCs治疗后,PCNA阳性细胞计数显著升高;转染miRNA-33a之后通过抑制抗氧化酶活性,激化氧化应激损伤,降低了PCNA阳性细胞计数。
综上所述,本研究通过系列细胞及动物实验发现,移植分化的BMSCs,对于RIRI存在确切的修复作用,且上述修复作用受到miRNA-33a调控。若及时抑制miRNA-33a的表达,可通过降低氧化应激损伤,进而发挥对肾小管上皮细胞的保护作用,尽可能修复肾脏组织或者使肾脏修复时间提前,从而改善RIRI的预后。但miRNA-33a具体的作用靶点及干预信号通路尚不得而知,这也将是我们后续研究的重点。
