SIRI、FAR和ALP对前列腺癌骨转移的预测价值
2023-01-03谢文亮邱逸凡臧晋
谢文亮 邱逸凡 臧晋
前列腺癌在全球男性恶性肿瘤发病率中排名第二位,是老年男性中最常见的恶性肿瘤之一[1]。99mTc-MDP SPECT全身骨显像是前列腺癌骨转移最常用的检测方法,由于其较高的灵敏度,几十年来一直被广泛应用于临床[2]。《中国泌尿外科和男科疾病诊断治疗指南》认为,一旦前列腺癌诊断明确,建议行全身骨扫描检查[3]。然而,一项基于北京市人群的临床研究表明,初诊前列腺癌患者骨扫描阳性率低于30%[4]。虽然全身骨扫描检查具有较高的灵敏度,但不必要的全身骨扫描检查会使患者受到辐射暴露,因此通过更经济便捷的临床指标,筛选出前列腺癌骨转移高风险患者具有重要的临床意义。国内外大量研究表明,免疫炎症、凝血止血、营养状况等指标与肿瘤的发生、发展有关[5-7]。肿瘤细胞能够与炎症细胞相互影响产生炎性因子,从而调节肿瘤的发生、发展[8]。凝血系统通过帮助肿瘤细胞逃脱体内免疫系统的监视而提高肿瘤侵袭力[9]。白蛋白在恶性肿瘤的发生、发展过程中普遍降低,能够早期提示全身的营养状况[10]。本文通过探讨免疫炎症、凝血止血、营养状况等指标联合传统指标对前列腺癌骨转移患者的预测价值,以期为临床早期发现前列腺癌骨转移高风险患者,以及合理选择全身骨扫描检查提供一定的指导和帮助。
对象与方法
一、研究对象
回顾性分析2019年1月至2021年12月在苏州大学附属第一医院初诊为前列腺癌的657例患者资料,所有患者行超声引导下经直肠前列腺穿刺或磁共振-超声融合引导下经会阴前列腺穿刺确诊为前列腺癌。根据全身骨扫描检查结果,将患者分为骨转移组(124例)和非骨转移组(533例)。
二、纳入和排除标准
纳入标准:①初次行经会阴或经直肠前列腺穿刺活检术,并由两名或两名以上病理科医生诊断为前列腺癌;②均于我院行99mTc-MDP SPECT全身骨显像检查,并由两名或两名以上核医学科医生判断是否发生骨转移。
排除标准:①合并其他恶性肿瘤;②合并感染性疾病或血液系统疾病;③凝血功能障碍或长期口服抗凝药物未提前停用;④长期服用激素或合并先天性骨疾病;⑤临床资料不全。
三、纳入指标及采用标准
于前列腺穿刺术前1周内,收集患者的清晨空腹静脉血,检测指标包括中性粒细胞(参考范围1.80×109/L~6.30×109/L)、单核细胞(参考范围0.10×109/L~0.60×109/L)、淋巴细胞(参考范围1.10×109/L~3.20×109/L)、纤维蛋白原(参考范围1.8~3.5 g/L)、白蛋白(参考范围4.0~5.5 g/dl)、血磷(参考范围0.85~1.51 mmol/L)、血钙(参考范围2.11~2.52 mmol/L)、碱性磷酸酶(alkaline phosphatase, ALP)(参考范围50~135 U/L)、总前列腺特异性抗原(total prostate specific antigen, tPSA)(参考范围0~4 ng/ml);并计算全身炎症反应指数(systemic inflammation response index, SIRI)和纤维蛋白原与白蛋白比值(fibrinogen-to-albumin ration, FAR),SIRI=中性粒细胞计数×单核细胞计数/淋巴细胞计数,FAR=纤维蛋白原/白蛋白。采用Gleason分级系统确定病理分级,将主要病变区和次要病变区所得分数的总和作为组织学评分。临床分期采用美国癌症联合会(American point Committee on Cancer, AJCC)第8版前列腺癌TNM分期系统。
四、统计学方法
应用SPSS 26.0软件处理数据,首先对计量资料进行正态性分布检验,正态分布检验方法采用K-S检验,符合正态分布的数据用均数±标准差表示,不符合正态分布的数据用中位数及四分位间距表示;计数资料采用例数或构成比表示。对于正态分布的资料采用t检验进行组间比较,对于非正态分布资料则采用Mann-WhitneyU秩和检验,对收集到的资料进行单因素Logistic回归分析后,将差异具有统计学意义的指标进行多因素Logistic回归分析,确定前列腺癌骨转移的独立危险因素,绘制受试者工作特征(receiver operating characteristic, ROC)曲线并计算各预测指标的ROC曲线下面积(area under curve, AUC)、敏感度及特异性。
结 果
一、前列腺癌骨转移部位的分布特征
124例前列腺癌骨转移患者中,20例(16.13%)为单发骨转移,104例(83.87%)为多发骨转移。前列腺癌骨转移部位发生率由高到低依次为髂骨88例(70.97%)、耻骨81例(65.32%)、坐骨76例(61.29%)、肋骨71例(57.26%)、胸椎61例(49.19%)、骶椎60例(48.39%)、腰椎55(44.35%)、股骨54例(43.35%)、颈椎50例(40.32%)、肩胛骨45例(36.29%)、胸骨45例(36.29%)、肱骨44例(35.48%)、锁骨42例(33.87%)、颅骨40例(32.26%),依据以上统计数据进行绘图,具体见图1、2。
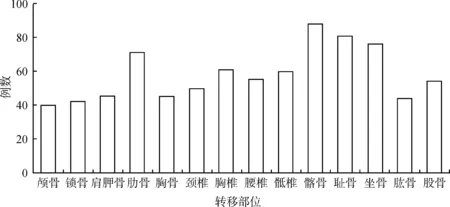
图1 前列腺癌骨转移部位分布柱状图
图2 前列腺癌骨转移部位分布热图
二、患者临床基线资料及组间比较
将患者年龄、SIRI、FAR、血磷、血钙、ALP作为计量资料纳入分析,Gleason评分、临床分期作为计数资料纳入分析,由于大部分患者tPSA>100 ng/ml时无法统计到具体数值,遂将tPSA作为计数资料纳入分析。由于所有的计量资料均不符合正态分布,遂采用秩和检验进行描述性统计,秩和检验结果显示两组的年龄、血钙水平差异无统计学意义(P>0.05),两组的SIRI、FAR、ALP、血磷水平差异有统计学意义(P<0.05)。计数资料使用卡方检验进行统计分析,结果显示两组的tPSA、Gleason评分及临床分期差异有统计学意义(P<0.05)。见表1。
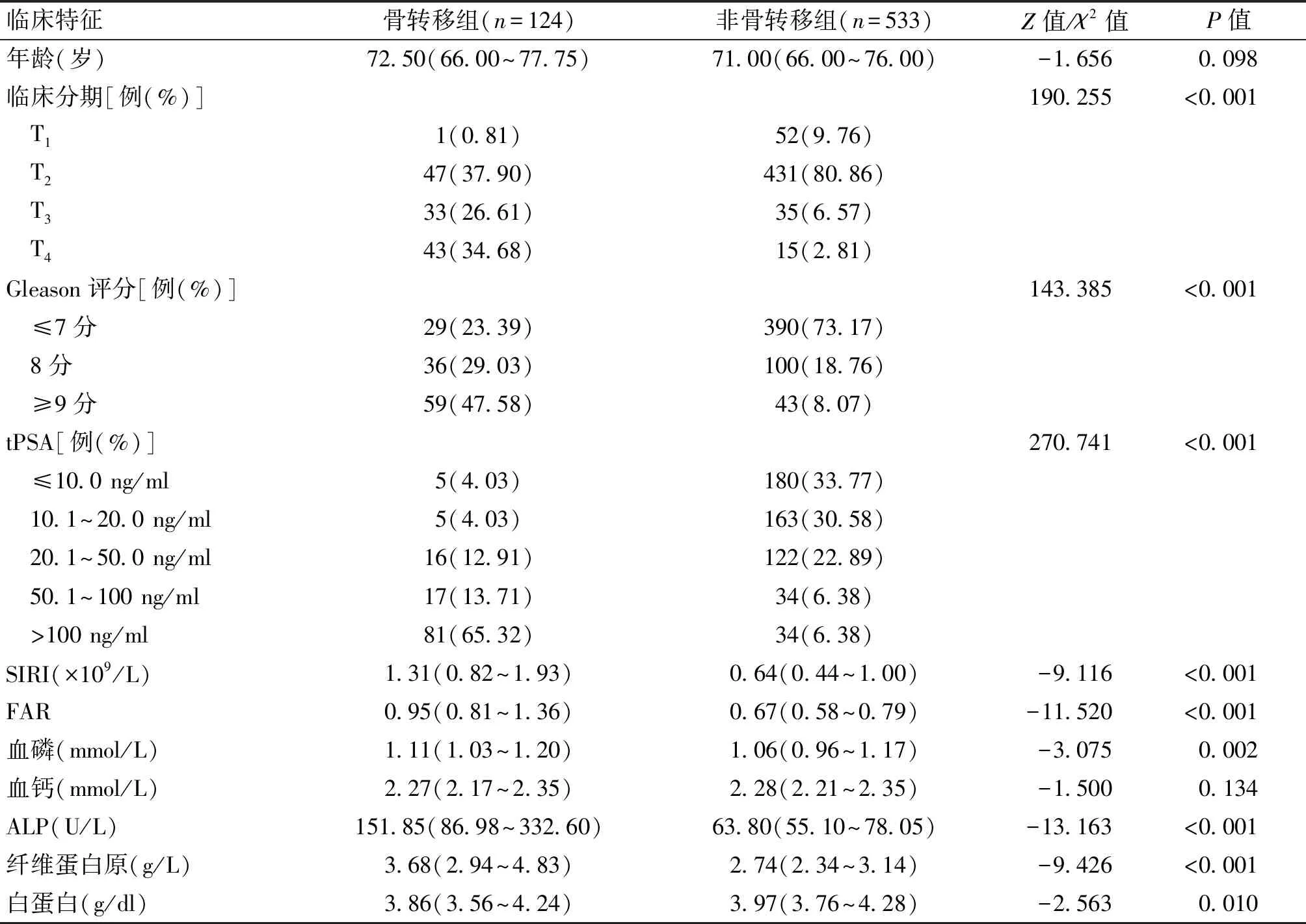
表1 前列腺癌患者基线资料及组间比较
三、单因素及多因素Logistic回归分析
对连续变量进行标准化后,单因素Logistic回归分析表明SIRI、FAR、血磷、ALP、tPSA、Gleason评分及临床分期与前列腺癌骨转移显著相关(P<0.05)。将上述变量纳入多因素Logistic回归分析,分析结果表明SIRI、FAR和ALP的OR值及95%CI分别为1.870(1.391~2.515)、2.010(1.432~2.820)和3.744(2.451~5.720),分类变量tPSA(以≤10.0 ng/ml为参考)>100 ng/ml(OR=7.456,95%CI:4.683~19.830)、Gleason评分(以≤7分为参考)≥9分(OR=4.511,95%CI:1.777~8.452)以及临床分期(以T1为参考)T4(OR=6.825,95%CI:2.454~18.784)是前列腺癌骨转移的独立危险因素(P<0.05),见表2。

表2 单因素及多因素Logistic回归分析结果
四、ROC曲线
SIRI、FAR、ALP、tPSA、Gleason评分、临床分期6个独立危险因素中,tPSA的AUC为0.881,ALP、FAR、Gleason评分、临床分期、SIRI的AUC分别为0.879、0.832、0.782、0.782和0.763。将6个独立危险因素构建综合预测模型,其AUC为0.971,大于所有单个的预测指标,且具有较高的敏感度(0.927)和特异性(0.904)。各个预测指标的AUC的差异性分析表明,综合模型与所有单个预测指标的AUC均具有显著差异(P<0.001)。见表3、4及图3。
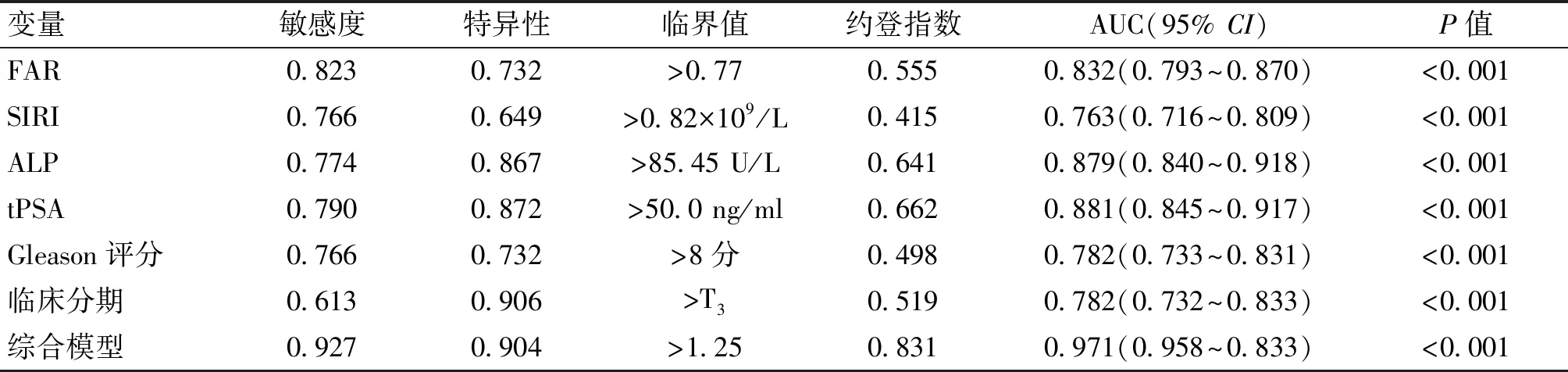
表3 ROC曲线参数特征
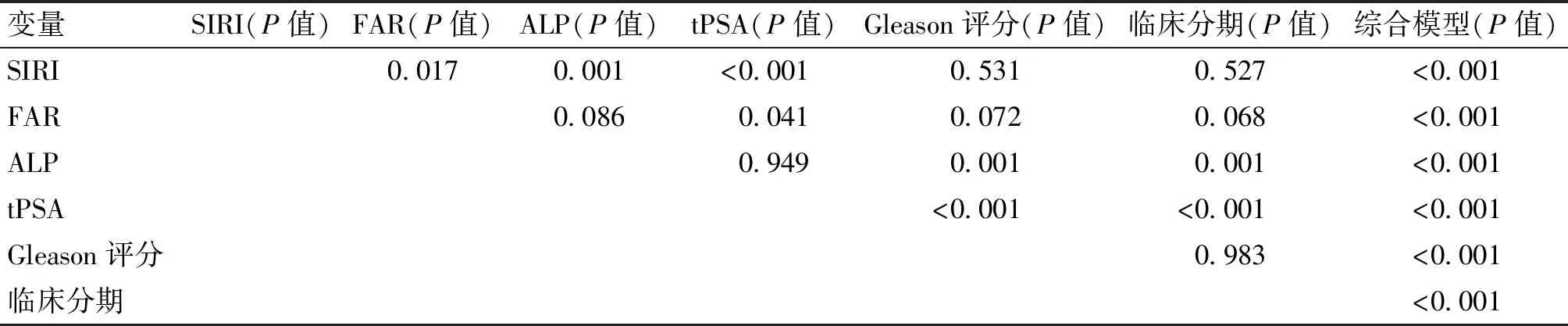
表4 各个预测指标的AUC的差异性检验结果
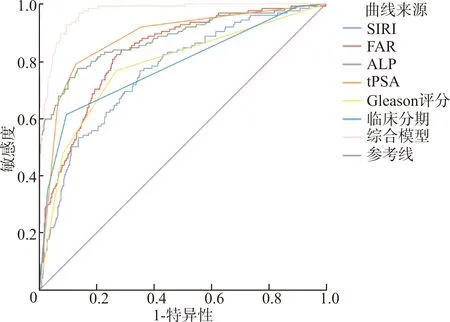
图3 前列腺癌骨转移危险因素的ROC曲线
讨 论
前列腺癌是全球男性发病率排名第二和死亡率排名第五的恶性肿瘤,据统计,2020年全球约有140万新发病例和37.5万死亡病例[1]。前列腺癌早期易发生骨转移,欧美国家人群中约有3%~10%的初诊前列腺癌患者发生骨转移,而在我国这一比例高达13.3%~16%[11]。本研究中初诊前列腺癌发生骨转移的概率为18.9%(124/657)。前列腺癌患者发生骨转移将会引起一系列的骨相关事件如骨痛、病理性骨折以及神经压迫等,极大影响了患者的生存质量[12]。99mTc-MDP SPECT全身骨显像是评价前列腺癌骨转移最常使用的检查手段,因其敏感度较高,一直被广泛应用于临床。但由于受到如创伤、退行性疾病、炎症性疾病的影响,其特异性较差[13]。且并不是所有的初诊前列腺癌患者都需要行全身骨扫描检查,过度的全身骨扫描检查将增加患者不必要的辐射暴露,并加重患者的经济负担。因此,通过经济便捷的临床指标,筛选出需要行全身骨扫描检查的初诊前列腺癌患者具有重要意义。
癌症和炎症之间的联系最早是在 19 世纪由德国医生Virchow提出的,其观察到肿瘤通常出现在慢性炎症部位,并且发现炎性细胞存在于活检到的肿瘤样本中[14]。事实上,在慢性炎症疾病发作期间,人类易患多种癌症,包括前列腺癌、肝癌、膀胱癌、卵巢癌、乳腺癌、肠癌、胃癌和皮肤癌等。据估计,慢性炎症导致肿瘤转化,约占全球癌症总数的 15%[15]。SIRI包括外周血中的中性粒细胞、淋巴细胞和单核细胞,是对全身炎症的集中反映,其指标的变化影响着多种癌症的发生、发展和预后。朱梦柳等[16]进行的一项针对785例乳腺癌患者的临床研究表明SIRI是乳腺癌的独立有效预测因素,低SIRI的乳腺癌患者有着更好的预后。国内的另一项临床研究证实高SIRI是肾癌预后不良的独立危险因素[17]。本研究中,前列腺癌骨转移组SIRI中位数为1.31×109/L(0.82×109/L~1.93×109/L),明显高于非骨转移组[0.64×109/L(0.44×109/L~1.00×109/L)],差异具有统计学意义(P<0.001),多因素Logistic回归分析结果表明,SIRI是前列腺癌骨转移的独立危险因素(P<0.001)。因此,高SIRI与前列腺癌是否发生骨转移存在一定的关联。
除炎症外,凝血功能障碍和营养状况不良也与恶性肿瘤的发生、发展有关。FAR被认为与多种肿瘤的预后相关。国内何咏梅等[18]进行的一项临床研究表明FAR在良性卵巢肿瘤和卵巢癌、复发性卵巢癌和非复发性卵巢癌之间表达水平不同,且FAR是卵巢癌预后的独立危险因素。本研究中前列腺癌骨转移组FAR中位数为0.95(0.81~1.36),非骨转移组FAR中位数为0.67(0.58~0.79),两组差异具有统计学意义(P<0.001)。多因素Logistic回归分析结果表明,FAR是前列腺癌骨转移的独立危险因素(P<0.001)。由此可见,前列腺癌是否骨转移与FAR水平存在一定的关联。
ALP是一种主要来源于骨骼、肝脏的单脂磷酸水解酶,已被证明在患有骨转移的癌症患者中升高[19]。骨微环境中的癌细胞可以形成成骨细胞样细胞表型,可直接导致ALP水平升高,随着骨转移的进展,ALP逐渐被释放到血液和尿液中[20]。ALP对前列腺癌骨转移的诊断有着很高的特异性,但其敏感度相对较低,可因其他骨骼疾病而出现变化。国外Wynenga等[21]进行的一项针对363例前列腺癌患者的临床研究表明,当ALP>90 U/L时,约有60%的前列腺癌骨转移患者被诊断为骨转移阳性。在本研究中,ALP>85.45 U/L,约有77%的前列腺癌骨转移患者诊断为骨转移阳性。ALP在其最佳诊断临界值时,敏感度为0.774,特异性为0.867。因此,ALP可作为检测前列腺癌骨转移的可靠标志物。
Gleason评分、tPSA、临床分期作为前列腺癌骨转移的传统预测指标,在前列腺癌骨转移的诊断预测中被广泛研究。本研究发现前列腺癌骨转移组和非骨转移组的tPSA、Gleason评分、临床分期差异有统计学意义,多因素Logistic回归分析结果表明这3个指标是前列腺癌骨转移的独立影响因素(P<0.001)。本研究通过外周血指标SIRI、FAR和ALP联合传统预测指标tPSA、Gleason评分和临床分期构建综合预测模型对前列腺癌骨转移进行预测,综合模型的敏感度和特异性较高,分别为0.927和0.904,可为临床工作提供一定参考。
本研究也存在一定的局限性。第一,我们将全身骨扫描结果作为前列腺癌是否发生骨转移的金标准,可能会产生一定的假阳性率,对结果的准确性造成一定的影响。第二,外周血白细胞计数可能受到诸如饮食、家族史等其他因素的影响,我们无法完全排除这些因素。第三,本研究为单中心回顾性研究,纳入的病例数较少,未来需要大样本多中心的前瞻性研究来进行结果的验证。
综上所述,我们通过ROC曲线分析发现,外周血指标SIRI、FAR、ALP与传统指标tPSA、Gleason评分、临床分期联合预测前列腺癌骨转移的效能优于单个检测指标,这提示上述指标的联合检测可为临床早期发现前列腺癌骨转移高风险患者提供一定的参考和帮助。
