凝血相关基因及ATⅢ、FIB、DD在肾透明细胞癌诊断、转移及预后中的临床价值
2023-01-03戴政封凯文周毅彬阳东荣薛波新朱进
戴政 封凯文 周毅彬 阳东荣 薛波新 朱进
肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)是成年肾癌中最常见的病理类型,其侵袭、转移能力强,大约1/6的患者在诊断时已发生局部进展或转移[1],因此,早发现、早诊断、早治疗,对于肾癌患者极其重要。有研究报道凝血系统相关指标的变化与胃癌、宫颈癌、胰腺癌及小细胞肺癌等肿瘤的发生、发展相关[2-5],例如:术前纤维蛋白原(fibrinogen, FIB)、D-二聚体(D-dimer, DD)的水平,就与恶性肿瘤的诊断及预后具有显著相关性[6]。同样在肾癌中,有研究表明术前血浆中高FIB水平是肾癌术后患者不良预后的独立预测因素[7]。血浆抗凝血酶Ⅲ(antithrombin Ⅲ, ATⅢ)、FIB及DD是临床上检测凝血和纤溶常用的3个指标。本文对我院108例ccRCC患者的ATⅢ、FIB、DD检测结果进行回顾性分析,并与肾囊肿及肾错构瘤患者的检测结果对比,探讨凝血功能与ccRCC鉴别诊断、肿瘤分期及转移之间的关系;同时分析了肿瘤基因组图谱(The Cancer Genome Atlas, TCGA)数据库中ccRCC患者凝血相关基因的差异性表达以及这些基因对ccRCC患者总生存期(overall survival, OS)和疾病特异性生存期(disease specific survival, DSS)的影响,现报告如下。
对象与方法
一、研究对象
1.本院患者临床资料:回顾性分析本院2011年9月至2021年9月期间经病理学检查确诊的108例ccRCC患者的资料,其中男66例,女42例;年龄20~85岁,平均(58.8±14.0)岁;TNM分期Ⅰ期81例、Ⅱ期14例、Ⅲ期2例、Ⅳ期11例,Ⅳ期患者均已发生远处转移。纳入同期经病理诊断为肾良性肿瘤的患者100例,包括肾囊肿和肾错构瘤各50例。50例肾囊肿患者中,男34例、女16例,年龄24~82岁,平均年龄(54.8±15.2)岁;50例肾错构瘤患者中,男14例、女36例,年龄21~80岁,平均年龄(48.2±14.1)岁。
排除标准:血液系统疾病、血栓栓塞性疾病、近期使用抗凝或抗血小板治疗、急慢性炎症反应、既往有恶性肿瘤病史的患者。
2.TCGA数据库中ccRCC患者资料:相关凝血基因在ccRCC组织与正常肾组织中的表达量以及不同凝血基因表达量的ccRCC患者的OS和DSS数据均来源于TCGA数据库。总共1 074例患者,其中男692例,女382例;年龄26~90岁,平均(60.6±12.1)岁;TNM分期Ⅰ期538例、Ⅱ期114例、Ⅲ期250例、Ⅳ期166例,6例数据缺失;病理类型均为ccRCC。
二、研究方法
于术前抽取患者空腹静脉血,采用Stago自动凝血分析仪测定ATⅢ、FIB及DD含量,检测工作均于采血后2 h内完成,严格按照仪器操作规程及试剂要求进行检测,并比较ccRCC组与肾良性肿瘤组的检测结果;依据TNM分期将ccRCC患者分为转移组(11例)与非转移组(97例),分析两组患者ATⅢ、FIB、DD水平的差异。检测指标参考标准分别为FIB 2.0~4.0 g/L、DD 0~0.5 μg/ml、ATⅢ 75%~130%;肿瘤分期参照2017年美国癌症联合委员会肾癌TNM分期标准。TCGA数据处理:①将ccRCC组织与正常肾组织中的相关凝血基因(F2、F3、F7、F8、ACE、SERPINE1)表达量进行分组,绘制成箱线图并进行比较;②以相关凝血基因(F2、ACE、SERPINE1)在ccRCC组织中的表达量中位数为截断值,将ccRCC患者分为两组(高表达组与低表达组),绘制生存曲线并进行分析。
三、统计学方法

结 果
一、ccRCC组与肾良性肿瘤组的ATⅢ、FIB、DD水平比较
ccRCC组的FIB及DD显著高于肾良性肿瘤组,两组比较差异有统计学意义(P<0.01);两组的ATⅢ比较差异无统计学意义(P>0.05)。见表1。

表1 cRCC组与肾良性肿瘤组ATⅢ、FIB、DD水平比较
二、ATⅢ、FIB、DD区分肾良恶性肿瘤的ROC曲线
ATⅢ区分肾良恶性肿瘤的最佳截断值为101.00,敏感度为55.56%,特异度为58.00%,AUC为0.579(95%CI:0.508~0.647,约登指数为0.136,P=0.047)。FIB区分肾良恶性肿瘤的最佳截断值为3.94,敏感度为31.50%,特异度为95.00%,AUC为0.630(95%CI:0.560~0.695,约登指数为0.265,P<0.001)。DD区分肾良恶性肿瘤的最佳截断值为0.34,敏感度为61.11%,特异度为69.00%,AUC为0.685(95%CI:0.618~0.748,约登指数为0.301,P<0.001)。ATⅢ、FIB、DD这3个指标的AUC组间比较,其中ATⅢ与DD两组比较差异有统计学意义(P=0.046),其他两组(ATⅢ与FIB、FIB与DD)比较差异无统计学意义(P>0.05)。见图1。

图1 ATⅢ、FIB、DD区分肾良恶性肿瘤的ROC曲线
三、转移与非转移ccRCC患者的ATⅢ、FIB、DD水平比较
将108例ccRCC患者分为转移组(11例)与非转移组(97例)。转移患者的ATⅢ明显低于非转移患者,差异具有统计学意义(P<0.01);转移患者的FIB及DD明显高于非转移患者(P<0.01)。见表2。

表2 转移与非转移患者ATⅢ、FIB、DD水平比较
四、相关凝血基因在ccRCC组织与正常肾组织中的差异表达
凝血相关基因(F2、F3、F7、F8、ACE、SERPINE1)在ccRCC组织与正常肾组织中的表达差异有统计学意义(P<0.01),其中ccRCC组织中F3、F7基因的表达显著低于正常肾组织(P<0.01),而F2、F8、ACE、SERPINE1基因的表达显著高于正常肾组织(P<0.01)。见图2。
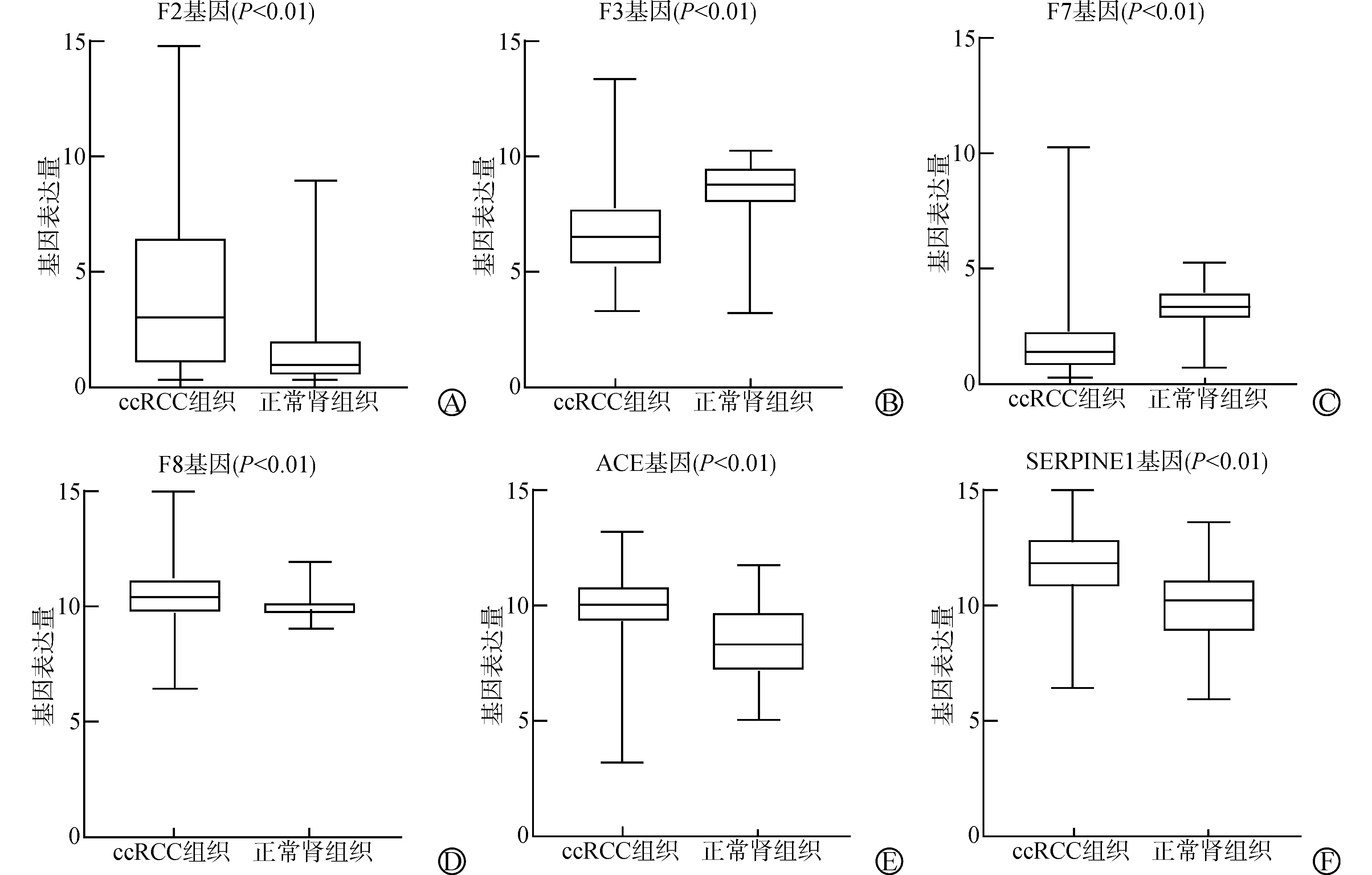
A:F2基因在ccRCC组织与正常肾组织中的差异表达;B:F3基因在ccRCC组织与正常肾组织中的差异表达;C:F7基因在ccRCC组织与正常肾组织中的差异表达;D:F8基因在ccRCC组织与正常肾组织中的差异表达;E:ACE基因在ccRCC组织与正常肾组织中的差异表达;F:SERPINE1基因在ccRCC组织与正常肾组织中的差异表达图2 相关凝血基因在ccRCC组织与正常肾组织中的表达比较
五、凝血相关基因对于ccRCC患者生存的影响
基于TCGA数据库,可以发现不同凝血基因表达量的ccRCC患者OS及DSS差异具有统计学意义(P<0.01)。其中,F2、SERPINE1基因高表达患者的OS及DSS较低表达患者显著降低(P<0.01),而ACE基因高表达患者的OS及DSS较低表达患者显著升高(P<0.01),见图3。F3、F5、F7、F8、F13A1、F13B、THBD、TFPI、SERPIND1、SLC4A1、MTHFR、FGA、FGB、FGG、PLAT等凝血基因与ccRCC患者的OS及DSS同样具有相关性。
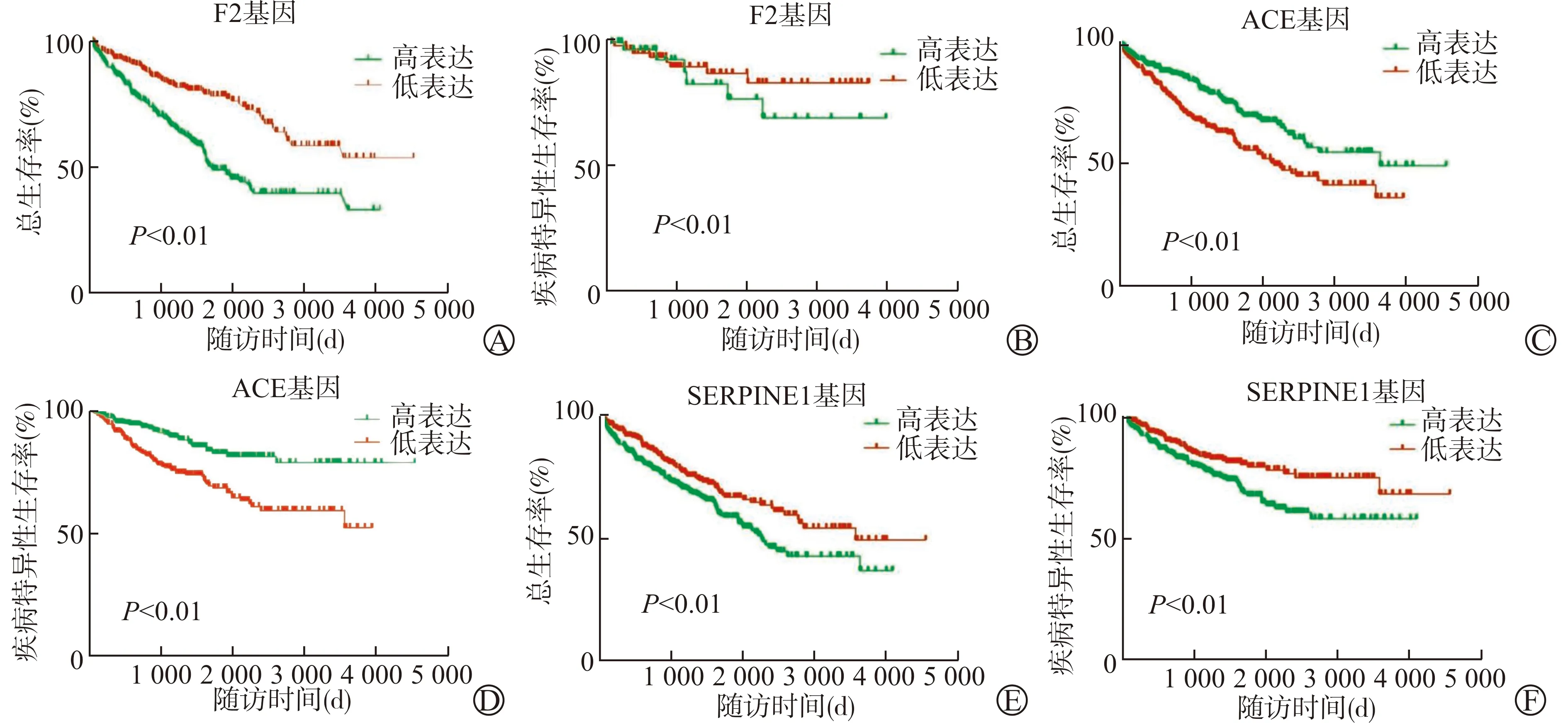
A、B:不同F2基因表达量的ccRCC患者的OS和DSS;C、D:不同ACE基因表达量的ccRCC患者的OS和DSS;E、F:不同SERPINE1基因表达量的ccRCC患者的OS和DSS图3 不同凝血基因表达量的ccRCC患者的OS和DSS
讨 论
据报道,很多肿瘤患者都会出现凝血功能异常,其中也包括肾癌患者[8]。有研究表明术前FIB水平与肾癌患者的预后具有显著相关性[9],血浆DD或FIB水平升高被确定为肾癌患者OS和无病生存率的不利预后因素[10],但是对于依靠凝血指标来鉴别诊断肾良恶性肿瘤以及评估癌细胞是否转移的研究较少。
FIB是由IL-6等炎性因子刺激后在肝脏合成的一种必不可少的凝血因子,在凝血酶的作用下转变成纤维蛋白参与机体的凝血过程,它是凝血级联反应最后一步的靶分子[11]。既往研究显示,FIB是影响患者OS、无病生存率的独立预后因子,并且血浆FIB水平与肾癌的肿瘤大小、肿瘤分级、TNM分期以及转移密切相关[12]。本研究中,ccRCC组患者血清FIB明显高于肾良性肿瘤组,AUC大于0.60,且特异度高,转移患者的FIB明显高于非转移患者,提示FIB的升高与ccRCC的发生、发展及转移相关,也许可作为鉴别肾良恶性肿瘤的一个指标。肾癌患者血浆FIB增高的可能机制[6]:①肾癌患者的肝脏合成功能往往更加活跃,机体在肿瘤及体内释放的IL-6的共同刺激下,可以合成更多的FIB,FIB水平由高到低可作为肿瘤受到抑制的一个信号,而FIB水平继续升高,往往预示肿瘤转移的可能;②肿瘤细胞在血循环中与内皮细胞、血小板等相互作用,释放生物活性物质,促使血小板激活,而血小板被激活时,其α-颗粒含有的FIB释放入血,参与肿瘤的转移;③机体对抗肿瘤是一种系统性炎症反应,FIB作为一种急性期反应蛋白会出现升高。血浆DD是纤维蛋白单体经活化的因子XⅢ交联后,再在纤溶酶的作用下形成的特异性降解产物,DD水平的增高是体内高凝状态和纤溶亢进的重要标志。本研究结果显示ccRCC组患者的DD水平与肾良性肿瘤组有显著性差异(P<0.01),并且其水平在转移患者中显著升高,其对于鉴别肾良恶性肿瘤的诊断效能更大。DD水平在ccRCC患者中显著升高,一方面是由于肿瘤细胞具有较高的纤维蛋白溶解活性,能促进纤维蛋白的降解;另一方面可能是由于包裹肿瘤组织的网状结构被破坏,DD释放入血增多[13]。ATⅢ主要由肝细胞和血管内皮细胞分泌,是人体血浆中主要的生理性抗凝物质,ATⅢ的测定可以作为ccRCC患者出血和血栓栓塞并发症的预后指标。本研究中,发生转移的患者ATⅢ活性显著低于非转移患者,这可能提示ATⅢ的急剧下降与ccRCC转移具有相关性。一部分原因可能是肾癌晚期患者出现了血栓栓塞并发症,ATⅢ的大量消耗已经超过机体的代偿能力[14];也可能是肿瘤转移至肝脏及其他脏器,导致肝细胞和内皮细胞的损伤,进而ATⅢ合成减少[15]。
我们进一步分析了来自TCGA数据库的凝血相关基因,发现它们在ccRCC组织与正常肾组织的表达差异显著(P<0.01),相对于正常肾组织,F2、F8、ACE以及SERPINE1基因在ccRCC组织中高表达,而F3、F7基因在ccRCC组织中低表达;并且还发现了F2及SERPINE1的高表达与ccRCC患者的OS及DSS呈负相关,ACE则相反。Sui等[16]研究发现SERPINE1对ccRCC有较好的诊断价值,ccRCC组织中的SERPINE1表达水平明显高于正常组织,且与预后不良有关,可作为ccRCC新的临床诊断和预后生物标志物。还有研究发现F2基因对ccRCC与正常患者有较好的区分性,其AUC为0.61,且F2的表达与ccRCC患者的OS呈负相关[17],这与我们通过TCGA数据库分析得出的结果相似。基于这些凝血基因的研究,我们可以发现其表达的改变对ccRCC患者的OS及DSS有显著影响,这些影响可能是由于凝血相关基因参与多条关键信号通路,导致基因变量活性的改变,外在指标是凝血功能的改变,这也就解释了临床检验结果的异常,即ATⅢ、DD、FIB等凝血指标的改变。针对肾癌患者凝血功能的异常,研究显示抗凝治疗可以有效的降低肿瘤转移率[18],功能性抑制FIB和其他凝血因子可能是治疗肾癌的新策略,抗凝治疗以及凝血基因发挥作用的机制仍不清楚,其在肾癌发生、发展中的作用机制尚有待进一步研究探讨。
既往研究主要是通过观察术前FIB、DD的水平来对肾癌患者进行预后分析[19],我们在此基础上加入了ATⅢ这个重要凝血指标,并进行了相关的研究分析,结果发现FIB、DD在肾良恶性肿瘤中差异表达,ATⅢ与ccRCC的转移及预后可能相关;相对于既往的预后研究,我们的优势在于可以通过分析FIB、DD水平来辅助诊断影像学发现的肾占位,甚至可能将这些凝血指标的异常作为患者进行影像学检查的依据。肾癌具有异质性,特别是T1、T2期肿瘤,相同分期或分级的预后差别可能很大[20],并且肾癌对放化疗均不敏感,因此肾癌的早期诊断尤其重要[21]。早期肾癌多无临床症状,大多依靠超声进行筛查,不同单位及不同医生的超声诊断水平不一,存在一定的漏诊率,并且目前尚未找到一种明确有效的肿瘤分子标志物用于肾癌的诊断或监测治疗反应[22],而血常规、凝血功能、生化等检查通常在各级医疗机构都能达到一定的质控标准;定期检测基于血液的参数,如ATⅢ、FIB及DD,能够尽早发现凝血功能的异常,进而结合影像学检查来辅助诊断肾癌。这些检测是常规、廉价、易于实现的检测,不需要额外花费昂贵的测序费用,值得进一步推广。本研究主要的不足是样本量不够大,研究属于回顾性分析,不能得出确定的因果关系,并且我们所研究的ccRCC患者的基因表达量来自于TCGA数据库,并非所收集的样本测定而来。未来我们考虑加入更多的多中心样本,将凝血基因、凝血指标与血常规、生化等指标联合,进一步研究其在ccRCC诊断中的价值。
