产丁酸菌的产酸机制及其在调控肠道健康中的作用研究进展
2023-01-03付域泽张乃锋
付域泽,焦 帅,张乃锋
(中国农业科学院饲料研究所 农业农村部饲料生物技术重点开放实验室,北京 100081)
动物消化道内栖息着极其复杂和多样化的微生物群落,这些微生物群落分布在肠道的不同部位并保持着相对稳定和平衡,对宿主健康发挥着重要作用[1]。除了与宿主互作以外,其发酵产物(主要是短链脂肪酸)作为能源物质及炎症、细胞增殖和凋亡的调节剂等,也对宿主产生了多重影响。按代谢产物不同可将这些微生物分为不同的功能类群,比如产乙酸菌、产丙酸菌、产丁酸菌、产乳酸菌等。其中产丁酸菌与一系列微生物失调引发的消化道炎症等现象存在关联,这愈发引起了人们的兴趣[2-3]。Tye等[4]发现,NLPR1炎症小体是肠道产丁酸菌丰度的关键负调节因子,该类菌丰度的下调促进了炎症发生,这种现象引起了研究者的关注。本文从产丁酸菌的生物学分类、产酸机制、肠道炎症调控作用及发展前景等方面做了系统综述,旨在阐明产丁酸菌与宿主健康的互作机制,助力产丁酸菌的深入研究与应用。
1 产丁酸菌概述
对于产丁酸菌的研究具有悠久的历史。早在1930年,McCoy等[5]发现,产丁酸菌能够通过多种发酵方式(碳水化合物、多元醇和糖苷的发酵;乳酸盐的发酵;蛋白质及其衍生物的发酵)产生丁酸,这个过程还伴随有其他代谢产物(乙酸、醇和丙酮等)的产生;2011年,万朕等[6]从酒厂窖泥中成功分离纯化出1株产丁酸菌,该菌在温度为36 ℃、pH为7.0条件下,接种量为5%,产丁酸量在3 d内可高达300 mg·dL-1。近几年,产丁酸菌已经成为行业研究热点[7]。产丁酸菌是严格的厌氧菌,通常被认为难以培养,但近期在研究人员的努力下获得了一些主要菌株的全新信息[8]。丁酸的形成过程在细菌能量代谢中发挥了特殊作用[9],这意味着能量代谢和微生物生态学的某些特征可能在不同产丁酸菌之间存在共享。产丁酸菌的主要发酵产物(丁酸)在维持宿主肠道健康等方面起着关键作用,是结肠黏膜的主要能量来源,也是宿主细胞中基因表达、炎症、细胞分化和凋亡的重要调节剂[10]。
关于产丁酸菌的定义,可概括为:一类能够利用食物(饲料)中不易消化的碳水化合物合成丁酸,通过调控肠道菌群结构、为肠道上皮细胞供能、维护肠黏膜屏障功能、调节宿主免疫功能等调控肠道内环境和微生态平衡,对宿主健康有益的功能性菌群[4]。其广泛存在于消化道的各个部位,包括瘤胃、口腔、结肠和盲肠等[11]。产丁酸菌的代谢产物包括短链脂肪酸(乙酸、丙酸、丁酸)、酶类[12](蛋白酶、淀粉酶、脂肪酶、糖苷酶、纤维素酶)以及维生素B族[13]等,其中丁酸是产丁酸菌的主要代谢产物,也是产丁酸菌发挥功能的主要媒介,在促进肠道发育和维持肠道稳态方面起到了重要作用。
2 产丁酸菌分类学地位
产丁酸菌代表了宿主肠道微生态中的一个功能性群体,而不是一个单系的系统发育群,其在多样性、功能性等方面都是肠道菌群发挥作用的重要体现[14]。产丁酸菌多为革兰阳性厌氧菌。Vital等[15]从整合的微生物基因组数据库中筛选了3 184个测序细菌基因组,鉴定出225种可能产生丁酸的细菌基因组,包括许多以前未知的候选基因。多数候选菌属于厚壁菌门(Firmicutes)内不同的家族[7],但其他的门也存在潜在的产丁酸菌[16],如放线菌门、拟杆菌门、梭杆菌门和变形杆菌门等。厚壁菌门的产丁酸菌在属水平上分布于梭菌属(Clostridium)、真杆菌属(Eubacterium)、罗氏菌属(Roseburia)、粪杆菌属(Faecalibacterium)、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、瘤胃球菌属(Ruminococcus)等。赵广民等[17]利用16S测序技术研究了金华猪和长白猪各肠段主要产丁酸菌相对丰度,发现丁酸球菌属(Butyricicoccus)、丁酸单胞菌属(Butyricimonas)、粪杆菌属(Faecalibacterium)、真杆菌属(Eubacterium)、颤螺旋菌属(Oscillospira) 和罗氏菌属(Roseburia) 相对丰度均低于1%。
3 产丁酸菌的代表性菌种
丁酸梭菌 (Clostridiumbutyricum),又名酪酸梭状芽孢杆菌或丁酸菌,是一种典型的肠道共生菌,以其特有的强产丁酸能力而闻名,也是梭菌属的典型模式菌[18]。丁酸梭菌是受关注和研究最多的产丁酸菌。1933年日本学者首先发现并报道该菌;2003年欧盟批准丁酸梭菌作为肉鸡和断奶仔猪的饲料添加剂;2009年7月我国批准了丁酸梭菌制剂在饲料中作为微生物饲料添加剂使用。该菌属于革兰阳性、厌氧芽孢杆菌,主要以内生孢子形式存在,抗逆性好。菌落表面黏稠,边缘处形成白色或乳白色一圈突起,呈不规则圆形形态,稍突。菌体形态为直杆状,单生。菌体可以产生芽孢,有鞭毛,可以运动[19]。丁酸梭菌的代谢产物有丁酸、乙酸、丙二醇、氢等[12]。
直肠真杆菌(Eubacteriumrectale)属于真杆菌属,可以利用淀粉、葡萄糖和麦芽糖[20],代谢产物主要为丁酸。不但在结肠和粪便中占比最大,同时也具有较为出色的产酸能力[21]。直肠真杆菌于1937年出现在“病原体细菌词典”中,最早发现的VPI 0989T菌株已经丢失,和该菌株来自同一份粪便样本的YPI 0990[22]并没有被正式认可为原始菌株。Duncan和Flint[22]发现的直肠真杆菌(A1-86)呈杆状、革兰阳性、厌氧且可运动。从宏基因组分析,直肠真杆菌属于人类特有菌,包含有4个亚种,其中3个(ErEurasia、ErEurope、ErAsia)在系统发育树中属于大型且明确的单系亚种,第4个是存在于非洲的新亚种(ErAfrica),不同亚种的形成,一定程度上是地理距离隔离产生的结果[23]。
霍氏真杆菌(Eubacteriumhallii)是婴儿肠道中出现最早的产丁酸的细菌之一[24]。霍氏真杆菌能够利用短链寡糖、菊粉等,代谢产物有丙酸、丁酸和次级胆汁酸[25]。霍氏真杆菌与双歧杆菌互作可以更高效地利用L-岩藻糖和岩藻糖乳糖[26]。另外,霍氏真杆菌还能够转化甘油为3-羟基丙醛(3-HPA)[27]。霍氏真杆菌属于真杆菌属,最近被发现的1株名为L2-7T的菌株因其具有不同的表型(DNA杂交值与细胞膜成分)和系统发育特征(与E.halliiDSM 3353T相似度仅有98.0%~98.5%),或许会被重新分类为Anaerobutyricumhallii[28],归属于毛螺旋菌科。
普拉梭菌(Faecalibacteriumprausnitzii)属于粪杆菌属,该菌种下分离株主要包含F.prausnitziiA2-165、F.cf.prausnitziiKLE1255、F.prausnitziiL2-6等。起初,普拉梭菌被归类于梭杆菌属(Fusobacterium),2002年,Duncan等[29]建议将该菌归入粪杆菌属,粪杆菌属的基因组又可以聚为不同的类群(A、B和C簇),多数普拉梭菌归属于这3个类群,不过也有较少的菌株(F.prausnitzii_CNCM_I-4541,F.prausnitzii_CNCM_I-4575,和F.prausnitzii_L2-6)不在此类[30]。普拉梭菌为革兰阴性、专性厌氧、不产芽孢、无鞭毛、无运动性杆菌。扫描电子显微镜图像显示,普拉梭菌模式菌株 A2-165(DSM17677)为约 2 μm 长杆状、两头钝圆的杆菌,其细胞壁外有瘤状突起[31]。2010年完成该菌的基因组测序,平均基因组大小为3.05 Mb,GC含量为56.4%,含有2 745个开放阅读框(open reading frame, ORF)。普拉梭菌能利用果糖、低聚果糖、淀粉和菊粉,不能利用阿拉伯糖、鼠李糖、木糖等;乙酸刺激其生长,产生二氧化碳,不产氢;发酵产物有甲酸、丁酸和D-乳酸[29]。
肠道罗斯拜瑞氏菌(Roseburiaintestinalis)又称为罗氏弧菌,属于罗氏菌属,该菌种的第1株分离株(L1-82T)在2002年被发现。肠道罗斯拜瑞氏菌为革兰阳性菌,微弯曲杆状,有鞭毛,扫描电镜观察下处于活跃运动状态,在体外可产生10 μmol·mL-1的丁酸[29]。肠道罗斯拜瑞氏菌被称作是存在于肠道黏液层的乙酸-丁酸转换器[32],有着将乙酸转化为丁酸的功能,在这个过程中也能检测到甲酸、氢和二氧化碳[29],但并不是主要代谢产物。肠道罗斯拜瑞氏菌是膳食中β-甘露聚糖的主要分解者[33],也能分解木聚糖[34],尤其偏好阿拉伯木聚糖。
4 产丁酸菌的产酸机制
产丁酸菌发挥作用的关键途径之一是作为载体运输活性分子(丁酸)至特定肠道部位发挥靶向调节作用,因此,其产丁酸机制成为研究热点。近年来,研究人员针对产丁酸菌的产酸方式分别总结出了乙酰辅酶A途径、赖氨酸途径、戊二酸途径和4-氨基丁酸途径4种产酸途径[15]。其中,乙酰辅酶A途径是最普遍的产丁酸途径。人体摄入的碳水化合物经过小肠的消化吸收到达结肠,这些复杂的多糖(如淀粉和木聚糖等)通过底物水平磷酸化的方式产生ATP进而被产丁酸菌利用,在这个过程中,碳水化合物产生了丙酮酸、乙酰辅酶A等中间产物。两分子的乙酰辅酶A被硫解酶(Thiolase)催化为乙酰乙酰辅酶A(acetoacetyl-CoA),硫解酶被检测到存在A和B两种基因。随后在Hydroxybutyryl-CoA dehydrogenase(BHBD)的催化下生成3-hydroxybutyryl CoA,3-hydroxybutyryl CoA通过巴豆酸酶(Crotonase)的催化生成crotonyl-CoA,由crotonyl-CoA到丁酰辅酶A(butyryl-CoA)是整个途径的中心通路,因为该步骤也是其他3个途径的共同通路[15]。在这一步骤中,丁酰辅酶A脱氢酶(butyryl-CoA dehydrogenase)的电子转移黄素蛋白复合体(electron-transferring flavoprotein,Etfαβ)提供了电子从而帮助产丁酸菌节约了能源[9],该反应还可能与原核生物和真核生物中脂肪酸的氧化密切相关。由丁酰辅酶A到丁酸的最后一步是由丁酰辅酶A∶乙酸辅酶A转移酶(acetate CoA-transferase)(由But基因编码)或丁酸激酶(butyrate kinase)(由Buk基因编码,丁酰辅酶A磷酸化后)催化的。通常,这两个基因被用作鉴定/检测产丁酸菌菌群的生物标志物[35],目前,可以通过简并引物建立该基因的实时PCR检测方法,从而半定量监测存在于人体结肠微生物中产丁酸菌的动态变化。乙酰辅酶A途径如图1所示。
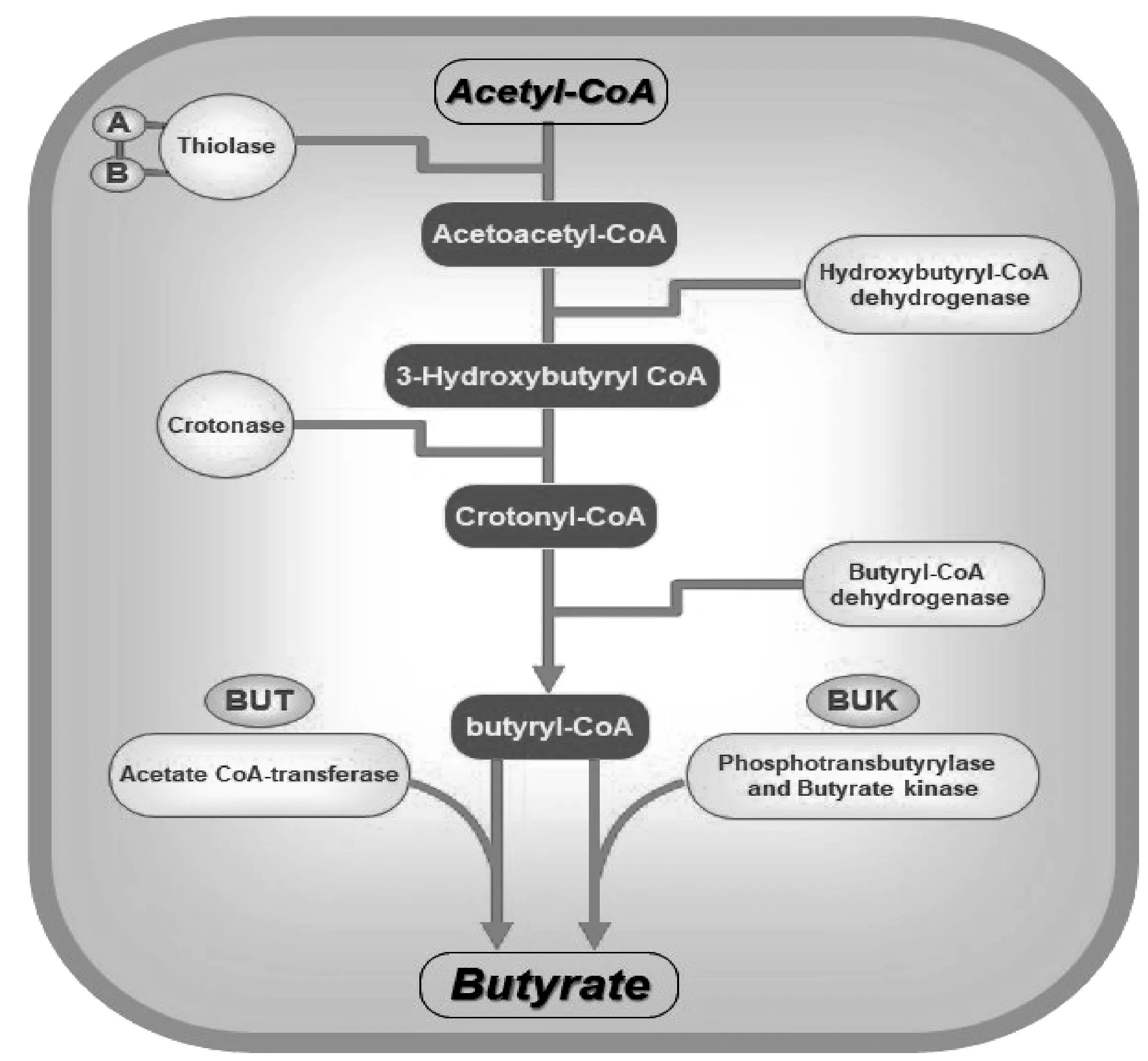
图1 产丁酸菌产酸的乙酰辅酶A途径Fig.1 Acetyl-CoA pathway of acid production by butyrate-producing bacteria
除了乙酰辅酶A途径之外的其它3种产酸途径皆以氨基酸为主要底物,具有代表性的为赖氨酸通路[15]。Bui等[36]利用13C-NMR同位素发现,产丁酸菌能够使赖氨酸的C2与C3残基发生裂解,核磁共振结果显示,赖氨酸几乎转化为等量摩尔质量的丁酸,并且在这个过程中产生了乙酰辅酶A途径的中间产物。从基因表达分析上来看,赖氨酸途径的相关基因包含1个类似操纵子的簇(具有提取利用果糖赖氨酸(fructoselysine) 和阿洛酮糖赖氨酸(psicoselysine)的基因)[37]和1个赖氨酸利用操纵子(可以编码6种参与赖氨酸转化为丁酸的酶)。另外,通过对AF211肠杆菌基因组的分析预测出了全部的14种赖氨酸途径的相关酶,其中包括CoA转移酶AtoD-A、4Hbt和But。通过进一步活性诱导和蛋白质组学分析发现,AtoD-A在赖氨酸降解条件下大量表达,AtoD-A也被认为是赖氨酸途径的关键酶,同时这是肠道生态系统中首次对赖氨酸途径进行描述,因此赖氨酸利用操纵子和已鉴定的ATOD-A基因可能作为赖氨酸途径发生的标志物[36]。赖氨酸途径如图2所示。
根据已有的研究,除了中心通路(crotonyl-CoA到butyryl-CoA)以外,戊二酸途径与4-氨基丁酸途径和其他途径并无共底物,且这两种途径占据总产酸途径的比例很小(平均为2.4%~2.5%)[15]。说明这两种产酸途径相对独立且中间产物不被多数产丁酸菌优先利用。4-氨基丁酸分别在4-hydroxybutyrate dehydrogenase(AbfH)、4-hydroxybutyrate-CoA transferase(4Hbt)和4-hydroxybutyryl dehydratase(AbfD)的作用下生成vinyl-acetyl-CoA。戊二酸途径则由谷氨酸脱氢酶(glutamate dehydrogenase,Gdh)、2-hydroxyglutarate dehydrogenase (L2Hgdh)、glutaconate-CoA transferase (Gct)、2-hydroxyglutaryl-CoA dehydrogenase (HgCoAd)和Glutaconyl-CoA decarboxylase (Gcd)参与反应[38]。两条途径同样在中心通路形成代谢交汇点,值得注意的是,戊二酸在厌氧细菌的利用下可以通过谷氨酸脱羧酶(Glutamate decarboxylase,Gdc)生成4-氨基丁酸[39]。戊二酸途径与4-氨基丁酸途径如图3所示。

图2 产丁酸菌产酸的赖氨酸途径Fig.2 Lysine pathway of acid production by butyrate-producing bacteria
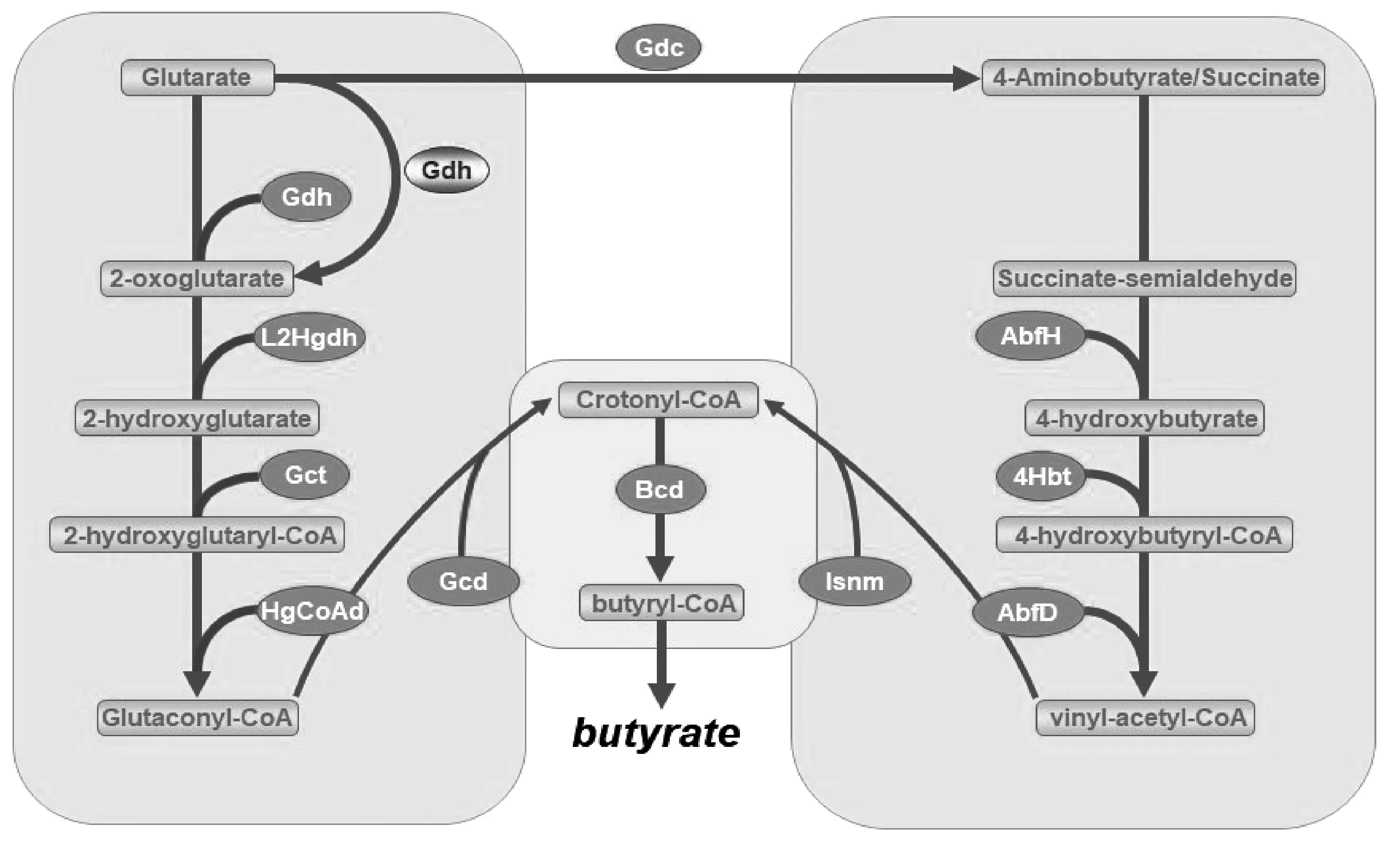
图3 产丁酸菌产酸的戊二酸途径与4-氨基丁酸途径Fig.3 Glutarate and 4-aminobutyrate pathway of acid production by butyrate-producing bacteria
5 产丁酸菌与肠道健康
产丁酸菌对于宿主肠道健康有着重要的意义,往往通过其本身特性以及代谢产物发挥作用。
5.1 产丁酸菌能够与肠道菌群发生营养互作
霍氏真杆菌能够通过形成不同的短链脂肪酸来影响代谢平衡以及肠道菌群稳态[40]。婴儿体内的双歧杆菌可以特异性地利用L-岩藻糖(L-fucose)生成1,2-丙二醇(1,2-propanediol,1,2-PD),双歧杆菌还可以将半乳糖转化为乳酸和乙酸。霍氏真杆菌能够与双歧杆菌发生营养互作,以双歧杆菌产生的乳酸和乙酸为底物生成对肠道有益生作用的丁酸,并能够将1,2-PD转化为丙酸[26]。这种共生现象不但能够使宿主更高效地产生对宿主有益的挥发性脂肪酸,还能够增强共生菌的竞争力,加强双歧杆菌对岩藻糖的利用,间接对致病出血性大肠杆菌(岩藻糖调节其定植)产生抑制作用[41]。普拉梭菌能够与多形拟杆菌(Bacteroidesthetaiotaomicron)发生营养互作。多形拟杆菌产生的乙酸通过上调KLF4转录因子促使杯状细胞分化,普拉梭菌与多形拟杆菌共生下,会利用多形拟杆菌产生的乙酸生成丁酸,削弱对杯状细胞和黏蛋白糖基化的影响,调节上皮细胞分泌系谱中不同类型细胞的比例,从而维持肠道黏膜稳态[42]。
5.2 产丁酸菌能够与致病菌发生竞争拮抗作用
丁酸梭菌能够与致病性大肠杆菌竞争黏附位点。丁酸梭菌细胞内含有的磷脂壁酸(与聚甘油磷酸酯链共价连接的脂质部分)能够锚定上皮细胞的纤维连接蛋白并与之共价连接[43],从而与大肠杆菌抢夺黏附位点,竞争致病菌的生存空间。丁酸梭菌能够富集其它产丁酸菌(瘤胃球菌科和真杆菌属等),并减少致病性拟杆菌门和胆汁酸生物转化菌(bile acid (BA)-biotransforming bacteria)的产生[44]。这是因为丁酸梭菌能够抑制Wnt/β-连环蛋白信号通路并通过丁酸激活特定的丁酸受体(GPR43),从而抑制癌细胞增殖并诱导凋亡[45]。在丁酸梭菌CBM588与艰难梭菌的共培养中,丁酸梭菌通过细胞接触影响了艰难梭菌毒素蛋白的产生,少量的丁酸梭菌CBM588就能够抑制大量艰难梭菌的萌发[46]。
5.3 产丁酸菌能够改善肠道环境
产丁酸菌发酵产生的丁酸一方面能够增加肠道黏蛋白和抗菌肽以及加强紧密连接蛋白的表达[47]、降低肠道通透性从而抑制病原微生物的定植和增殖,防止有害物质进入血液循环,维护肠道健康;另一方面产丁酸菌发酵产生的丁酸通过增加钙水平激活腺苷一磷酸活化的蛋白激酶(AMP-activated protein kinase,AMPK),激活后的AMPK进而分别抑制肌球蛋白II调节轻链(myosin II regulatorylight chain,MLC2)的磷酸化和促进蛋白激酶Cβ2(protein kinase C β2,PKCβ2)的磷酸化,从而促进肠道紧密连接的重组,增强肠黏膜屏障功能[48]。此外,产丁酸菌(Clostridiales)丰度的增加能够抑制NLRP1炎性小体,减少IL-18的分泌,从而维护肠道屏障功能,炎性小体已被证实在响应PAMP和DAMP信号后,激活炎症应答及死亡途径[49]。梭菌属和直肠真杆菌属等产丁酸菌能够以高密度富集于结肠腔内并通过发酵碳水化合物产生大量丁酸,这些丁酸被运输到结肠上皮细胞,在线粒体内以β氧化的形式产生乙酰辅酶A进入TCA循环,导致NAD+还原为NADH,NADH进入电子传递链最终生成ATP[50]。这些能量占正常结肠上皮细胞所需能量的60%~70%。
6 产丁酸菌应用进展
产丁酸菌已经被纳入“下一代益生菌”的范畴[51],其在改善动物生产性能、缓解肠道炎症、增强机体免疫和抗氧化能力以及抵抗、治疗疾病等方面有着广泛的作用。
产丁酸菌在动物养殖上的应用主要体现于丁酸梭菌。在1日龄的肉鸡日粮中添加109CFU丁酸梭菌能够改善肉鸡的生长性能,增强肉鸡的骨骼发育[52];在干物质中添加0.05%的丁酸梭菌也能够改善热应激山羊的瘤胃发酵和生长性能[53];在基础饲粮中添加250 mg·kg-1的丁酸梭菌显著改善了断奶仔猪的肠道健康,增强了仔猪机体的免疫功能[54],但也有不同的研究显示,另1种添加剂量(500 mg·kg-1)的丁酸梭菌对于降低“杜×长×大”的三元杂交断奶仔猪的腹泻率、提高仔猪的生长性能[55]、增强其机体免疫和抗氧化能力[56]具有显著效果。另外,丁酸梭菌一方面能够通过抑制Wnt/β-连环蛋白信号通路和改变肠道菌群组成来抑制结直肠癌(colorectal cancer,CRC)小鼠模型的肠道肿瘤形成[44],另一方面也能通过下调脂肪酸代谢、β-丙氨酸代谢和色氨酸代谢有效改善腹泻症状的发生,且有较高的治疗应答率[57]。丁酸梭菌还能够通过改善运动功能、减少多巴胺神经元丢失、改善突触功能障碍及抑制小胶质细胞激活、提高结肠胰高血糖素样蛋白GLP-1、结肠G蛋白偶联受体GPR41/43和大脑GLP-1受体水平预防和治疗帕金森病[58]。同样,该菌也能用于对抗幽门螺旋杆菌疾病,但其疗效颇具争议,有研究认为丁酸梭菌能够在一定程度上根除幽门螺杆菌[59],也有研究认为根除幽门螺杆菌应综合考虑宿主个体情况[60]。除了丁酸梭菌,直接饲喂其代谢产物丁酸盐也能提高肉鸡[61]、母牛[62]和羔羊[63]的生长性能,对于缓解仔猪腹泻,改善仔猪肠道通透性也有一定效果[64]。
普拉梭菌在动物养殖中应用较少,其研究多集中在炎症性肠病(inflammatory bowel,IBD)患者领域。普拉梭菌最初被注意到是因为在IBD 患者肠道中几乎检测不到其存在[65],也因此被认为是潜在的IBD治疗产品。后续的研究证明,普拉梭菌不但能够分泌抗炎因子(细菌素、15 ku蛋白[66])阻断NF-κB的激活和IL-8的产生[67];也可以增强特异性T细胞的增殖,降低IFN-γ+T的细胞数量[68];还能够增加血浆中的抗TH17细胞因子(IL-10和IL-12),抑制IL-17水平,改善结肠炎的病变[69]。从大量IBD和肠易激综合征(irritable bowel syndrome,IBS)患者的粪便中分析得出,肠道炎症导致的氧化应激使抗氧化生物合成途径减少,胆汁酸代谢发生改变,在这个过程中普拉梭菌或许能成为关键的治疗靶点[67]。
肠道罗斯拜瑞氏菌能够缓解肠道炎症,抑制还未分化的恶性肠细胞[70-71];其通过增加Treg等免疫细胞的数量来上调体内抗炎细胞因子(IL-10、TGF-β、TSLP)的表达和分泌[72],下调促炎细胞因子(TNF-α、IL-1β、IL-6和IL-12)的表达水平并利用其本身结构特性(鞭毛蛋白)来激活H1F1A-AS2等启动子发挥抗炎作用,为治疗IBD提供了新的路径[73]。
7 产丁酸菌应用的影响因素
产丁酸菌作为功能菌和下一代益生菌的候选菌无疑具备良好的应用前景和发展潜力[51, 74],然而产丁酸菌仍然面临诸多问题亟待研究与解决。第一,缺乏足够的动物试验研究:产丁酸菌在动物试验方面存在不足,除了研究较多的丁酸梭菌以外,由于筛选条件困难导致的以普拉梭菌为代表的产丁酸菌在动物应用方面的研究鲜有报道,对于这些产丁酸菌的试验还有待更多的探索;第二,产丁酸菌在动物试验的应用条件并不一致:以丁酸梭菌为代表的饲用微生态制剂其添加形式多种多样,包括物理形态不同(液态和固态)[75]、添加剂量不同[56]以及添加方式不同(单菌制剂、复合菌制剂和酶菌制剂)等,不同的添加形式对于宿主的应用效果存在差异;第三,产丁酸菌的应用宿主差异导致应用效果不一致:丁酸梭菌在仔猪、育肥猪的研究效果多体现在促生长方面,对于禽类养殖则具备改善生长性能、抗氧化能力和免疫功能的作用,对于牛、羊等草食动物的影响体现在肠道健康和免疫调控等方面[76],造成以上差异的具体原因则需要后续研究人员更多的探索。
8 小 结
肠道菌群与宿主间的对话机制成为目前研究的热点[77],产丁酸菌作为肠道菌群发挥功能的重要群体之一,其主要分布于厚壁菌门并通过乙酰辅酶A途径、赖氨酸途径等4种存在交叉的产酸途径产生丁酸从而发挥重要作用。此外,产丁酸菌通过本身特性与肠道菌群发生营养互作和竞争拮抗而影响肠道菌群的结构与丰度,菌群本身的交互作用以及代谢产物还可以改善肠道环境促进肠道健康,对宿主炎症性肠病、肠易激综合征等多种疾病具有重要的治疗和预防意义。但除了本文所概述的产丁酸菌应用进展之外,探明产丁酸菌影响应用进展的新因素以及更多的动物试验研究参考同样具有重要意义。
