家禽全基因组关联分析研究进展
2023-01-03施俊安刘凌斌王丽辉
施俊安,刘凌斌,王丽辉
(1.重庆市畜牧科学院,重庆 402460;2.西南大学动物科学技术学院,重庆 400715)
全基因组关联分析(Genome-wide association analysis,GWAS)是以生物体基因组中的单核苷酸多态性(Single nucleotide polymorphism,SNP)为分子遗传标记,在全基因组水平上进行对照分析或相关性分析,通过比较发现影响复杂性状的基因变异的一种新策略。GWAS的概念最早是由N.Risch等[1]提出。N.Risch等[1]研究指出,不同位点和复杂疾病之间的连锁研究结果缺乏可复现性,利用候选基因关联分析的效果要优于发现主基因连锁分析,复杂疾病遗传学需要通过大规模关联分析。随后首次在植物[2]和人类[3]上的研究分别揭示了与海甜菜生长性状相关的2个扩增片段长度多态性标记和人类视网膜黄斑病变相关的SNPs,之后GWAS技术开始被大范围运用在生物研究领域中。
我国地形地势多种多样,造就了很多适应不同环境的家禽地方遗传资源,地方品种有着肉质鲜美多汁、抗逆性强、适应性强等优点。随着国民消费水平的提高,对蛋和肉的需求增多,同时加之外来品种市场的冲击,使得地方品种生长缓慢、饲料报酬低、产蛋性能差等劣势也突显出来。随着高通量测序技术和生物信息学技术高速发展,相关育种新技术在家禽领域也积累了大量研究成果。本文对近年来国内外GWAS相关研究进行综述,以期为家禽新品种选育和分子遗传改良提供有效参考。
1 GWAS概述
1.1 GWAS概念
GWAS是以生物体基因组中数以百万计的SNP为分子遗传标记,在全基因组水平上进行对照分析或相关性分析,从而发现影响复杂性状的基因变异的一种新策略。通过高通量和大数据为家禽遗传改良提供方法指导,根据连锁不平衡原理,在全基因组范围搜索关联度高于随机关联的基因序列,随后在统计学理论的指导下,对结果进行分析并找到候选标签的一种方法。
1.2 GWAS常用研究方法及优缺点
根据研究策略不同,GWAS研究可分为单阶段设计和多阶段设计。单阶段设计需要的样本群体很大,每个样本均要进行SNP分型,针对不同研究性状进行SNP相关性分析,需要投入大量资金,适用于基因组小的低等生物;多阶段设计先在小样本群体通过设置相对宽松的阈值筛选显著SNPs,随后在大群体针对这些显著SNPs,进行分型研究,最后结合两次结果分析统计,常用于人类复杂疾病研究[4-5]。根据研究对象不同,GWAS研究可以分为对照-病例分析、随机群体关联分析和不同家系关联分析。这些方法本质上均是比较同一性状的不同表型分组之间的基因差异,对变异位点进行基因分型和频率统计,进而筛选出基因变异和表型之间的最强关联。根据研究性状不同,质量性状一般采用Logistic回归模型;数量性状则采用线性模型。GWAS检测技术主要包括三种。(1)基因芯片。该技术经历了三代变迁,DNA芯片和SNP芯片如今应用广泛,可以检测基因突变位点和新的SNPs,但是需要已知基因组序列。(2)简化基因组。测序覆盖范围小,只有5%左右,会丢失大量有效SNP信息。(3)基因组重测序。重测序技术不需要已知基因组信息,通过对物种基因组重测序获得大量变异信息,随着测序深度增加对SNP的定位精度也增加[6]。GWAS的优点主要有:(1)不需要已知功能基因位置信息便可进行基因组区域定位,通过基因功能注释精确定位相关SNP和候选基因;(2)有助于发现新的生物学机制;(3)研究群体多样化,不局限于样本个体间有关系的群体;(4)数据方便共享和公开,可用的数据有助于新的发现[7]。缺点主要有:(1)结果受测序深度影响很大,不同测序深度得到的结果不尽相同;(2)大部分鉴定的单个SNP对性状贡献很低,是否具有实际意义有待更深地考究;(3)表型是受基因和环境共同影响的,可能同一群体在不同环境下性状表现不同,GWAS在这种情况下普适性不足;(4)GWAS研究需要大量物力和财力投入。
2 GWAS与家禽生长性状
2007年首篇家禽生长相关GWAS通过鉴定极端表型的雄性肉鸡腹部脂肪百分比相关的SNPs,发现上位效应是杂种优势和隐性等位基因表达的共同潜在机制[8],在肥胖差异选择下脂肪形成相关信号通路基因处于强选择状态[9]。孵化后鸡心脏甲基化与孵化时蛋壳温度和环境中CO2浓度相关,可能通过转录因子结合和基因差异甲基化影响心脏生长发育[10],TNFSF11与肠道长度、肝脏和胗或肺的重量显著相关[11]。对肉鸡和蛋鸡进行GWAS筛选,发现基因主要富集在肌肉系统过程和离子转运的负调控过程[12];基于单倍型对鸡的胴体和生长性状进行GWAS,检测到腹脂沉积相关基因SHH和骨骼发育相关基因TNFRSF1B[13],通过检测数量性状基因座(Quantitative trait locus,QTL)定位了JDP2、PLCG1和HNF4a等调控脂肪沉积潜在候选基因[14];GJA1表达变化趋势和胸肌发育过程中重量变化趋势是一致的[15],RBPJ可能与鸡的生长相关[16]。采食行为对体重的影响是最直接的,MINR和HTR2A是采食的主效基因,通过调节采食影响鸡的生长[17];低剩余采食量鸡可能通过减少细胞活动、免疫反应和体力活动的能量消耗优化能量利用[18],gga-miR-15a上游13.55~45.16 kb区域与饲料转化效率显著相关[19]。通过比较180只雄性肉鸡的生长性状、饲料效率性状和代谢效率性状发现5个代 谢 效率性 状 相关QTL[20];G.C.M.Moreira等[21]揭示了鸡饲料效率和体重性状之间的基因组关联并发现11个基因与成骨、骨骼肌发育、生长、能量代谢和脂质代谢相关。基因会通过多种途径影响蛋鸡骨强度[22],GAG1L与骨密度相关,RANKL、ADAMTS和SOST可作为鸡骨质疏松的候选基因[23],同时MXRA8促进小腿骨发育[24],F.Tarsani等[25]对肉仔鸡体重进行GWAS发现14个体重相关基因。对纯种汶上肉鸡[26]和京海黄鸡[27]进行GWAS,分别检测到体重相关SNP和基因LDB2和INTS6,对4个中国地方鸡品种进行GWAS,发现多基因基础和可变遗传结构导致鸡体重具有复杂性[28]。生长发育是一个复杂的生物进程,生长是发育的物质基础,发育成熟状况也反映了生长的量变,机体的正常发育需要所有器官系统的协同发展,因此可以从局部到整体进行基因功能探究。
3 GWAS与家禽肉质性状
随着肉鸡体重越来越大,肉品质的保持便显得尤为重要,刘大鹏等[29]利用“北京鸭×野鸭”的杂交F2代 进 行GWAS,发 现SERP1、SELENOT、EIF2A、TSC22D2、SIAH2是鸭胸肌肉色性状潜在候选基因,并确定SELENOT是影响肌肉黄度的候选基因,BCMO1与胸肌肉色性状相关[30];PIK3C2A、MAP3K13和LOC10174362可以作为屠体性状的候选基因[31];ATP11A是脂肪型北京鸭屠体重、全净膛重、半净膛重和翅重性状的候选基因[32]。在京海黄鸡上发现FAM184B、QDPR和LDB2等基因和屠宰性状相关[33],同时FAM124A、QDPR和LDB2等与上市体重存在相关[34],PGO2、SMARCA2和ZNF302等 和 翅 重 显 著 相 关[35],LOC101747478、CBLN2、HPGDS等与肉质性状相关[36],GRIK1、NCAPG和KCNIP4等 与 体 组 成 相关[37]。随着人们消费习惯的升级,现有肉鸡品种远远不能满足多元化需要以及不断发展的市场需求,高度专门化新品系的培育及优质高效的新品种(配套系)的组建是未来鸡育种目标的方向,这些候选基因的鉴定为后续的标记辅助选择和分子育种改良提供有效参考。
4 GWAS与家禽繁殖性状
4.1 GWAS与产蛋性状
对白来航蛋鸡和矮脚褐壳蛋鸡进行GWAS表明多个SNP显著影响产蛋和蛋品质[38],发现产蛋相关基因CDK1[39];FAM184B[40]等多个基因可能对京海黄鸡繁殖性状有着不同程度影响[41]。Shen M.M.等[42]通过GWAS定位了5个基因决定输卵管特征,可以增进对输卵管发育分子调控的理解;连锁分析发现MIR1809、MIR6612和MIR6671影响北京油鸡性腺发育[43];在对白来航鸡和东乡绿壳蛋鸡进行遗传差异的鉴别中发现,ROBO1基因与卵泡发育有关[44]。一项京红蛋鸡产蛋性状GWAS表明RAPGEF6和产蛋后期产蛋率显著相关[45],且3号和13号染色体上有12个SNP与产蛋后期受精率显著相关[46]。DTNC2H1和TLL1分别与俄罗斯白鸡初产日龄和蛋重相关[47],GTF2A1、CLSPN和CALM1影响产蛋性状[48],对东乡绿壳蛋鸡和白来航鸡的生长和产蛋性状进行GWAS,找到性染色体上DGKQ可能与类固醇激素系统相互作用影响25~45周总产蛋数[16]。小黄卵泡数量和DCLK1、NBEA和SMAD9有关,AMH和RGS3可以作为小黄卵泡预后生物标志物[49],POLA1和PDK3等是产蛋数相关候选基因[50]。一个蛋的生产从排卵至产出整个过程每一环节都很重要,通过对相关性状进行进一步遗传改良必定会提升家禽繁殖性能。
4.2 GWAS与蛋品质性状
蛋品质性状主要包括外部品质和内部品质[51],外部品质主要包括蛋壳厚度、蛋壳强度、蛋壳颜色、蛋壳光滑度以及蛋的形状等,内部品质主要包括蛋白浓度、蛋黄颜色以及营养素含量和胆固醇含量等[52]。对褐壳蛋鸡系一个独特资源群体进行GWAS,发现第2、12和17号染色体上QTL区域分别与蛋白高度(AH)、壳色(ESC)和产蛋量相关[53];MSX2在蛋白质形成过程中间接影响AH和哈夫单位,而RHOA通过系统发育过程影响ESC[54]。在蛋壳强度方面,A.Wolc等[55]研究发现CAPN等多个与蛋壳形成相关的基因,SLC25A32被证实是形成斑点蛋的候选基因之一[56];对蛋壳超微结构进行GWAS,检测到719、784、1个和10个SNP分别与蛋壳厚度(EST)、有效层厚度(ET)、乳头层厚度(MT)和乳头密度(MD)显著相关,ABCC9可能调控EST和ET,而ITM2C和KNDC1分 别 影 响MT和MD[57]。SHROOM3作为细胞骨架蛋白编码基因,对蛋重有着显著影响,ARL8A参与GTPase信号通路影响蛋壳厚度,HAS2与蛋壳颜色存在相关性[16],AJAP1表达量的高低决定绿壳蛋蓝色深浅[58]。需求决定市场,市场决定研究方向,通过GWAS可以显著推动蛋品质性状的后期选育,以满足人们多样化需求。
4.3 GWAS与孵化性状
种蛋受精率和孵化率直接决定下一批雏禽的生产性能和企业产能,樊庆灿[59]发现PCNX和CDCA7是京海黄鸡蛋孵化率相关候选基因,曹海月等[60]对比宁海黄鸡和广西黄鸡找到ST8SIA1、ENC1、LOC101750905与死胚蛋数、受精率、入孵蛋孵化率和受精蛋孵化率相关。但从仅有的少量结果看来,孵化相关性状的研究并不充分,需要进一步提高质与量,才能在将来推动孵化性状的遗传改良。
5 GWAS与家禽免疫性状
细胞介导免疫会导致细胞内抗原破坏和宿主细胞的清除,使得动物可以抵抗外源性抗原,一项在鸡上的细胞介导免疫应答GWAS发现UBASH3B、CRTAM和MRPL21等基因在抗原加工呈递、中间丝和蛋白丝途径显著富集[61]。钥孔血蓝蛋白(Keyhole limpet hemocyanin,KLH)与天然抗体(Natural antibodies,NAb)的结合水平与鸡存活率相关,TLR1A和KLH-Blinding IgM NAb浓度显著相关,通过对KLH结合的NAb进行选择性育种可以提高鸡综合抗性进而提高其存活率[62],JARID2、RBMS3、GPC3和TRIB2与白来航鸡免疫性状相关[44]。禽流感、新城疫、寄生虫病和腹水综合征等是家禽生产中常见疾病,它们每年给养禽业造成了巨大的经济损失。鸡对高致病性禽流感的抗性是一个复杂的多基因性状且存在群体特异性[63],因此并不能很好地预测其遗传多样性[64],Sun Y.等[65]定位了两个禽流感病毒抗体效价相关的基因LYRM4和KTN1。Z染色体上存在179 kb区域,含有3个SNP与红细胞体积分布宽度相关,该指标和机体贫血相关,代表了机体血液携氧能力的强弱,当机体含氧量不足时会导致肺动脉压升高、右心室肥大、腹腔和心周积液,诱发腹水综合征,MC4R和CDH6可以作为该病的候选基因[66],MC4R在动脉压调节中发挥重要作用,CDH6对胚胎期肾小泡和近端小管发育至关重要,其异常表达将导致肉鸡腹水综合征进展过程中凝血异常和肺部血管病变。对鸡进行新城疫疫苗免疫后发现ROBO1和ROBO2对新城疫病毒抗体应答显著相关[67];鸡白痢是一种雏鸡易感的疾病,NKTR基因和该病显著相关[68],FBXW7、LRBA与该病感染后沙门氏菌抵抗显著相关[69],TRAF3和ggamir-489与宿主载体状态显著相关。鸡肠道微生物GWAS发现感染白痢链球菌后宿主肠道微生物区系发生变化且存在多个免疫相关基因突变[70]。新城疫感染热应激鸡发现CAMK1d、CCDC3和TIRAP等基因与抗体效价相关[71];感染慢性新城疫病毒之后应激过程中CHORDC1影响生长,JAZF1与感染后鸡的生长速率显著相关[72]。首个马立克氏病耐药位点的研究定位了SMOC1和PTPN3与马立克氏病抵抗显著相关[73]。G.Banos等[74]利用GWAS结 合 全 基 因组测序检测到与多个疾病相关的基因,研究表明MAP3K4和绦虫抵抗相关,PTPN1和NFATC2与传染性法氏囊病毒集体应答相关[75]。免疫和疾病是一对不可分割的关系,针对不同疾病需要免疫系统表达不同的基因,但也有少量基因具有多效性,可以对多种疾病发生免疫反应,在一定程度上具有广谱效应。
6 GWAS与外貌特征性状
GWAS是基因水平的研究策略,可以找到与家禽外貌特征相关的基因,这些研究在很大程度上对家禽外貌选育起到了积极的推动作用。阿劳卡纳鸡所特有的两个Iroquois同源异型体基因Irx1和Irx2的错误表达是产生无尾性状的基础[76]。羽毛是一种复杂的皮肤衍生物,对禽类来说极其重要,决定了禽类通讯、防水和调节体温的能力,HOXB8在羽毛发育中有着重要作用[77],SPEF2和PRLR可以作为寿光鸡羽速表型的候选基因[78]。鸡面颊本身的颜色影响着胴体外观,EDN3与信阳绿壳蛋鸡的面部色素沉着相关[79];耳垂也是鸡面颊两侧的一个重要结构,其颜色和自身血管密度息息相关,PIK3CB、TP63和B4GALT1通过调节耳垂血管密度直接导致白色耳垂[80];鸡的羽毛颜色由真黑素和类黑色素的比例决定,NUAK1和SHH在胚胎期神经嵴细胞或成黑素细胞的发育中发挥作用,进而影响真黑素的色素沉着[81],对江西省9个地方品种黑羽的种群结构进行研究,发现9个黑羽候选基因[82],GRM5是鸡羽毛颜色相关的新候选基因[83],2号染色体上CA-BLES1可作为背羽颜色变异的候选基因[84],CCDC171对鹌鹑羽毛颜色存在显著影响[85];足羽作为一种多基因性状,在家鸡和野生鸟类中存在,其特征是踝部和足部的羽毛部分或完全发育,PITX1和TBX5的异常表达和足羽形成有关,其中PITX1通过转录调控影响足羽,而TBX5是足羽发育的关键决定因子[86]。Sun H.Y.等[87]找到参与鸡轮廓羽毛密度遗传控制的5个候选基因,KRT75L4缺失突变导致麒麟鸡生长出卷曲羽毛,降低了羽毛覆盖率和鸡对热环境的适应力[88]。VPS36可能对鸡冠性状有影响[89],冠的颜色和产蛋量间存在着一定关联[90],EDN3和BMP7在鸡的不同颜色冠中存在表达差异,深色冠和鸡低产蛋量的高发生率相关。异常表型研究中发现AOX1和ADAMTSL3调控区突变导致垂冠[91],LMBR1与多趾畸形相关[92],STMN1等与喙畸形显著相关[93]。从家禽外貌特征的研究来看,我国有着得天独厚的优势,有很多的地方品种,其体型外貌均各有特色,是一个有着丰富多样性的基因库,存在着很大的开发潜力。
7 GWAS与其他性状
除了常见生产性状,在其他方面也筛到了候选基因,对7种鸟类和哺乳动物进行GWAS,发现多个基因与鸡驯化后的行为表型相关[94],如SORCS2通过调节多巴胺能通路和神经生长因子在鸡的攻击行为中发挥着重要作用[95],SLC12A9和GNG2与参与啄羽和攻击行为的单胺信号转导通路相关[96]。FOXG1是藏鸡适应高海拔低氧环境主要候选基因[97];白来航蛋鸡1号染色体上存在两个与热应激病死率相关的区域[98];在台湾一个本地肉鸡品系2号染色体上发现15个显著的SNP与热应激条件下的体温相关[99]。鉴定发现LRRK2等基因影响血浆极低密度脂蛋白[100],另外,CPNE4的表达影响井陉黄鸡肌糖原代谢[101]。
8 小结与展望
随着科技不断进步,GWAS也衍生出了针对性不同的技术,包括代谢组GWAS、基因表达GWAS和单倍型GWAS等检测方法[102];越来越多定制芯片的问世,使得全基因组测序所需资金逐步降低,推动了不同物种的基因组测序工作日渐完备。家禽领域全基因组测序也得到了充分发展,把本文中涉及到的家禽生产性状和相关候选基因的关系绘制成网络图,见图1。
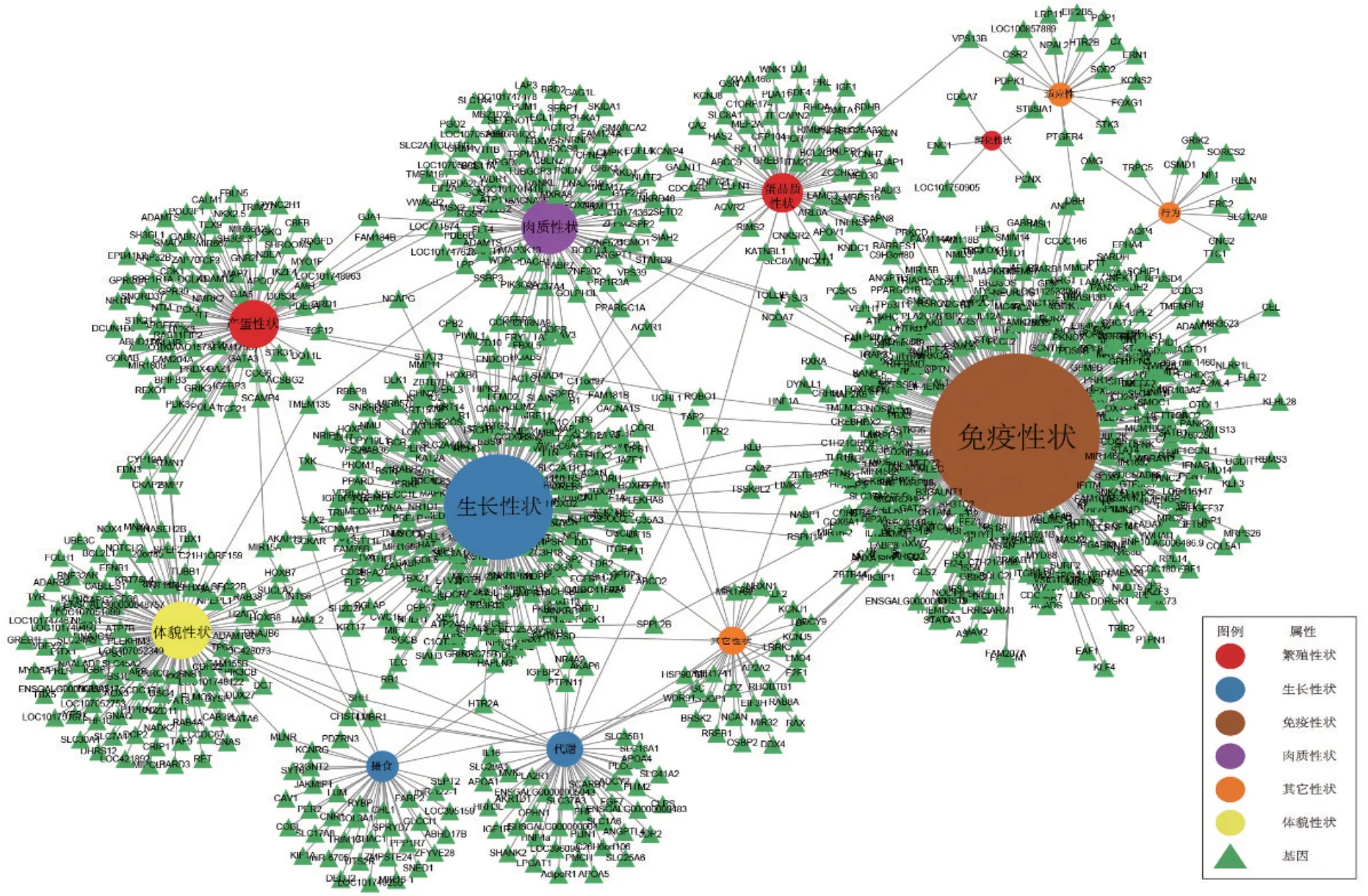
图1 家禽主要经济性状与候选基因
从图1中可以看到家禽的生长、肉质、繁殖、免疫等性状均受到多个基因影响,说明这些性状是数量性状,由多个基因共同调控;同时也存在一个基因对应多个性状的现象,说明这些基因具有多效性,能影响或调控多个性状的形成,这也从侧面反映这些性状涉及的生理生化过程是相互联系和相互依赖的。由于GWAS是大范围的检测,只提示某些基因与目标性状具有关联性,但候选基因在性状发生发展中的具体作用机制还需大量功能试验探究;另一方面,伴随着技术和统计学方法不断优化,GWAS必然需要不断推陈出新,以适应未来更多的样本量和更复杂的群体分层结构。
