核苷磷酸化酶的工程菌构建
2022-12-29段佩玲王振宇刘国生
段佩玲,王振宇,刘国生
(1.郑州铁路职业技术学院,河南 郑州 451460;2.河南师范大学生命科学学院,河南 新乡 453007)
核苷类物质是抗肿瘤、抗病毒类药物的重要来源。目前,核苷类化合物主要是通过发酵法、化学法、生物催化等方法进行合成。其中,发酵合成法难度较大,此方法既要考虑反馈调节机制,还需要考虑相关酶系的控制[1-2];化学合成法过程中存在的问题较多,如反应环节多、反应条件不易控制等,而且须用到有机溶剂、重金属等有毒化合物,因此对实验人员及环境都易造成相当大的危害[3];生物催化方法与上述两种方法比较具有较大优势,主要是因为其反应条件温和、合成效率高、对环境危害小。
阿糖鸟苷(ara-G)是一种能够降低T细胞白血病细胞活性[4-5]的重要核苷类药物,可以作为奈拉滨等药物的前药。阿糖鸟苷生物催化过程中主要涉及的酶包括核苷磷酸化酶和N-脱氧核糖转移酶[6],但这些酶在野生微生物菌株含量一般都较低,而且多种酶往往同时存在,致使其生物催化反应过程受到限制,且存在产物多样性等诸多问题。基于上述原因,将来源不同的PNPase基因通过基因工程手段[7-8]进行重组构建工程菌,通过提高酶活来参与相应的核苷转化反应。相关研究认为,阿糖鸟苷生物催化合成使用“两步法”[9]:第一步为关键环节,是以阿糖尿苷(uracil arabinoside)和二氨基嘌呤为底物合成阿糖二氨基嘌呤核苷(diaminopurine arabinoside);第二步主要是由PNPase(嘌呤核苷磷酸化酶)催化ara-U转化ara-DA。本研究利用基因重组技术将PNPase(嘌呤核苷磷酸化酶)基因deoD导入E.coli BL21(DE3),以此构建工程菌株E.coli(deoD),为生物转化阿糖鸟苷提供参考。
1 仪器与材料
1.1 仪器
PCR仪(Applied Biosystems)、高速冷冻离心机(Eppendorf)、凝胶成像分析系统(WD-9413B)。
1.2 试剂
DNA抽提试剂盒、克隆试剂(TaKaRa)、表达试剂(Salarbio)、细菌基因组质粒pMD18-T、质粒 p ET-28a(+)、E.coli BL21(DE3)感受态细胞与E.coli DH5α感受态细胞(宝生物工程有限公司)、二氨基嘌呤和阿糖尿苷(新乡拓新科技有限公司),其他试剂均为分析纯。
2 方法与步骤
2.1 菌株活化和基因组提取
埃希氏菌E.coli AEM0812菌体经LB液体培养基37℃过夜培养后,选取合适浓度梯度涂布于LB固体培养基中,于36℃培养24小时,再次接种于LB液体培养基,36℃培养8~12小时。利用细菌基因组抽提试剂盒来抽提DNA。
2.2 引物设计和基因扩增
根据数据库Genbank中搜索的目的基因序列,通过引物设计软件与pMD18-T质粒图谱设计PCR扩增引物。5′端引物CCCATGGGATGGCTACCCCACACATTAAT,下划线部分为Nco I酶切位点。3′端引物CCTCGAGGTTACTCTTTATCGCCCAGCA,下划线部分为 Xho I的酶切位点。
deoD基因扩增条件:93℃预变性50~55秒,94℃变性30~35秒,50℃退火40秒,72℃延伸60秒;循环次数30。最后再延伸10分钟。采用琼脂糖凝胶电泳验证,如图1所示(M为DNA marker)。

图1 嘌呤核苷磷酸化酶基因PCR扩增结果
2.3 克隆载体pMD18-T-deoD的构建
将所得目的基因deoD进行纯化后,按照一定比例与pMD18-T质粒混合,17℃放35min进行连接反应以构建pMD18-T-deoD克隆载体。将克隆载体转化至感受态E.coli DH5α细胞,然后接种到通过含有对应抗生素的固体培养基36℃过夜培养,再经过LB液体培养基培养后利用试剂盒抽提质粒。Xho I和Nco I双酶切后进行电泳分析,在约730bp和2600bp处有两条条带,如图2所示(M为DNA marker,1为重组质粒p MD18-T-deoD)。对目的基因deoD进行DNA测序比对,结果与图1测序结果一致,证明重组质粒pMD18-T-deoD构建成功。
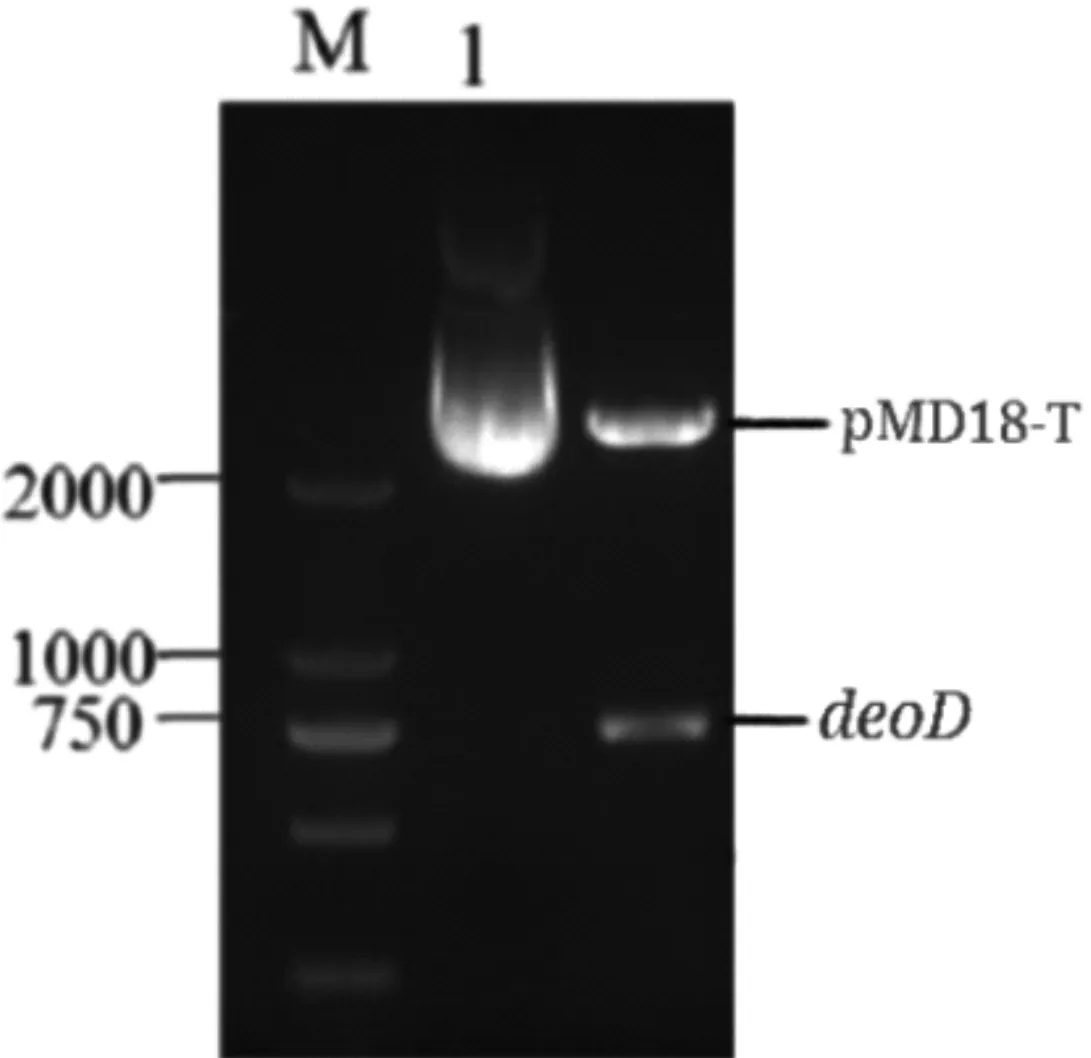
图2 双酶切重组质粒电泳
2.4 表达载体pET-28a-deoD的构建
将重组质粒 pMD18-T-deoD进行双酶切纯化后,将获得的包含黏性末端的目标基因与表达质粒pET-28a 混匀后加入连接体系进行PCR,进而将产物转到感受态细胞。通过含相应抗生素培养基培养筛选后,对阳性菌株进行质粒抽提并进行电泳分析。图3显示的两条带大约在5200bp和730bp处,经过测序,与前一次结果相同。以上证明成功构建表达载体,由此获得携带重组质粒pET-28a-deoD的工程菌菌株,并选取阳性菌落保存。
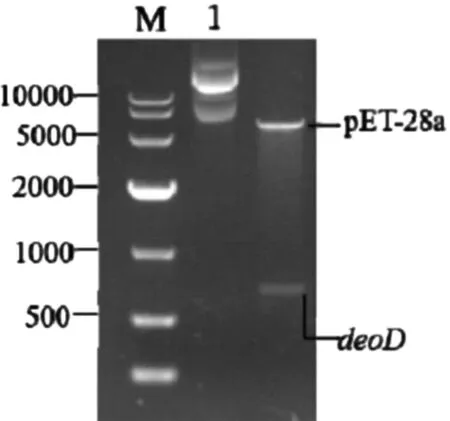
图3 双酶切pET-28a-deoD 后电泳
2.5 嘌呤核苷磷酸化酶(PNPase)的基因E.coli(deoD)诱导表达
菌体蛋白制备。LB液体培养基培养至菌液OD600值为0.55~0.80 ,加入IPTG继续培养6~8 小时后收集菌体,菌体超声破碎,离心处理得到沉淀。采用SDS-PAGE电泳[10]验证。
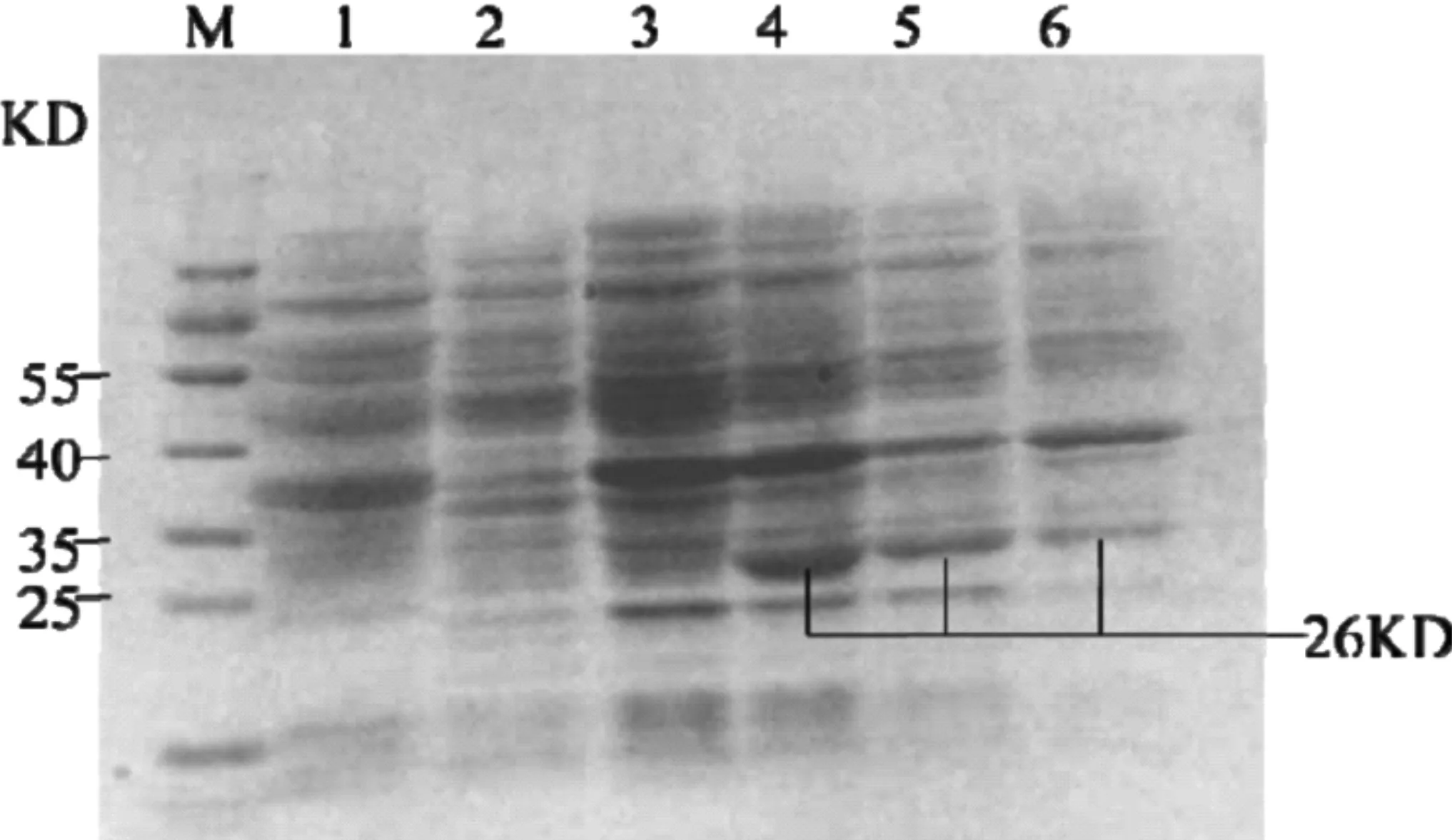
图4 deoD基因的SDS-PAGE表达图谱
如图4所示,M为预染彩虹蛋白 Marker,1~6分别表示埃希氏菌AEM0812、E.coli(pET-28a)、未经IPTG诱导的E.coli(deoD)、经IPTG诱导的E.coli(deoD)、E.coli(deoD)破碎后上清液、E.coli(deoD)破碎后沉淀。结果显示,E.coli(deoD)菌体经IPTG诱导,在26 KD出现了蛋白条带,与已知的嘌呤核苷磷酸化酶分子量25.85 KD大约相同,证明出现的此蛋白条带应为 PNPase表达产物,说明deoD基因成功表达。
3 结果与讨论
本研究将来源于埃希氏菌AEM0812菌株的嘌呤核苷磷酸化酶(deoD)基因通过PCR扩增后,连接到质粒pMD18-T上,利用原核表达体系pET-28a的强启动子T7将含有粘性末端的目的基因通过分子生物学技术构建重组载体,并将其导入大肠杆菌BL21(DE3)中,以此构建的工程菌菌株携带了重组质粒pET-28a-deoD。对上述构建的工程菌进行由IPTG诱导的蛋白表达,经过SDS-PAGE检测分析,蛋白表达量较原始菌株大幅提升,说明deoD基因成功表达,由此也证明成功构建了含有嘌呤核苷磷酸化酶的工程菌。通过构建E.coli(deoD)菌株,以获得催化阿糖鸟苷(ara-G)生物合成反应所用嘌呤核苷磷酸化酶的高产基因工程菌,不论是以工程菌全细胞进行发酵,还是以工程菌的粗酶液进行发酵,都可以大幅提高生产效率、降低成本,为工业化生产奠定基础。
