应用种子形态及DNA条形码技术鉴定黄芪及混伪品种子
2022-12-28张召雷王晓敏刘立轩冷晓红
李 军,张召雷,王晓敏,刘立轩,冷晓红
应用种子形态及DNA条形码技术鉴定黄芪及混伪品种子
李 军1*,张召雷2,王晓敏3,刘立轩1,冷晓红1
1. 宁夏职业技术学院 宁夏中药材开发与利用工程技术研究中心,宁夏 银川 750021 2. 承德医学院 河北省中药研究与开发重点实验室,河北 承德 067000 3. 宁夏大学农学院,宁夏 银川 750021
采用传统形态鉴定方法结合DNA条形码分子检测技术对黄芪及混伪品种子进行鉴定。收集黄芪及混伪品种子、市售黄芪种子样品共58份,利用体视显微镜和游标卡尺进行种子外观形态特征的观察和记录,测定千粒重;提取单粒种子的基因组DNA,PCR扩增、双向测序获得ITS2及psbA-trnH序列。使用邻接法(neighbor joining,NJ)构建系统发育树,kimura二参数(kimura two-parameter,K2P)模型计算遗传距离,进行物种鉴定分析。黄芪及混伪品种子在颜色、形状、长、宽、厚度及千粒重等方面存在细微差别;ITS2的测序成功率为100%,黄芪种间最小遗传距离均大于种内最大遗传距离;ITS2序列构建的NJ系统进化树将蒙古黄芪var.聚为独立一支,并将蒙古黄芪、紫花苜蓿、锦鸡儿、蜀葵及黄芪属其他物种分开,可进行黄芪及其混伪品种子的鉴定。基于外观形态和ITS2条形码序列鉴定发现12份市售黄芪种子中有1份为斜茎黄芪。基于种子形态鉴定和ITS2条形码相结合的方法可以准确鉴定黄芪及混伪品种子,为规范黄芪种源及种植生产,进而保障黄芪药材质量提供科学依据。
黄芪;种子;蒙古黄芪;扁茎黄芪;斜茎黄芪;紫云英;外观形态;ITS2;DNA条形码;系统发育分析
黄芪原名黄耆,始载于《神农本草经》[1],宋代《图经本草》载:“今出原州(宁夏固原)及华原(陕西耀县)者也佳。”[2]。《中国药典》2020年版规定豆科植物蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao或膜荚黄芪(Fisch.) Bge.的干燥根作为黄芪入药[3]。黄芪的主要有效成分皂苷、黄酮等,有抗炎、降压、抗心肌缺血损伤、抗衰老、抗慢性肾病、调节免疫、保肝和清除自由基等作用[4]。由于黄芪具有优良的补气固表、敛疮生肌等功效,国内外市场对黄芪的需求极大,进而导致野生黄芪资源逐渐匮乏,目前市场上商品黄芪大多为栽培品种[5-6],主要分布在山西、宁夏、内蒙古、陕西省毗邻的干旱少雨沙生草原区[7],种植规模不断扩大。但存在种源混乱、种质混杂等现象,黄芪种子作为中药材种植的源头,质量参差不齐,鉴定错误的种子不仅会带来严重的经济损失,也会给临床用药带来极大的安全隐患。
黄芪及混伪品种子如斜茎黄芪、扁茎黄芪和紫云英外观形态相似,传统方法易受鉴定人员经验、种子成熟度和外部环境的影响,难以进行准确鉴定[8-9]。因此需要一种更加客观、准确的鉴定方法对传统鉴定方法进行补充。DNA条形码技术具有通用性、客观性、准确性等特点[10-11],已是传统形态鉴别方法的辅助手段和有效补充,可以实现对生物物种的准确、快速鉴别[12-13]。目前,DNA条形码鉴定技术已经在黄芩、木通、钩藤和北苍术等种子鉴定中取得了良好的效果[14-18],成为近年来种子鉴定研究的重点和亮点。当前,黄芪种植及需求量越来越多,种源鉴定困难,关于黄芪种子的分子鉴定较少且未进行系统研究[19]。因此,本研究拟利用外观形态和DNA条形码技术系统地对黄芪及其混伪品种子进行鉴定研究,以期建立一种客观、准确、高效的黄芪种子鉴定方法,以保障其种子的物种准确,为市场流通黄芪种子的规范化管理提供技术支持,为从源头解决黄芪药材质量问题提供科学依据,并为中药黄芪的临床用药安全提供保障。
1 材料与仪器
1.1 材料
本研究共收集黄芪及其混伪品种子样本58份,分别来自宁夏、山西、内蒙古、甘肃和江苏等多个省份,其中来源于黄芪及其混伪品原植物的种子样品46份,原植物标本经宁夏农业科学院李明研究员及宁夏职业技术学院郭鸿雁教授鉴定分别为蒙古黄芪(Fisch.) Bge. var.(Bge.) Hsiao、扁茎黄芪R. ex Bge.、斜茎黄芪Jacquin及紫云英L.,市售待检样品12份。所有样品均保存于宁夏中药材开发与利用工程技术研究中心。样品采集信息见表1。
同时本研究从GenBank数据库下载条形码序列[19],共整理黄芪与锦鸡儿、蜀葵、紫云英、白花草木樨等混伪品的37条有效条形码序列(表2)。
1.2 试剂
DL2000 Marker、RNase酶、植物基因组DNA提取试剂盒均购自北京天根生化科技有限公司;psbA-trnH、ITS2序列引物由上海生工生物工程有限公司合成;琼脂糖购自西班牙Biowest Agarose公司;2×Taq plus Master Mix购自南京诺唯赞生物科技有限公司;GelRed染料购自美国Biotium公司。
1.3 仪器
M205FA型高级研究级体视显微镜(德国莱卡有限公司);MyCycler PCR仪、Gel Doc XR+凝胶成像系统、Powerpac Basic型琼脂糖凝胶电泳仪(美国伯乐有限公司);MiniSpin plus型高速离心机(德国Eppendorf公司);Geno 2010型高通量组织研磨机(美国SPEX SamplePrep公司);Nanodrop ONE型超微量分光光度计(美国NanoDrop公司);YXQ-LS-50S型立式压力蒸汽灭菌锅(上海博讯仪器有限公司);Mini型离心机(珠海黑马医学仪器有限公司);SZ-1型涡旋混合器(常州国宇仪器制造有限公司);HHSY21-Ni4-C型恒温水浴锅(北京长源实验设备厂)。
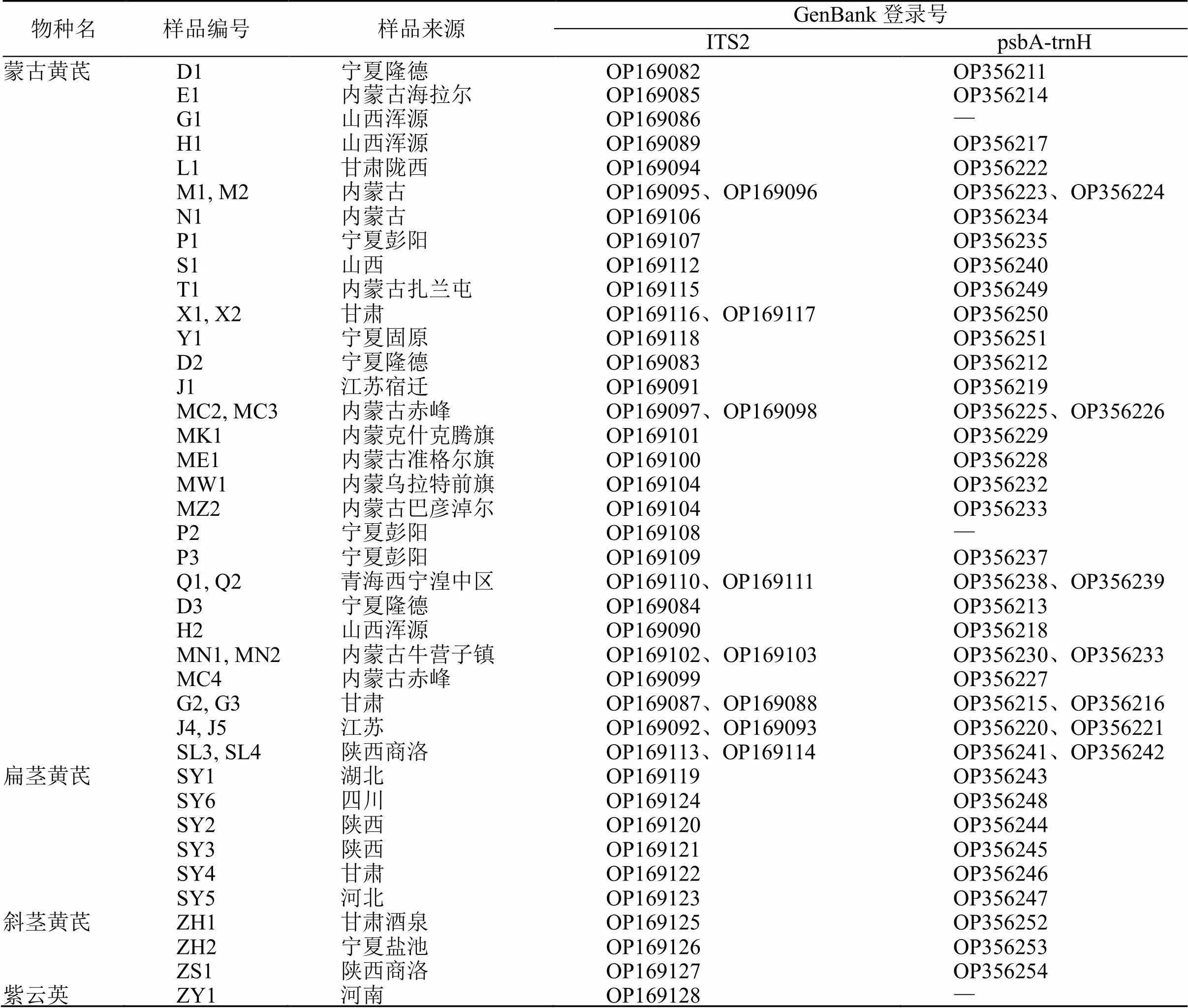
表1 蒙古黄芪及混伪品种子样品信息

表2 GenBank的DNA条形码序列登录号
2 方法
2.1 种子外观形态特征观察
从每份种子样品中随机选取20粒进行观察,用体视显微镜观察种子的形状、颜色、表面纹理等外观形态特征,并拍照记录;用数显游标卡尺测量供试种子的长度、宽度和厚度;从充分混匀的净种子样品中随机选取做3个重复,每个重复100粒种子称定质量,取平均值并估算其千粒重。
2.2 DNA提取及质量检测
取单粒种子样品,用75%乙醇擦拭表面,自然挥干,放入2.0 mL离心管,加入钢珠2枚,−80 ℃冰箱冷冻2 h,用高通量组织球磨仪研磨8 min(4000 r/min),采用植物基因组DNA提取试剂盒提取总DNA,详细操作参照试剂盒说明书[20]。并使用Nanodrop ONE型超微量分光光度计检测种子DNA的浓度和质量。
2.3 PCR扩增及测序
本研究选用国际通用序列ITS2及psbA-trnH2条DNA条形码候选序列。2对引物序列及PCR反应条件见表3。PCR体系为25 μL,包含2×Taq Plus Master Mix 12.5 μL,正反向引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL[21]。取4 μL PCR产物用1%的琼脂糖凝胶(含GelRed染料)电泳,在凝胶成像仪中观察并拍照保存。并将PCR产物送至中国农业科学院作物科学研究所进行双向测序。

表3 所用引物序列及相应PCR反应条件
2.4 序列分析及物种鉴定
利用序列拼接软件CodonCode Aligner 10.0.2对测序峰图文件进行校对拼接,去除低质量序列及引物区;ITS2去除2端5.8S和28S区,仅保存中间ITS2片段,psbA-trnH序列去除2端和的基因序列,仅保留基因间隔区[22];使用MEGA 7.0对拼接后序列进行比对分析,比较不同序列的比对后长度、变异位点和遗传距离,分析序列的碱基组成,对各个候选序列进行种间种内变异分析[23],并对数据进行1000次自展,以kimura二参数模型(kimura two-parameter,K2P)模型计算遗传距离,采用邻接法(neighbor joining,NJ)建立系统进化树,考察ITS2和psbA-trnH鉴定黄芪及其混伪品种子的能力,并对市售黄芪种子进行鉴定。
2.5 市售黄芪种子物种鉴定
收集12份市售商品名标注为黄芪的种子,样本分别来自内蒙古、甘肃、陕西、江苏等产地。利用外观形态和优选的DNA条形码序列进行黄芪种子物种鉴别研究,考察其种子鉴定准确性。
3 结果
3.1 种子外观形态特征
通过体视显微镜的观察和游标卡尺的测量,黄芪及混伪品种子在外观形态上有细微差异。从表4中的观察结果来看,蒙古黄芪种子宽卵状肾形,略扁,长2.0~4.5 mm,宽1.9~3.5 mm,厚0.5~1.5 mm,表面光滑,为暗棕色或黄褐色,种脐位于腹中部凹陷处,千粒重约6.65 g。扁茎黄芪种子相对较小,褐绿色或青色,呈球状肾形,略扁,表面光滑,种皮基本无斑,种脐位于腹中部凹陷处,千粒重约2.64 g。斜茎黄芪种子最小,呈肾形,褐绿色,表面光滑,种皮有黑褐色斑点和细密网状纹,种脐位于腹中上部凹陷处,千粒重约1.63 g。紫云英种子较蒙古黄芪略小,呈长肾形,棕色或者褐色,种皮无斑,腹中部凹陷较深,种脐位于凹陷处,千粒重约3.76 g。
上述种子的典型形态特征可以作为鉴别黄芪种子的依据,种子形态特征研究表明(图1),黄芪及其混伪品扁茎黄芪、斜茎黄芪和紫云英的种子形态特征有一定细微差异,如颜色、形状、斑点等,由于种子均比较细小,在无专业设备辅助下鉴定易出现偏差。
取不同采集地经过鉴定的蒙古黄芪种子于体视显微镜下进行观察,图2结果表明不同采集地黄芪种子,受气候环境及成熟度的影响形态特征存在显著差异,单从形态鉴定黄芪种子存在一定的局限性。

表4 蒙古黄芪及混伪品种子外观形态特征

图1 黄芪属种子的形态特征

图2 不同产地蒙古黄芪种子的形态特征
3.2 黄芪种子ITS2序列特征及物种鉴定能力考察
PCR扩增的ITS2经电泳凝胶成像检测,其在500 bp呈现单一明亮、清晰的条带,PCR扩增率均为100%。经测序,46个来源于原植物的种子样品中ITS2序列均获得高质量双向测序峰图,ITS2测序成功率为100%。另从GenBank数据库中下载8个物种的19条ITS2序列,共计获得65条黄芪及混伪品种子ITS2参考序列,比对后长度226 bp,GC%含量50.5%,共有68个变异位点。蒙古黄芪种内平均遗传距离0.002,种内最大遗传距离0.005,与黄芪混伪品的种间最小遗传距离0.080,故黄芪及其混伪品种间最小遗传距离大于种内最大遗传距离。基于黄芪及其混伪品种子的ITS2序列构建NJ系统发育树,结果表明(图3),混伪品中紫花苜蓿、蜀葵、锦鸡儿、白花草木樨和黄芪属其他物种分别单独聚类,说明其与黄芪属物种的亲缘关系较远,较易区分。蒙古黄芪可形成独立的一大枝,可以与扁茎黄芪、斜茎黄芪和紫云英明显区分,ITS2序列可作为黄芪及其混伪品种子鉴定的序列。
3.3 黄芪种子psbA-trnH序列特征及物种鉴定能力考察
psbA-trnH序列经电泳检测,其在600 bp左右呈现明亮、清晰的条带。对收集的46个种子样品PCR产物测序,psbA-trnH序列由于存在polyT结构,影响其测序质量,psbA-trnH序列测序成功率为93.5%。另从GenBank数据库中下载6个物种的18条psbA-trnH序列,共获得61条黄芪及混伪品种子psbA-trnH序列。比对后长度636 bp,GC%含量21.1%,共160个变异位点。蒙古黄芪种内平均遗传距离0.006,种内最大遗传距离0.038,与混伪品斜茎黄芪、扁茎黄芪、紫花苜蓿、锦鸡儿、蜀葵和白香草木樨的种间最小遗传距离分别为0.028、0.118、0.263、0.232、0.486和0.252。故蒙古黄芪与斜茎黄芪种间最小遗传距离小于种内最大遗传距离,蒙古黄芪与其他混伪品种间最小遗传距离均大于种内最大遗传距离。基于黄芪及其混伪品种子的psbA-trnH序列构建NJ系统发育树,图4结果表明混伪品中紫花苜蓿、蜀葵、锦鸡儿、白花草木樨和黄芪属其他物种分别单独聚类,说明其与黄芪属物种的亲缘关系较远,较易区分。黄芪属物种聚为一大枝,但蒙古黄芪与扁茎黄芪、斜茎黄芪分成小枝,可以进行区分。psbA-trnH序列可作为黄芪及其混伪品种子鉴定的补充序列。

图3 基于ITS2序列构建的蒙古黄芪及混伪品种子NJ树
3.4 基于外观形态及ITS2条形码序列的市售黄芪种子物种鉴定
根据上述结果,收集12份市售商品名标注为黄芪的种子来进行真伪鉴别研究。样本分别来自内蒙古、甘肃、陕西、江苏等产地。通过观察发现ZG1I种子外观与蒙古黄芪样品有一定差异。随后以ITS2序列物种鉴定,每份样品取单粒种子进行DNA提取,结果如表5所示,DNA质量浓度48.35~109.80 mg/L,吸光度()比值260/280处于1.724~1.994。PCR扩增产物电泳检测结果在500 bp有1条清晰明亮的条带,双向测序和注释获得ITS2序列,经BLAST鉴定,12份市售黄芪种子中有1份为斜茎黄芪,符合外观形态特征。

图4 基于psbA-trnH序列构建的蒙古黄芪及混伪品种子NJ树
4 讨论
4.1 黄芪及混伪品种子总DNA的提取及测序
关于样品用量方面,按照DNA提取试剂盒要求的取样量干燥组织20 mg,应该取多粒种子作为样品,但由于种子个体间易存在基因杂合现象,测序峰图容易存在杂峰,进而影响测序质量,本实验选取黄芪及混伪品单粒种子1.5~8.0 mg进行DNA提取试验,DNA质量浓度48.35~109.80 μg/mL,且260/280为1.724~1.994。采用ITS2和psbA-trnH 通用引物均可以获得明亮、清晰的条带,表明黄芪和混伪品单粒种子提取的DNA完全可以满足试验要求。故后续采用单粒种子样品进行总DNA的提取。另外,为了提高提取的稳定性,本实验采用−80 ℃冰箱冷冻降低温度后[24],用组织研磨仪快速研磨后,新型植物DNA提取试剂盒快速提取,提高总DNA的质量。试验样品的ITS2和psbA-trnH序列PCR扩增成功率均为100%。ITS2的测序成功率为100%,而psbA-trnH序列由于存在polyA/T结构,影响其测序质量及拼接,测序成功率为93.5%。测序未成功的样本均经多次重复试验,仍不能成功测序。

表5 市售黄芪种子样品信息及鉴定
4.2 黄芪及混伪品种子形态和DNA条形码鉴定
中药材种子鉴定主要通过借助显微镜的形态学观察来完成,但其形态特征和显微特征易受环境和种子成熟度等因素影响,相同物种的种子往往也存在形态差异,均会影响物种鉴定的准确性[25]。作为传统形态鉴定方法的补充,DNA条形码技术依靠植物的遗传信息进行鉴定,不受环境和植物生长发育阶段的影响[24]。
目前关于黄芪DNA条形码鉴定的研究较多,其中郑司浩等[26]利用特异性分子标记鉴别蒙古黄芪与膜荚黄芪,高婷等[27]利用ITS2条形码序列鉴定了黄芪属药用植物。刘亚令等[11]基于ITS2序列及二级结构鉴定了黄芪药材及其混伪品。这些研究主要是针对黄芪药材及其植物的分子鉴定研究。而种子作为繁殖材料在DNA条形码鉴定实践中有一定特殊性,内含物丰富,多数个体较小,DNA提取困难,且含有PCR抑制物[28]。其中张改霞[19]采用形态学结合ITS2条形码技术对10批次黄芪种子样品进行鉴定。本研究从25个不同产地收集了黄芪及混伪品种子46份,通过外观形态及ITS2和psbA-trnH条形码序列分析,不仅在形态学方面揭示了黄芪种子及其混伪品的差异,而且在ITS2条形码鉴定的基础上,补充了psbA-trnH条形码鉴定,结果发现ITS2序列能将蒙古黄芪聚为一大枝,黄芪属其他物种聚为小枝,可以明显区分黄芪及其混伪品种子。研究结果表明,ITS2序列作为黄芪及其混伪品种子鉴定的优选序列,psbA-trnH作为补充序列。系统完善地对黄芪及其混伪品种子鉴定进行了研究。同时,本研究通过外观形态和ITS2条形码技术发现12份市售黄芪种子中有1份为斜茎黄芪。说明市售黄芪存在一定的种源混杂问题,可通过DNA条形码技术对其进行准确鉴定,避免由于种子混乱给临床用药带来了的安全隐患。
4.3 DNA条形码鉴定黄芪及混伪品种子的意义
黄芪作为大宗药材,应用广泛,除《中国药典》2020年版规定的蒙古黄芪和膜荚黄芪之外,其混伪品斜茎黄芪、扁茎黄芪、紫云英、紫花苜蓿、锦鸡儿和蜀葵等[10]也时有出现,导致市场上种子种苗比较混乱。严重影响了黄芪药材的质量稳定和临床用药安全,所以从药材源头着手,准确鉴定黄芪种子基原,保证黄芪种子的质量至关重要。DNA条形码技术可鉴定单粒种子,解决混种、种子混杂问题,弥补传统鉴别方法的不足,在中药鉴定领域具有广阔的应用前景[29-30]。
目前尚缺少完善的法律法规规范黄芪种子种苗的生产和销售。2019年农业农村部种业管理司印发了《2019年推进现代种业发展工作要点》,指出《中药材种子管理办法》的起草任务迫在眉睫[31]。与黄芪药材和饮片的鉴定方法相比,由于黄芪种子尚未建立系统的物种鉴定方法,采用DNA条形码技术进行鉴定成本低、准确率高、实践性强[32]。因此,利用DNA条形码技术,加快推进黄芪种子标准化建设,不仅能为我国黄芪种子种苗鉴定规范化建设提供有力技术保障,也是中药现代化建设的重要建设内容[14]。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄海波, 黄柏超. 《本草纲目·释名》“黄耆”诸名解读 [J]. 中医药文化, 2016, 11(4): 46-49.
[2] 詹志来, 邓爱平, 彭华胜, 等. 基于历代本草产地变迁的药材道地性探讨: 以黄芪、丹参为例 [J]. 中国中药杂志, 2016, 41(17): 3202-3208.
[3] 中国药典 [S]. 一部. 2020: 323.
[4] 孟祥善, 代晓华, 刘萍, 等. 基于ITS序列的银柴胡种质资源遗传多样性研究 [J]. 中药材, 2018, 41(1): 55-59.
[5] 孙淑英, 陈贵林. 内蒙古黄芪产业化现状、问题及对策建议 [J]. 分子植物育种, 2018, 16(15): 5126-5133.
[6] Li D, Liu Y T, Qin X M. Rapid quantitative analysis of 12 chemical constituents in wild-simulated and cultivatedbased on UHPLC-MS [J]., 2022, 14(3): 464-469.
[7] 彭露茜, 郭彦龙. 中国黄芪地理分布和未来适生区预测 [J]. 四川农业大学学报, 2017, 35(1): 60-68.
[8] 闫冲, 刘红菊, 赵丽丽. 黄芪及其混淆品种子的种皮组织结构鉴别 [J]. 海峡药学, 2007, 19(4): 55-56.
[9] 闫冲, 聂凤禔. 黄芪及其伪品的种子快速鉴别方法 [J]. 中国药业, 2005, 14(7): 69-70.
[10] Chen S L, Yao H, Han J P,. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species [J]., 2010, 5(1): e8613.
[11] 刘亚令, 耿雅萍, 王芳, 等. 基于ITS2序列及二级结构对药用黄芪及混伪品的鉴别研究 [J]. 药学学报, 2020, 55(3): 522-529.
[12] 穆威杉, 谢红波, 赵晴, 等. 基于ITS2序列的市售木通药材及其混伪品的分子鉴定[J]. 中草药, 2022, 53(7): 2108-2114.
[13] Zhang G X, Liu J X, Gao M,. Tracing the edible and medicinal plantand its products in the marketplace yields sub species level distinction using DNA barcoding and DNA metabarcoding [J]., 2020, 11: 336.
[14] 穆威杉, 于娟, 赵晴, 等. 基于DNA条形码技术的中药材木通种子鉴定研究 [J]. 世界中医药, 2020, 15(9): 1271-1274.
[15] 刘金欣, 魏妙洁, 李耿, 等. 黄芩ITS2条形码数据库构建及其种子的DNA条形码鉴定方法建立 [J]. 中国实验方剂学杂志, 2018, 24(9): 37-45.
[16] 谢红波, 赵晴, 穆威杉, 等. 北苍术种子DNA条形码研究及序列特征分析 [J]. 承德医学院学报, 2022, 39(1): 13-18.
[17] 陈士林, 姚辉, 韩建萍, 等. 中药材DNA条形码分子鉴定指导原则 [J]. 中国中药杂志, 2013, 38(2): 141-148.
[18] 蔡一鸣, 代江鹏, 郑雨欣, 等. 钩藤属植物分子鉴定的DNA条形码筛选[J]. 中草药, 2022, 53(6): 1828-1837.
[19] 张改霞. 几种传统大宗中药材种子DNA条形码鉴定 [D]. 济南: 山东中医药大学, 2016.
[20] 李军, 张燃, 于淑萍, 等. 中药材银柴胡及其混伪品的DNA条形码鉴定研究 [J]. 药学学报, 2019, 54(5): 937-943.
[21] 陈士林. 中药DNA条形码分子鉴定 [M]. 北京: 人民卫生出版社, 2012: 14.
[22] Keller A, Schleicher T, Schultz J,. 5.8S-28S rRNA interaction and HMM-based ITS2 annotation [J]., 2009, 430(1/2): 50-57.
[23] Kumar S, Stecher G, Li M,. MEGA X: Molecular evolutionary genetics analysis across computing platforms [J]., 2018, 35(6): 1547-1549.
[24] 戚文涛, 李剑超, 王晨, 等. 应用ITS2条形码及种子形态鉴定柴胡属种子 [J]. 中国实验方剂学杂志, 2020, 26(11): 170-177.
[25] 肖娟. 不同生境白簕种子形态、品质特征和种子萌发特性的研究 [J]. 中药材, 2014, 37(5): 731-736.
[26] 郑司浩, 尚兴朴, 曾燕, 等. 蒙古黄芪与膜荚黄芪特异性分子标记鉴别研究 [J]. 中国现代中药, 2019, 21(3): 307-311.
[27] 高婷, 姚辉, 马新业, 等. 中国黄芪属药用植物DNA条形码(ITS2) 鉴定 [J]. 世界科学技术—中医药现代化, 2010, 12(2): 222-227.
[28] 赵晴, 谢红波, 赵红玲, 等. 中药材种子DNA条形码鉴定研究进展 [J]. 中草药, 2019, 50(14): 3471-3476.
[29] 辛天怡, 雷美艳, 宋经元. 中药材DNA条形码鉴定研究进展 [J]. 中国现代中药, 2015, 17(2): 170-176.
[30] Shi L C, Chen H M, Jiang M,. CPGAVAS2, an integrated plastome sequence annotator and analyzer [J]., 2019, 47(W1): W65-W73.
[31] 邓明瑞. 中药材种生产经营管理探讨: 种子管理机构在贯彻实施新《种子法》中遇到的困难与挑战 [J]. 中国种业, 2019(5): 34-37.
[32] 张尚智, 张建军, 刘玲玲. 我国中药材种子种苗标准发布状况及分析 [J]. 畜牧兽医杂志, 2019, 38(1): 49-54.
Identification ofseeds and its adulterants by morphology and DNA barcoding technique
LI Jun1, ZHANG Zhao-lei2, WANG Xiao-min3, LIU Li-xuan1, LENG Xiao-hong1
1. Ningxia Research Center for Development and Utilization of Chinese Medicinal Materials, Ningxia Polytechnic, Yinchuan 750021, China 2. Hebei Key Laboratory of Research and Development of Chinese Medicine, Chengde Medical University, Chengde 067000, China 3. School of Agriculture, Ningxia University, Yinchuan 750021, China
Using the traditional morphological identification method in combination with DNA barcoding technique,seedsand the adulterantswere authenticated.A total of 58 samples including cultivated, marketedseeds and the adulterants were collected. Seeds morphological characters were determined using stereomicroscope and vernier caliper observations, along with calculation of their 1000-grain weights. Genomic DNA was extracted from the single seed. PCR and bidirectional sequencing yielded the ITS2 andsequences. Species identification were emoloyed, using kimura two-parameter model (K2P) genetic distance method and neighbor joining (NJ) phylogenetic analysis.Slight differences in color, shape, length, width, thinkness and 1000-grain weight amongseeds samples and the adulterants could be observed. The ITS2 sequencing success rate was100%. The minimum genetic distance between species ofwas greater than the maximum genetic distance within species. The NJ dendrogram of ITS2 sequences indicated that all thevar.seedscould form independent branches, which could be distinguished from,and other species ofin the collected samples, thus possessing the ability to authenticateseeds from the adulterants. Based on seed morphology and ITS2 barcoding identification strategy, onesample was identified from the 12 marketedseeds samples.Based on the combination of seed morphology and ITS2 sequence barcoding identification, theseeds and the adulterants can be accurately identified, which provides scientific bases for standardizing the source and cultivation of, ensuring the quality of Chinese medicinal materials.
Bunge; seed;(Fisch.) Bge. var.(Bge.) Hsiao;R. Ex Bge.;Jacquin;L.; morphology; ITS2; DNA barcoding technique; phylogenetic analysis
R286.12
A
0253 - 2670(2022)24 - 7871 - 09
10.7501/j.issn.0253-2670.2022.24.024
2022-09-13
宁夏回族自治区教育厅高等学校科学研究项目资助(NGY2020132)
李 军(1982—),男,山西浑源人,硕士,副教授,主要从事中药资源及开发利用研究。E-mail: lijunamy@126.com
[责任编辑 时圣明]
