草莓根腐病防控生物药剂筛选与田间防治效果验证
2022-12-27任晶晶刘政源冯俊涛马志卿
任晶晶, 刘政源,3, 王 勇,2, 冯俊涛,2,何 军,2, 吴 华*,,2, 马志卿,2
(1. 西北农林科技大学 植物保护学院,陕西 杨凌 712100;2. 陕西省生物农药工程技术研究中心,陕西 杨凌 712100;3. 山西省运城市农业农村局,山西 运城 044000)
草莓根腐病是一种危害十分严重的土传病害,在世界各地的草莓主产区均有发生[1],其病原菌种类复杂,疫霉菌Phytophthora fragariae、茄腐镰刀菌Fusarium solani、尖孢镰刀菌Fusarium oxysporum和立枯丝核菌Rhizoctonia solani等都能导致草莓根腐病的发生[2-4]。根据发病症状不同,草莓根腐病主要分为红中柱根腐病、鞋带灌根病、黑根腐病和白根腐病等,地上部症状大多表现为叶片变黄枯萎,整株萎蔫,地下部症状表现各异[5]。陕西省草莓产业发展迅猛,逐渐占据国内和国外市场[6],杨凌示范区位于关中平原,是陕西省草莓主产区,但近年来多发生草莓红中柱根腐病,造成严重减产[7]。对草莓根腐病的防治主要以杀菌剂灌根防治为主[8],但近年来随着化学农药的大量频繁使用,多种病原菌对甲霜灵、嘧菌酯和苯醚甲环唑等常用药剂已产生抗性[9-11],防效下降的同时造成农药残留超标,严重影响草莓品质和出口创汇[12]。除化学防治外也可使用生物药剂防治草莓根腐病。Agusti 等[13]和Namm 等[14]研究发现,由尖孢镰刀菌、立枯丝核菌和胶孢炭疽菌Colletotrichum gloeosporioides引起的草莓根腐病可以用枯草芽孢杆菌、多粘类芽孢杆菌和乳芽孢杆菌等生防细菌防治,因此本研究选用7 种生物源农药对草莓根腐病进行抑菌活性及田间防治效果研究,以期为陕西关中地区的草莓根腐病防治提供新的药剂选择。
1 材料与方法
1.1 试验材料
1.1.1 供试病原菌 草莓红中柱根腐病病株采自杨凌区寨西村11 号红颜草莓大棚,所采植株田间症状表现为整株倒塌萎蔫,易拔起,叶片发黄萎蔫,根部全部腐烂坏死,整个发病根系为黑褐色,根茎部中柱掰开为红褐色。
1.1.2 供试药剂 0.5% 小檗碱水剂 (berberine 0.5% AS)、0.4%蛇床子素可溶液剂 (osthol 0.4%SL)、0.3%苦参碱乳油 (matrine 0.3% EC)和2 亿芽孢/g 哈茨木霉菌可湿性粉剂 (Trichoderma harzianum200 million spores/g WP),由杨凌馥稷生物科技有限公司提供;1.5%苦参 · 蛇床子素水剂 (matrine + osthol 1.5% AS),由山西德威本草生物科技有限公司提供;1 000 亿芽孢/g 枯草芽孢杆菌可湿性粉剂 (Bacillus subtilis100 billion spores/g WP),由武汉科诺生物科技股份有限公司提供;10 亿芽孢/g 多粘类芽孢杆菌可湿性粉剂 (Bacillus polymyxa1 billion spores/g WP),由浙江省桐庐汇丰生物科技有限公司提供。80%多菌灵可湿性粉剂 (carbendazim 80% WP),由河北德裕祥生物化工有限公司提供。
1.2 试验方法
1.2.1 草莓根腐病病原菌的分离与鉴定
1.2.1.1 病原菌的分离与纯化 采用组织分离法[15]对采集的标本进行分离。首先切取根茎部病健交界处组织,进行表面消毒 (无菌水冲洗,75%酒精浸泡1 min,无菌水再次冲洗,0.1%升汞浸泡30 s,无菌水冲洗3 次) 后,将其切成0.4 cm ×0.4 cm 的组织块放在PDA 平板上,并置于23~25 ℃恒温培养箱中培养。待长出不同种类菌丝时,分别接种到PDA 平板中,继续恒温培养,直到获得纯净的菌落。
1.2.1.2 病原菌的致病性检测试验及再分离 在试验开始前,先转接培养20~30 个PDA 平板 (不同病原菌分别转接培养),待菌丝长满培养皿后,用接种针刮取平板中的菌丝,并与无菌水混合,制成孢子悬浮液。室外采用根部伤根灌根法接种,每株草莓植株接种浓度为1 × 106个孢子/mL 的孢子悬浮液20~25 mL[16],每处理重复4 次,并以无菌水为对照。试验选取的健康植株来自红颜草莓大棚,提前移栽至花盆中,接种病菌后再将其移到23~25 ℃的温室大棚中继续培养。定期观察接种后草莓植株的发病状况,记录草莓植株发病时间,并观察是否与田间症状一致。
采用组织分离法[15]对接种发病后的草莓植株再次进行病原菌分离。具体操作同1.2.1.1 节,直到获得纯净的菌落。显微镜下观察病原菌的形态特征,判断是否与初次分离的病原菌形态一致。
1.2.1.3 病原菌的形态学鉴定 选取已纯化好的病原菌平板,用灭菌打孔器 (直径0.5 mm) 打取菌饼放入新的PDA 平板上,于23~25 ℃恒温箱中进行培养,观察菌丝及基质的颜色和菌落的形态特征。待菌丝扩展至培养皿1/2 时,挑取边缘菌丝,在光学显微镜下观察分生孢子形态、大小、有无隔膜和分生孢子梗形态等,根据菌丝生长的外部形态及显微镜下观察的情况,将病原菌初步鉴定到种属。
1.2.1.4 病原菌的分子生物学鉴定
1) 病原菌DNA 提取。将活化好的菌株移入PDB 培养基中,在摇床上25 ℃振荡培养4~5 d,过滤,收集菌丝。利用天根新型植物基因组DNA 提取试剂盒提取病原菌的DNA。
2) 真菌ITS rDNA 扩增。PCR 扩增所用的引物为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′[17]。以提取的DNA 为模板,进行PCR 扩增,扩增体系(50 μL) 为:DNA 1 μL、上下游引物各1 μL、Taq mixture 25 μL、用无菌水补足至50 μL。扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共35 个循环;72 ℃延伸7 min,4 ℃保存。
3) 真菌TEF1-α 基因扩增。PCR 扩增所用的引物为镰刀属真菌通用引物TEF1-αF:5′-ATG GGTAAGGAGGACAA GAC-3′和TEF1-αR:5′-GGAAGTACCAGTGATCATGTT-3′[18],尖孢镰刀菌特异引物FO1:5′-AAGAAGTCGAAGAATA CATCGCT-3′和FO2:5′-CGAGGAGTGTAT GAGACGGC-3′[19],茄腐镰刀菌特异引物FS1:5′-CCGCCAGAGGACCCCTAACT-3′和FS2:5′-TGTGCCCACAGGG GGCTT-3′[20]。以提取的DNA 为模板,进行PCR 扩增,扩增体系 (50 μL)为:DNA 1 μL、上下游引物各1 μL、Taq mixture 25 μL、用无菌水补足至50 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共35 个循环;72 ℃延伸10 min,4 ℃保存。
4) 琼脂糖凝胶电泳检测及序列比对。在150 V、150 mA 的条件下,用1%琼脂糖凝胶电泳20 min,检测所提取DNA 的完整性,切取所需PCR 产物DNA 电泳条段,将所得纯净PCR 产物送往北京奥科鼎盛生物科技有限公司进行测序,将测序结果与NCBI 中的BLAST 数据库进行比对,用MEGA7 构建系统发育树,并将获得的序列提交到GenBank 获得登录号,结合病原菌镜检形态特征及致病性检测结果,确定杨凌区草莓红中柱根腐病的主要致病菌种类。
1.2.2 四种药剂对病原菌的抑菌活性测定 采用菌丝生长速率法[21]测定供试药剂对病原菌菌丝生长的影响。供试药剂按照表1 所设浓度使用无菌水稀释,每种药剂设置3 次重复,另外设无菌水作为对照组 (CK)。将培养基与供试药剂以体积比9 : 1 的比例混匀后立即倒入直径为9 cm 的培养皿中制成含药培养基,将打好的菌饼放置于含药培养基平板中央,于23~25 ℃恒温培养。观察菌丝生长状况,当对照组菌丝长满平板2/3 时,用十字交叉法测量菌落直径,按公式 (1) 计算各药剂处理对菌丝生长的抑制率 (I),将各药剂处理数据用SPSS 软件进行计算分析,求得各药剂的毒力回归方程和EC50值。
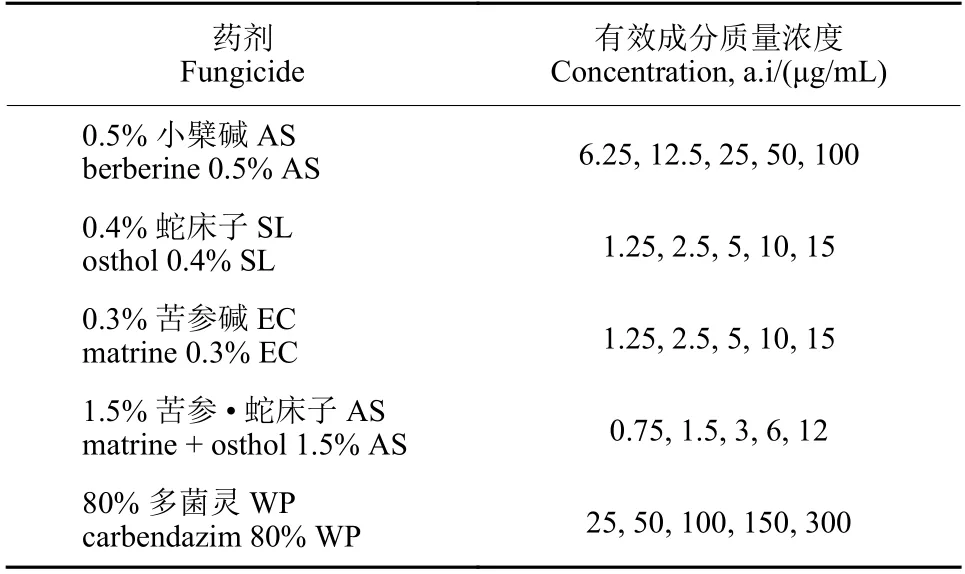
表1 供试药剂名称及测试浓度Table 1 Fungicides and concentrations

式中:Dt为药剂处理菌落直径;D0为空白对照菌落直径;D1为菌饼直径。
1.2.3 田间药效试验
试验时间为2017 年10 月至2018 年5 月,试验地点为陕西省咸阳市杨凌区寨西村11 号草莓大棚,草莓品种为红颜,土壤为塿土。2017 年10 月29 日第1 次灌根处理,天气多云;12 月20 日第2 次灌根处理,天气晴。
试验共设11 个处理,每个处理3 次重复,共33 个小区。每个小区面积为12 m2,随机排列。各小区按照事先设置的药剂处理浓度进行灌根处理,每株草莓灌液量为250 mL,空白对照组灌根等量清水。供试药剂及稀释倍数见表2。
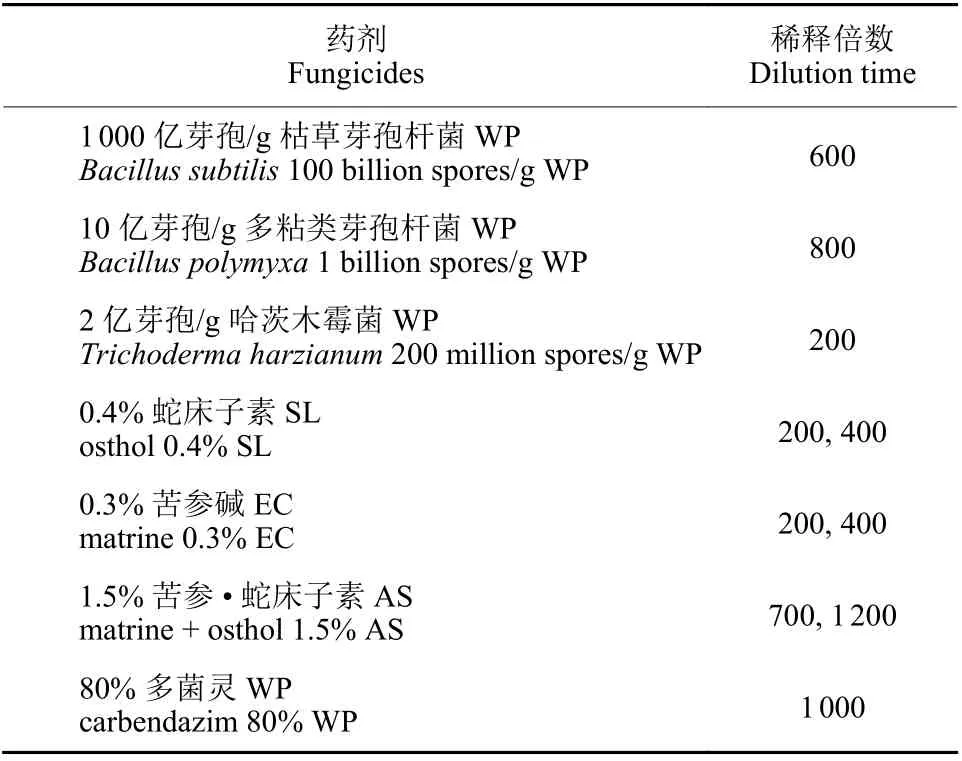
表2 药剂名称及稀释倍数Table 2 Fungicides and dilution times
草莓根腐病田间发病程度参考Vestberg 等[22]的方法,分为5 级:1 级为根系发病率≤30%,叶片正常;2 级为30%<根系发病率≤60%,叶片正常;3 级为60%<根系发病率≤80%;叶片变黄;4级为根系发病率80%以上,叶片枯萎;5 级为整株死亡,叶片干枯。
在空白对照组植株出现大量萎蔫倒伏时开始调查各处理的发病情况。每个小区随机选取20 株草莓,按公式(2)调查发病植株根系和叶片的发病情况,并进行分级,分别按照公式 (3) 和 (4) 计算各处理的病情指数和防治效果:

式中:IR为发病率;Nt为发病株数;N为调查总株数。
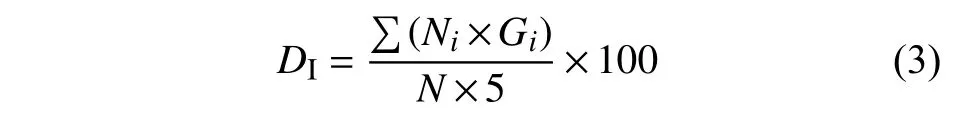
式中:DI为病情指数;Ni为各级病株数;Gi为该病对应的级数;N为调查总株数。

式中:P为防治效果;DIC为空白对照区病情指数;DIT为药剂处理区病情指数。
2 结果分析
2.1 病原菌分离结果
2.1.1 病原菌初次分离 采用常规组织分离方法对所采集的16 株草莓病株的病健组织进行分离,共分离得到6 株真菌,根据病原菌菌落生长的特征、外部形态、基质的颜色、镜检结果等将分离的病原菌归为2 类真菌菌株[23],分别挑选其中具有代表性的菌株命名为YL001 和YL002,菌株形态见图1。
由图1 可见:YL001 菌落呈圆形,边缘放射状,气生菌丝白色絮状,基质初期为白色,后期逐渐变为紫红色,但菌落边缘仍为白色。YL002菌落呈圆形,边缘整齐,气生菌丝白色绒状,轮状向外扩展,菌落反面深黄色至浅黄色。
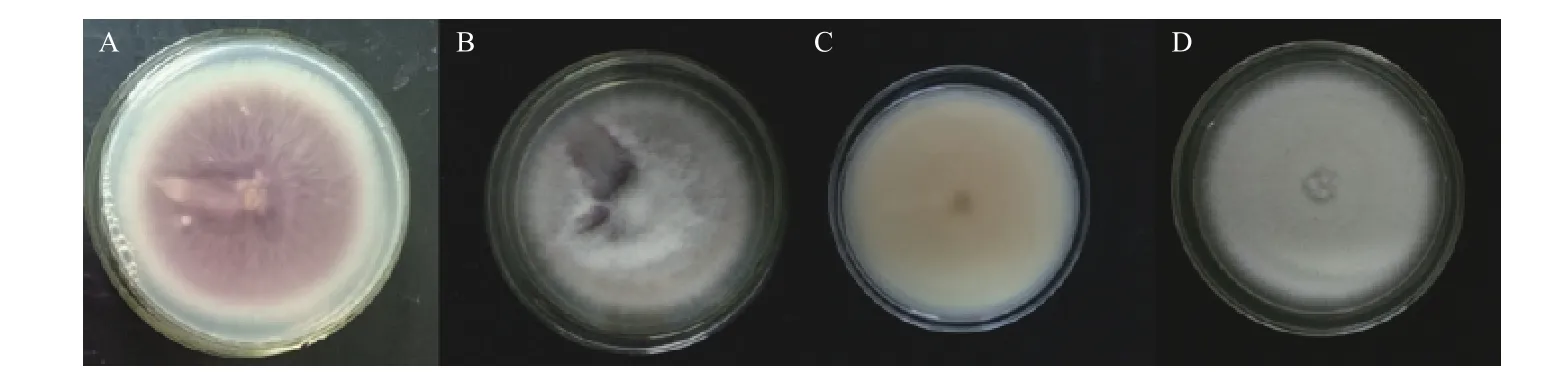
图1 草莓红中柱根腐病致病菌YL001 和YL002 的菌落形态Fig.1 The colony morphology of pathogenic fungi YL001 and YL002 of strawberry red stele root rot
2.1.2 病原菌形态学鉴定 YL001:镜检下小型分生孢子数量多,为卵形或椭圆形,单胞或偶尔双胞;大型分生孢子数量少,镰刀型,有隔膜,多为3 个隔;分生孢子梗为瓶状,单生,短,无分支[19]。
YL002:镜检下小型分生孢子数量较多,大多为卵形或者肾形,单孢,假头状着生于分生孢子梗上;大型分生孢子为马特形,两端钝圆,顶孢稍弯,有隔膜,多为2~3 个隔;分生孢子梗为瓶状,细长;厚垣孢子多为球形[24]。
根据两株菌株的形态学特征,参考Booth[25]《镰刀菌属》分类系统进行鉴定,初步将所分离的草莓红中柱根腐病的主要致病菌YL001 鉴定为尖孢镰刀菌Fusarium oxysporum,YL002 鉴定为茄腐镰刀菌Fusarium solani。
2.1.3 病原菌分子生物学鉴定
2.1.3.1 菌株DNA 提取及ITS rDNA、TEF1-α 基因片段扩增 分别以YL001 和YL002 菌株的菌丝作为提取材料提取DNA,以DNA 为模板分别进行ITS rDNA 和TEF1-α 基因PCR 扩增。结果显示,使用真菌通用引物ITS1/ITS4 和镰刀菌通用引物TEF1-αF/TEF1-αR 对两株菌株进行PCR 扩增,获得片段大小均约为700 bp 左右,使用尖孢镰刀菌特异引物FO1/FO2 对菌株YL001 进行PCR 扩增获得片段大小约为700 bp 左右,使用茄腐镰刀菌特异引物FS1/FS2 对菌株YL002 进行PCR 扩增获得片段大小约为300 bp 左右。
2.1.3.2 序列分析 将所得的PCR 产物送往北京奥科鼎盛生物科技有限公司测序,并将测序结果进行BLAST 序列比对,发现YL001 与尖孢镰刀菌F.oxysporum的相似性为99.10%,YL002 与茄腐镰刀菌F.solani的相似性为99.72%。基于ITS rDNA 扩增获得的序列,构建YL001 和YL002 系统发育树分别见图2A 和图2B, 并将获得的序列提交到GenBank,获得登录号分别为OL830714 和OL830715;基于TEF1-α 基因扩增获得的序列,构建YL001 和YL002 系统发育树分别见图3A 和图3B,并将获得的序列提交到GenBank,获得登录号分别为OL850016 和OL850017。
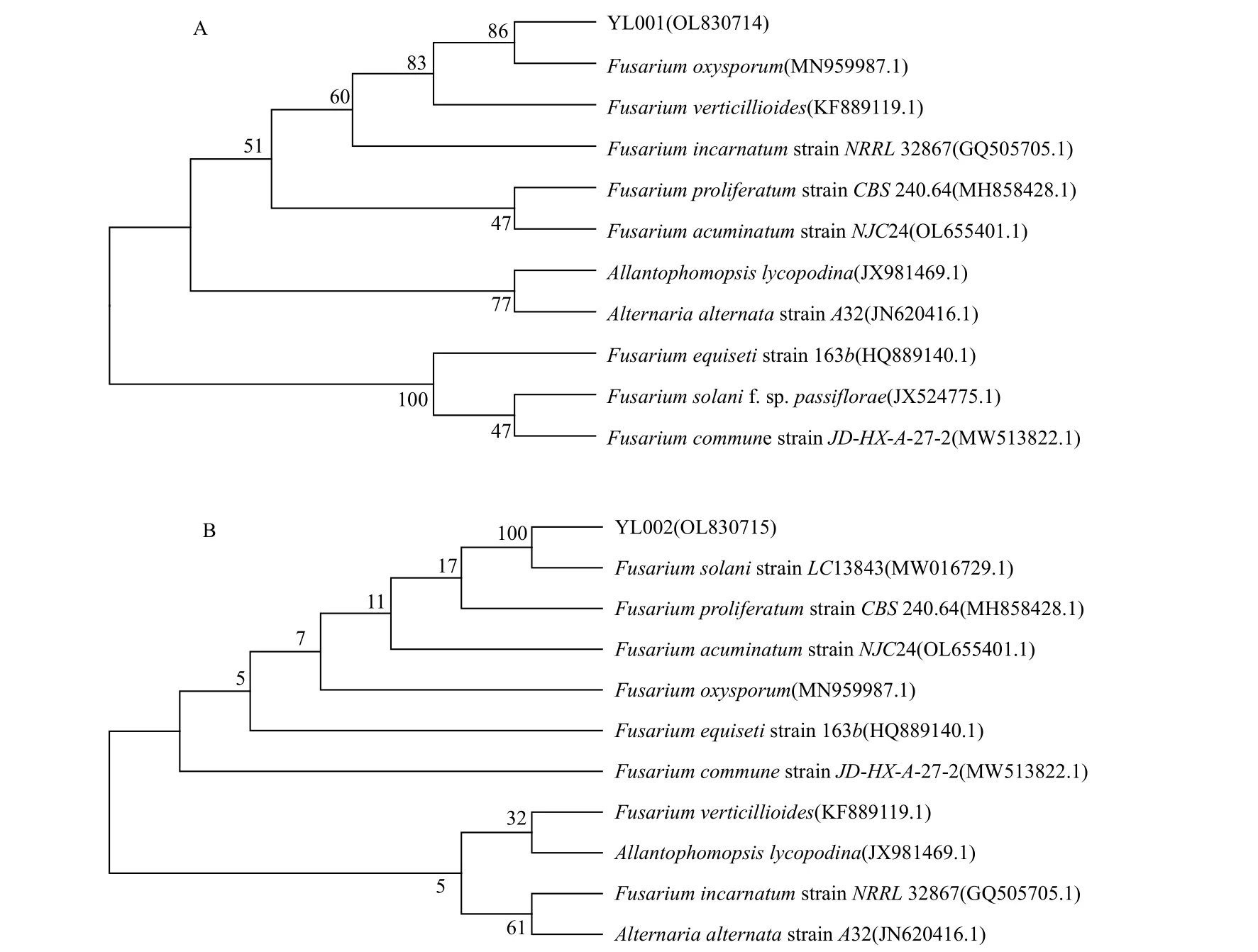
图2 基于ITS rDNA 的系统发育树Fig.2 Phylogenetic tree based on the ITS rDNA

图3 基于TEF1-α 基因的系统发育树Fig.3 Phylogenetic tree based on TEF1-α
2.1.4 病原菌致病性检测与再分离结果 按照伤根灌根接种的试验方法,将YL001 和YL002 分别接种到健康的草莓植株上,结果接种的草莓植株全部发病。相比于对照组,接种YL001 20 d 后草莓植株叶片边缘开始微卷,叶尖出现萎蔫,逐渐发展为整个叶片萎蔫 (图4A);同样地,接种YL002的草莓植株叶片边缘卷曲,叶片萎蔫,进而整株萎蔫 (图4B)。两个菌株的致病症状相似,都可造成草莓植株的萎蔫死亡,35 d 后整株草莓全部萎蔫倒塌,与田间症状一致,在接种YL001 和YL002的发病植株的根茎横切部均可看到中柱为红褐色环形,草莓根系也全部变为黑褐色(图4D 和图4E)。

图4 草莓红中柱根腐病致病菌YL001 和YL002 的致病性Fig.4 Pathogenicity of pathogenic fungi YL001 and YL002 on strawberry red stele root rot
采用组织分离法对接种后发病的草莓植株再次进行病原菌分离,分离之后得到两种菌株,将分离的菌株接种到PDA 平板上,待病原菌分生孢子长出后,刮取菌丝制片在光学显微镜下观察病原菌的形态特征,结果与初次分离的病原菌形态特征一致,经过观察鉴定,两次分离得到的菌株为同一种。
结合两个菌株形态学特征、致病性的检测及ITS rDNA、TEF1-α 基因序列的比对分析,将此次草莓红中柱根腐病的致病菌YL001 和YL002 鉴定为尖孢镰刀菌F.oxysporum和茄腐镰刀菌F.solani。
2.2 供试药剂对草莓根腐病病原菌的抑菌活性及田间防治效果
2.2.1 四种植物源农药对茄腐镰刀菌的抑菌活性
测定结果 (表3) 表明:0.3%苦参碱EC 对茄腐镰刀菌EC50值为4.5 μg/mL,与1.5% 苦参 · 蛇床子素AS 和0.4% 蛇床子素SL 的EC50值较为接近,这3 种植物源药剂对茄腐镰刀菌的EC50值明显低于0.5% 小檗碱AS 以及80% 多菌灵WP EC50。4 种药剂对茄腐镰刀菌的抑菌活性从大到小的顺序为0.3%苦参碱EC > 1.5%苦参 · 蛇床子素AS > 0.4%蛇床子素SL > 0.5%小檗碱AS。
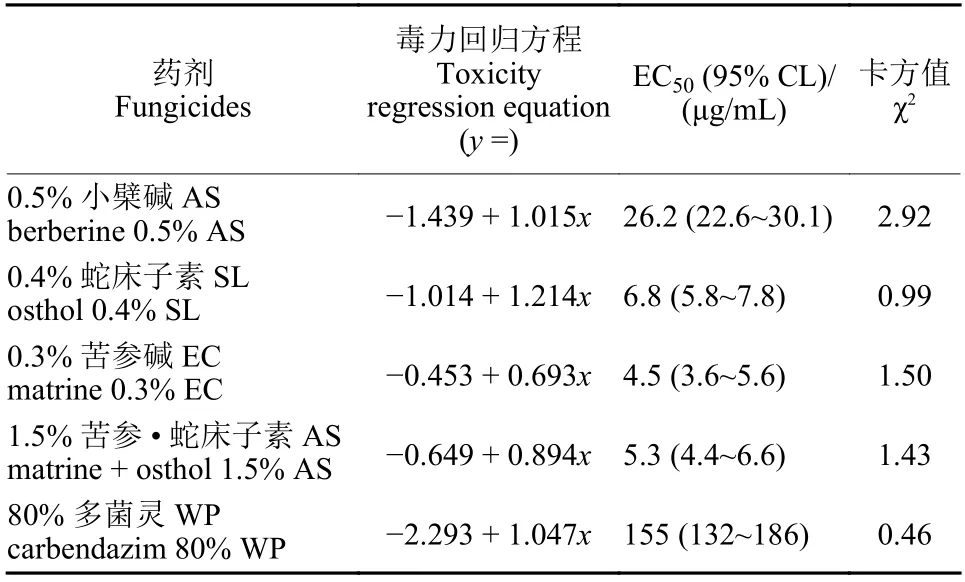
表3 四种植物源农药对茄腐镰刀菌的抑菌活性Table 3 The inhibitory activity of four plant derived fungicides against Fusarium solani
2.2.2 四种植物源农药对尖孢镰刀菌的抑菌活性 测定结果 (表4) 表明:1.5%苦参 · 蛇床子素AS 对尖孢镰刀菌的EC50值为2.7 μg/mL,与0.4%蛇床子素SL 和0.3%苦参碱EC EC50值较为接近,这3 种药剂对尖孢镰刀菌的EC50明显低于0.5%小檗碱AS 以及80%多菌灵WP EC50值。4 种植物源农药对尖孢镰刀菌的抑菌活性从大到小的顺序为1.5%苦参 · 蛇床子素AS > 0.4%蛇床子素SL >0.3%苦参碱EC > 0.5%小檗碱AS。
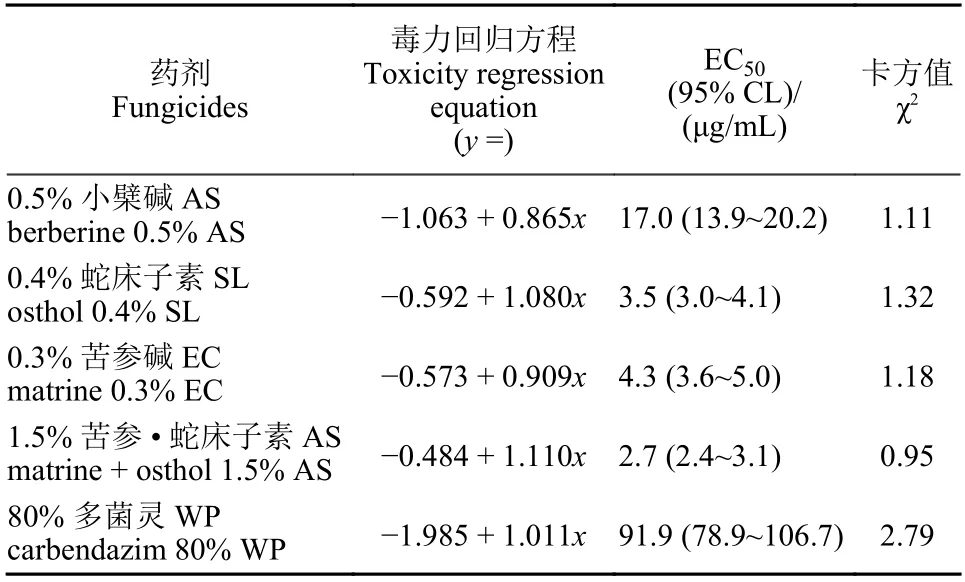
表4 四种植物源农药对尖孢镰刀菌的抑菌活性Table 4 The inhibitory activity of four plant derived fungicides against Fusarium oxysporum
2.2.3 田间防治效果 由表5 数据可以看出:各药液灌根处理对根腐病都有一定的防治效果,其中枯草芽孢杆菌600 倍液、多粘类芽孢杆菌800倍液和1.5%苦参 · 蛇床子素AS 700 倍液防治效果较为显著,尤其以枯草芽孢杆菌WP 1 000 亿芽孢/g 600 倍液处理的效果最好,防治效果为69.25%;哈茨木霉菌WP 200 倍液也表现出较好的防治效果,与多粘类芽孢杆菌和1.5%苦参 · 蛇床子素处理组无显著差异;而对照化学药剂80%多菌灵WP 1 000 倍液灌根的田间防效仅为35.12%,显著低于其他处理的防效,可能与多菌灵长期使用[26]、根腐病病原菌对其产生抗药性有关[27]。

表5 六种杀菌剂对草莓根腐病的田间防治效果Table 5 Field efficacy of six fungicides in controlling strawberry root rot
3 讨论与结论
关于草莓根腐病的病原菌种类,国内外有不同研究报道。1969 年加拿大首次报道了草莓根腐病的致病菌为镰刀菌Fusariumspp.,随后在西班牙和芬兰等地报道了草莓根腐病的病原菌分别是茄腐镰刀菌和锐顶镰刀菌Fusarium acuminatum[3],2004 年阿根廷也首次报道草莓根腐病的病原为茄腐镰刀菌[28]。中国从20 世纪80 年代开始研究草莓根腐病的病原,发现炭疽菌属Colletotrichumspp.、拟盘多毛孢属Pestalotiopsisspp.等均可导致草莓根腐病发生[29-30]。盛茹媛[31]报道草莓根腐病的致病菌为尖孢镰刀菌和终极腐霉菌Pythium ultimum;张阳等[32]报道草莓根腐病致病菌主要为立枯丝核菌、胶孢炭疽菌C.gloeosporioides、尖孢镰刀菌和木贼镰刀菌Fusarium equiseti。草莓红中柱根腐病的病原菌在国内外也有不同报道。例如,Eikemo 等[33]、陈孝仁等[34]和陈哲等[35]均报道草莓红中柱根腐病的致病菌为疫霉;穆丽松等[36]认为茄腐镰刀菌也可以引发草莓红中柱根腐病的发生,王玉民等[37]研究发现,草莓红中柱根腐病的病原菌为尖孢镰刀菌和立枯丝核菌;曹奎荣[4]认为草莓根腐病病原菌的种类可能与当地的土壤、气候等环境条件有关。
通过对杨凌区寨西村11 号大棚草莓红中柱根腐病病株进行组织法分离,得到了两种致病菌株,通过病原菌的形态观察,及采用柯赫氏法则回接和分子生物学鉴定,初步确定两个菌株分别为尖孢镰刀菌和茄腐镰刀菌,这与前人报道的草莓根腐病病原具有一致性[3,28,31,32,36-37]。本研究并未分离到其他致病菌,可能与选择的试验采集地点及分离用的培养基单一有关,应进一步调查关中地区其他设施草莓大棚草莓根腐病的发生情况,并采用选择性培养基进行多次、多点取样分离,以明确关中地区草莓根腐病的致病菌种类。本研究结果对认识关中地区设施草莓根腐病的发生规律及制定该病的综合防治策略等有一定的参考价值,不同栽培条件下,草莓红中柱根腐病危害可能是这两种镰刀菌单独或共同侵染所致,而关于这两种病原菌侵染致病过程和致病机制则需要进一步研究。
根据对草莓根腐病病原的分离鉴定,目前的田间防治策略主要以化学防治为主,其中对由胶孢炭疽菌C.gloeosporioides引起的草莓炭疽根腐病的防治可以选用苯醚甲环唑,由腐霉Pythiumspp. 或疫霉引起的草莓红中柱根腐病的防治可以选用霜脲 · 锰锌,而由立枯丝核菌R.solani引起的草莓黑根腐病可以选用多菌灵和百菌清等药剂防治[38-40]。此外,许博[41]研究表明,苯醚甲环唑和多菌灵对草莓根腐病的防治效果较好;王中武等[42]也通过多种药剂筛选明确了多菌灵对草莓根腐病防治效果。本文中80%多菌灵WP 对草莓红中柱根腐病防治效果较差,可能是病原菌对其抗药性产生有关,王勇等[43]研究表明,茄腐镰刀菌F.solani敏感株系极易对多菌灵产生抗性,经亚致死剂量培养7 代后其抗性可提高149.26 倍,也有文献报道亚洲镰刀菌F.asiaticum和禾谷镰刀菌F.graminearum对多菌灵产生了抗性[44-45]。
除化学防治外,生物防治也被广泛应用于根腐病的防治。例如,枯草芽孢杆菌MB1600 和GB03 已被登记用来防治由镰刀菌、丝核菌等引起的植物根部病害[46]。孙晓宇等[47]报道了枯草芽孢杆菌BSK1 对尖孢镰刀菌的菌丝生长抑制率能达到72%。关一鸣等[48]研究表明,哈茨木霉菌株SF0 对茄腐镰刀菌的菌丝生长抑制率达80% 以上。本研究也进一步证实枯草芽孢杆菌、多粘类芽孢杆菌、苦参 · 蛇床子素和哈茨木霉菌对草莓红中柱根腐病防治效果较好,可作为田间推荐药剂使用。因此以生防菌剂为代表的生物源农药在草莓根腐病的防治中有重要应用价值。
综上所述,本研究经过分离鉴定,确定了杨凌地区草莓红中柱根腐病的主要致病菌为尖孢镰刀菌和茄腐镰刀菌,通过筛选不同药剂对病原菌的抑菌活性和田间药效试验,确定了防治草莓红中柱根腐病的最优药剂为枯草芽孢杆菌 WP、多粘类芽孢杆菌 WP、苦参 · 蛇床子素 AS 和哈茨木霉菌 WP,研究结果为防治草莓重要病害根腐病提供了新的药剂选择。
