干扰素-γ通过调节分子伴侣干预人淋巴细胞抗原Ⅱ类表达的机制
2022-12-27冯星源王炽华陈谦彭万军王素利三亚市中医院检验科海南三亚57000海南省第三人民医院病理科
冯星源 王炽华 陈谦 彭万军 王素利( 三亚市中医院检验科,海南 三亚 57000; 海南省第三人民医院病理科)
人类淋巴细胞抗原(HLA)基因复合物是人类基因组中最多变的基因区域,它控制机体防护系统对病原体产生免疫抵抗作用,该基因复合物的功能意义主要表现为HLA Ⅰ类和Ⅱ类基因的功能〔1~3〕。HLA 编码形成Ⅰ类和Ⅱ类肽受体,通过向HLA 异型标记的T 细胞受体提供抗原肽来形成适应性免疫应答,HLA Ⅱ类糖蛋白和HLA Ⅱ类信号通路的其他多肽如:不变链和HLA-DM,可以在抗原呈递细胞(APCs)中发挥协同调控功能〔4〕。HLA Ⅱ类分子与一种Ⅱ型膜蛋白不变链相关,Ⅱ型膜蛋白不变链具有三种主要的伴侣蛋白功能,首先不变链作为同型三聚体与HLA Ⅱ类的3 个Aβ 异质二聚体结合形成非矩阵结构;通过与主要组织相容性抗原(MHC)Ⅱ类沟槽的紧密相互作用,抑制多肽的装载;不变链在其细胞质尾部含有靶向信号,使得非矩阵结构复合物能够在溶酶体间隔中传递〔5,6〕。通过炎症细胞因子干扰素(IFN)-γ 与APCs 上的受体结合,可以刺激Ⅱ类转录活化因子基因的活化进一步激活HLA Ⅱ类的表达,Ⅱ类转录活化因子通过与HLA Ⅱ类、不变链和HLA-DM 启动子的结合驱动转录调控〔7〕。Ⅱ类转录活化因子的调控对于启动适应性免疫应答至关重要,IFN-γ 对Ⅱ类转录活化因子的激活与T 细胞对细胞内细菌和病毒感染的应答启动一致,Ⅱ类转录活化因子对HLA Ⅱ类基因的活化和表达有重要的影响,被喻为HLA Ⅱ类基因的主控制器。若Ⅱ类转录活化因子缺乏激活HLA Ⅱ类启动子即裸淋巴细胞综合征,导致APCs 细胞表面无法表达HLA Ⅱ类启动子,HLA Ⅱ类缺失会导致机体对细菌感染的反应能力受损〔8〕。在不同的APCs 组中,HLA Ⅱ类基因的激活和对Ⅱ类信号通路的调控是可变的,HLA Ⅱ类基因的组织特异性调控是通过Ⅱ类转录活化因子基因的细胞类型特异性转录介导的,其中大部分位于HLA Ⅱ类地区〔9〕。与HLA-B 位点相邻的一组基因的产物被定义为B 相关转录本(BATs),研究发现〔10〕BAT3 编码的多肽可以调节多种细胞功能,并且发现BAT3 可以调控HLA Ⅱ类表达,IFN-γ 可以调控BAT3 转录,通过促进BAT3 和CⅡTA 的核导入,随后通过转录共激活因子激活HLA Ⅱ类基因。本研究探讨干扰素(IFN)-γ 通过调节分子伴侣干预人淋巴细胞抗原(HLA)Ⅱ类表达的机制。
1 材料与方法
1.1 原代细胞培养 使用含有10% 胎牛血清(FCS)、1%的抗生素、丙酮酸钠和HEPES 的DMEM培养基,培养获取的人黑色素瘤细胞系MelJuSo 和IMRS 人肺成纤维细胞;采用密度梯度离心法分离外周血单个核细胞;使用单核细胞分离试剂盒阴性选择分离出单核细胞。使用24 孔板用巨噬细胞集落刺激因子(1 000 U/ml)分化单核细胞(1×106个/ml)。
1.2 观测指标及方法
1.2.1 转染和CAT 报告试验 对MelJuSo 和IMRS细胞分别使用X-01 和A-02 程序,通过核分裂器Ⅰ电穿孔细胞,在用于转染的DNA 混合物中加入4 μg BAT3-敲除载体,转染48 h 后收集,收集得到的细胞用8 μg DNA jetPEI 转染试剂在培养皿中进行转染,生成稳定的MJ-BAT3-V5 和MJ-CⅡTA-V5 克隆体。采用G418 仪器选择稳定转染的克隆体,并用流式细胞仪分析检测V5 基因的表达;采用一种功能报告基因检测方法,使用Ii-启动子-CAT 结构作为报告质粒,MelJuSo 和MJ-BAT3-V5 细胞加入5 μg 报告质粒进行转染,转染48 h 后酶联免疫吸附试验(ELISA)检测CAT 基因的表达。
1.2.2 流式细胞术 室温下将细胞在乙二胺四乙酸(EDTA)中培养15 min,磷酸盐缓冲液(PBS)清洗,多聚甲醛(PFA)固定,使用Triton-X-100 对细胞进行通透化处理5 min,使用含有2% FCS 和0.05%的叠氮化钠的PBS 清洗细胞,接下来细胞在4℃下培养20 min,随后对细胞进行3 次洗涤,使用FACSD 高速细胞分选仪(贝迪医疗公司,德国)从未转染的细胞中分离绿色荧光蛋白阳性细胞。
1.2.3 Western 印迹、代谢标记和质谱检测 Western 印迹检测:细胞在0.5% NP-40 缓冲液中培养,加入细胞裂解液处理后裂解产物经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转移到硝化纤维素膜上,用抗原特异性一级抗体进行检测。采用辣根过氧化物酶(HRP)-耦联抗体和ECL Western 印迹试剂检测原发性抗体结合,随后进行X 射线显影。代谢标记:将细胞在不含蛋氨酸的培养基中培养2 h,随后在1×106个细胞悬浮在200 μl 无蛋氨酸的培养基中,加入2 mmol/L 谷氨酰胺、10 mmol/L HEPES 和35S-蛋氨酸,在37℃温度下摇晃细胞30 min。然后将细胞造粒、清洗后,悬浮在1 ml含有非放射性蛋氨酸的培养基中,继续标记培养4 h。对得到的细胞进行Western 印迹检测方法如上所述,用2,5-二苯氧唑增强SDS 凝胶,干燥并进行X 射线显影。使用EasyWin32 软件对薄膜进行密度扫描,为了获得线性关系的条带强度,将IFN-γ 刺激和未受刺激的细胞免疫沉淀凝胶暴露7或36 h。质谱分析检测:采用MJ-CⅡTA-V5 细胞中的V5 单克隆抗体免疫沉淀CⅡTA-V5,使用12%SDS-PAGE 进行分离,考马斯亮蓝G-250 染色后,选择具有CⅡTA/BAT3 流动性的蛋白条带,用胰蛋白酶谱免疫球蛋白(IG)D 试剂盒进行凝胶内胰蛋白酶消化,在质谱分析中从丙烯酰胺凝胶中洗脱出来的多肽通过3000 RSLC 系统分离,质谱分析采用配备纳米电喷雾离子源的LTQ-Orbitrap Velos 质谱仪进行ESI-MS/MS 质谱分析。
1.2.4 实时PCR 分析 为了量化BAT3 转录的相对数量,使用Oligotex mRNA Mini 试剂盒从1×106个细胞中分离出poly-A-mRNA,并根据试剂盒中说明书的指导,使用定量反转录试剂盒合成cDNA,随后以cDNA 为模版进行实时PCR,PCR 仪设置条件为37℃保持15 min、85℃保持5 s、4℃至最终。
1.3 统计学方法 采用SPSS21.0 软件行Shapiro-Wilk 检验、单因素方差分析、Fisher 精确检验。
2 结 果
2.1 BAT3 的缺失对HLA Ⅱ表达的影响 Western印迹检测了BAT3 耗尽后Ii 的表达情况如图1 所示,在实验中,对含有GFP 的细胞进行分类,随后进行裂解,并对BAT3、Ii 和β-actin 进行Western 印迹检测,在富含GFP 的裂解细胞样品中,可以看到BAT3 残带,Ii 明显消失。

图1 Western 印迹检测结果
研究BAT3 缺失对HLA Ⅱ表达的影响,采用流式细胞术将HLA Ⅱ类糖蛋白和HLA-DM 与Ii 进行比较结果如表1 所示,为了确认BAT3 敲除的特异性,将miRBAT3-GFP (miR4BAT3) 与另外一个BAT3 靶载体(miR10BAT3)、一个不相关的miRNA对照及编码GFP 的模拟载体进行了比较,将这两种miRBAT3 载体导入MelJuSo 细胞后,miR4BAT3 组、miR10BAT3 组Ii、HLAⅡ、HLA-DM 水平均明显低于模拟载体组(均P<0.05),miRNA 对照组与模拟载体组Ii、HLAⅡ、HLA-DM 水平比较差异无统计学意义(P>0.05)。见表1。
表1 BAT3 缺失对HLA Ⅱ表达的影响(±s,n=20)
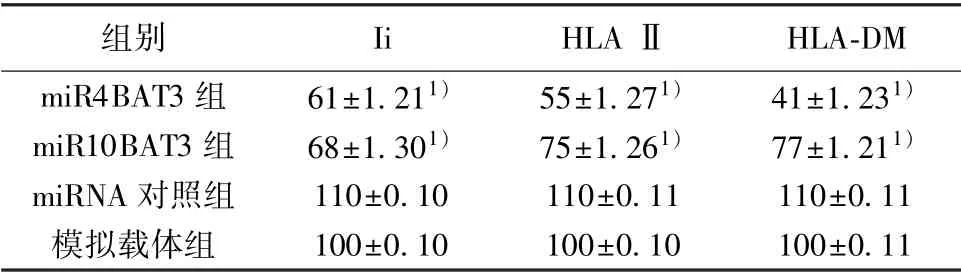
表1 BAT3 缺失对HLA Ⅱ表达的影响(±s,n=20)
与模拟载体组比较:1)P<0.05
组别IiHLA ⅡHLA-DM miR4BAT3 组61±1.211)55±1.271)41±1.231)miR10BAT3 组68±1.301)75±1.261)77±1.211)miRNA 对照组110±0.10110±0.11110±0.11模拟载体组100±0.10100±0.10100±0.11
2.2 过表达BAT3 对HLA Ⅱ成分水平的改变BAT3-V5 转染细胞组BAT3 水平(7 000±117)高于未转染细胞组(1 000±110),差异有统计学意义(P<0.05)。BAT3-V5 转染细胞组HLAⅡ和Ii 蛋白水平均明显高于未转染细胞组(均P<0.05);HLAⅠ蛋白水平明显低于未转染细胞组(P<0.05)。见表2。
表2 两组HLA Ⅱ、Ii 和HLA Ⅰ蛋白水平表达(±s,n=20)
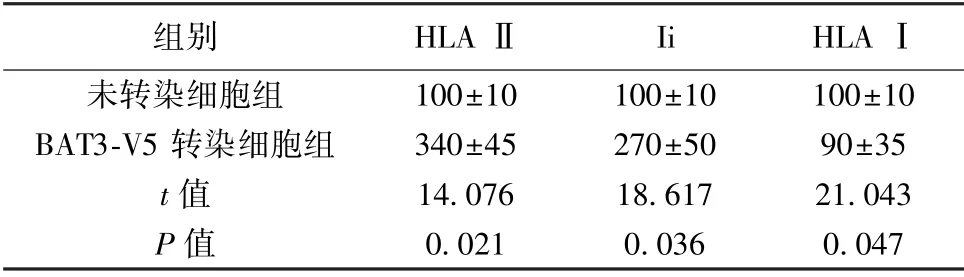
表2 两组HLA Ⅱ、Ii 和HLA Ⅰ蛋白水平表达(±s,n=20)
组别HLA ⅡIiHLAⅠ100±10100±10100±10 BAT3-V5 转染细胞组340±45270±5090±35 t 值14.07618.61721.043 P 值未转染细胞组0.0210.0360.047
2.3 IFN-γ 对BAT3 表达的影响 IFN-γ 刺激MelJuSo 细胞后通过Western 印迹检测细胞提取物中BAT3 的表达结果如图2 所示,IFN-γ 刺激48 h后BAT3 蛋白水平明显升高(P<0.05)。作为MelJuSo 细胞对IFN 反应的对照,随着时间的增加检测出Ii 的表达也增强。通过实时PCR 检测MelJuSo、IMRS 细胞中BAT3 对IFN-γ 介导的BAT3调控作用。将BAT3 的相对数量归一化为β-actin水平,IFN-γ 处理使MelJuSo 细胞BAT3 增加6~7倍。IFN-γ 处理使IMRS 细胞增加4~5 倍。见表3。
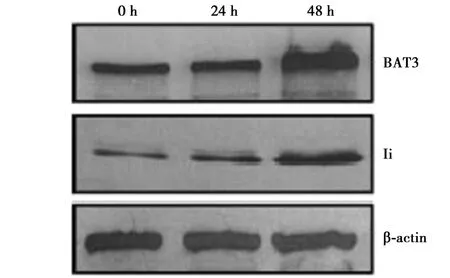
图2 Western 印迹检测不同时间点IFN-γ 对BAT3表达的影响
表3 MelJuSo、IMRS 细胞中IFN-γ 介导对BAT3调控(±s,n=20)
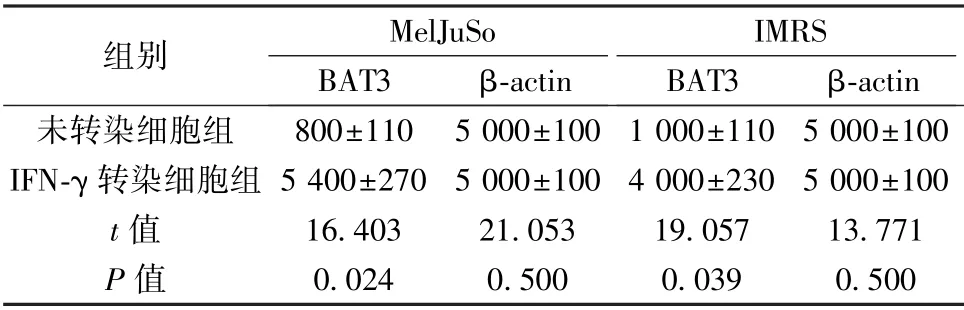
表3 MelJuSo、IMRS 细胞中IFN-γ 介导对BAT3调控(±s,n=20)
组别MelJuSo BAT3β-actin未转染细胞组-actin IMRS BAT3β 800±110 5 000±100 1 000±110 5 000±100 IFN-γ 转染细胞组5 400±270 5 000±100 4 000±230 5 000±100 t 值16.40321.05319.05713.771 P 值0.0240.5000.0390.500
2.4 ELISA 检测CAT 蛋白 IFN-γ 处理诱导细胞会诱导CⅡTA 表达,进而刺激HLA Ⅱ类基因转录,通过ELISA 检测CAT 蛋白的表达,证明过表达的BAT3 影响IFN-γ 诱导的Ii 转录调控结果,IFN-γ 诱引内源性CⅡTA 和BAT3 在MelJuSo 和BAT3-V5细胞中表达,刺激Ii 启动子活性,CAT 蛋白表达比较:IFN-γ+BAT3-V5 细胞(1 000±180)>IFγ+MJ 细胞(810±150)>BAT3-V5 细胞(700±110)>MJ 细胞(200±70),差异均有统计学意义(均P<0.05)。
3 讨 论
HLA 复合体控制着免疫系统对感染的各种反应,HLA Ⅱ类表达异常或缺失往往会引起严重自身免疫疾病或引起免疫缺陷的发生。Nakashima 等〔11〕研究发现HLA Ⅱ类基因的基因表达完全受主调控因子CⅡTA 的调控,这种转活化因子对HLA Ⅱ类基因和少数参与抗原处理的其他基因有显著的特异性。BAT3 在调节细胞凋亡和控制细胞增殖的稳定因子中发挥着重要作用〔12〕,BAT3 作为热休克蛋白HSP70 的参与蛋白可调控蛋白的再折叠和其合成的质量控制。研究表明BAT3/BAG6 支持一些抗原蛋白的降解和错误定位蛋白的消除,在BAT3 的生命周期中,会发生与其他蛋白质许多的相互作用〔13,14〕。BAG 家族的蛋白(BAT3 被指定为BAG6,因为它含有BAG 基序)已被证明与蛋白酶体亚基、转录因子和细胞周期调节因子相互作用〔15〕,通过高通量杂化筛选,可检测到与BAT3 N 端相互作用的新蛋白,这些蛋白含有调控蛋白降解的结构域基序。BAT3 的作用可能是稳定新合成的蛋白,并通过与其他因素的相互作用将其传递到细胞内的细胞间隔中。Takeuchi〔16〕研究表明在胞质中BAT3 与Ubl4a和TRL35 形成稳定的复合物,BAT3 复合物靶向核糖体上的一种尾锚定蛋白底物亚型,具有高度特异性,并将蛋白转移到TRC40,ATPase TRC40 伴侣蛋白是新近合成的尾锚定蛋白。类似于BAT3 稳定尾部锚定蛋白并将其靶向TRC40 的机制,BAT3 伴侣蛋白CⅡTA 在核糖体上合成并随后介导与核转运因子的相互作用,新合成的CⅡTA 通过BAT3 的陪伴可解释CⅡTA 在BAT3 介导下增加的现象,BAT3从细胞质到细胞核内部的是由在C 端发现的核定位序列介导。Luo 等〔17〕发现BAT3/BAG6 在细胞溶胶中的作用在受到免疫刺激细胞因子IFN-γ 的调控后可以转变为细胞核内多肽的作用,HLA Ⅱ类定位的BAT3 和CⅡTA 基因均受IFN-γ 调控,通过IFNγ 处理后BAT3 蛋白表达增加,同时IFN-γ 诱导的CⅡTA 升高,但是CⅡTA 水平升高并不增强BAT3 的表达。BAT3 被证明是一种转录调控因子,它与CTCFL 形成复合物,调节染色质结构和基因的表达,此外BAT3 与组蛋白乙酰转移酶p300 结合,促进p53 的后续乙酰化。p300 被CⅡTA 招募到Ⅱ类启动子中,参与CⅡTA 基因的转录。BAT3 在物理上与CⅡTA 相互作用,在IFN-γ 刺激作用后两种蛋白都转移到核内,Guillaume 等〔18〕发现IFN-γ 处理MelJuSo 细胞2 h 内CⅡTA 和BAT3 均转移至细胞核,这一短时间间隔表明IFN-γ 影响细胞质CⅡTA和BAT3 蛋白的稳态水平。BAT3 与CⅡTA 结合随后启动HLA Ⅱ类基因转录,但BAT3 对HLA Ⅱ类转录的直接作用尚未被证实。HLA Ⅱ类的表达在APCs 的异质性组中受到差异调控,BAT3 的伴侣作用可以在APCs 中调控HLA Ⅱ类基因的表达。未成熟的树突细胞可高度合成HLA Ⅱ类处理通路的成分,一旦病原体激活这种合成就会停止,在B 淋巴细胞中HLA Ⅱ类的本构表达在向浆细胞的终末分化过程中丢失〔19〕。Kosuke 等〔20〕发现IFN-γ 诱导HLA Ⅱ类,通过IFN-γ 刺激巨噬细胞中的BAT3 基因转录,BAT3 对CⅡTA 的关键影响可能为调控转录子提供了一个缺失的环节。本研究表明BAT3 通过陪伴CⅡTA 来调控HLA Ⅱ类表达,CⅡTA 蛋白稳定性的调控为HLA Ⅱ类通路的调控提供了一种新的机制。
