右美托咪定对原位肝移植大鼠VEGFR-3/VEGF-C通路及缺血再灌注损伤的影响
2022-12-27张昆夏建国陈群武汉市第三医院麻醉科湖北武汉43006烧伤科
张昆 夏建国 陈群 (武汉市第三医院 麻醉科,湖北 武汉 43006; 烧伤科)
原位肝移植(SOLT)是指将病肝连同后下腔静脉一并切除,植入肝与受体同名血管相吻合的一种手术方式,为治疗肝脏恶性肿瘤和终末期肝病的主要方法,但该过程中易导致缺血再灌注损伤(IRI)且无法避免,是导致移植物早期肝功能丧失、器官排斥的主要因素之一〔1,2〕。炎症级联效应是肝脏IRI 发生、发展的关键因素〔3,4〕,而血管内皮生长因子受体(VEGFR)-3 及其配体血管内皮生长因子(VEGF)-C上调表达可抑制炎症通路,增加抗炎细胞因子的产生,改善肝移植IRI〔5,6〕。因此探究VEGFR-3/VEGF-C 通路在SOLT 过程中调控作用,对阐明肝移植IRI 机制具有一定临床意义。右美托咪定(Dex)是一种新的重症监护病房(ICU)镇静药,已证实Dex 可通过抑制炎症反应和氧化应激达到对肝癌、肝移植、肝IRI 的保护效果〔7,8〕。但Dex 保护肝移植过程中避免IRI 的具体分子生物学机制还不甚明确,Dex 对肝移植过程中VEGFR-3/VEGF-C 通路的影响也不清楚。本研究通过建立SOLT 大鼠模型,对上述问题进行探究,旨在阐明Dex 抑制肝移植过程中IRI 的调控机制。
1 材料和方法
1.1 实验材料
1.1.1 动物 雄性同遗传背景Sprague Dawley 大鼠,清洁级,200~220 g,购自广东省医学实验动物中心〔SCXK(粤)2018-0002〕。所有大鼠于武汉市第三医院动物房中饲养。本试验符合3R 原则,且经武汉市第三医院动物伦理委员会批准。
1.1.2 主要试剂及仪器 Dex 购自南京赛泓瑞生物公司(规格:100 mg,货号:T2524);苏木素-伊红(HE)染色试剂盒购自北京索莱宝公司(货号:G1120);丙氨酸氨基转移酶(ALT)酶联免疫吸附试验(ELISA)试剂盒(货号:JK-ELISA-12191,购自上海晶抗生物工程有限公司);总胆红素(TBIL)ELISA试剂盒(货号:MM1005R2,购自广州市超博科技有限公司);白细胞介素(IL)-6 ELISA 试剂盒(货号:YS04528B,购自上海彩佑实业有限公司);肿瘤坏死因子(TNF)-α ELISA 试剂盒购自上海三抒生物公司( 货号: ss301254);VEGFR-3 抗体( 货号:ab243432)、VEGF-C 抗体(货号:ab32152)、促细胞因子信号传导抑制因子(SOCS)1 抗体(货号:ab62584)、磷酸化糖原合成酶激酶(p-GSK)3β 抗体(货号:ab75745)、Toll 样受体(TLR)4 抗体(货号:ab217274)购自美国Abcam 公司;胰蛋白酶(货号P0231)、BCA 蛋白定量试剂盒(货号P0768)购自美国Pierce 公司。SMZ745 光学显微镜(尼康,日本);RM2125RTS 手动轮转式切片机(Leica,德国);1659001 型蛋白电泳仪、Trans-Blot SD 半干转膜仪(Bio-Rad,美国);GIS-500 凝胶成像仪(米欧仪器有限公司,杭州)等。
1.2 SOLT 大鼠造模及分组给药 50 只SD 大鼠用随机数字表法分为假手术(Sham)组、自体原位肝移植模型( SOLT) 组、Dex 低(25 μg/kg)、中(50 μg/kg)、高(100 μg/kg)剂量组,每组10 只;除Sham 组仅行开腹、暴露肝脏、关腹外,其余4 组大鼠均采用自体肝脏原位移植法建立SOLT 模型〔9〕:戊巴比妥钠麻醉大鼠,呈仰卧姿势,固定四肢,于腹部自剑突下到耻骨联合上方正中切口,离断左三角韧带、肝镰状韧带,向左翻转肝脏,打开右侧后腹膜,分离肝上腔静脉(SHVC)、肝下腔静脉(IHVC);剪开肝十二指肠韧带,充分分离和显露门静脉(PV)、肝固有动脉,从而获得自体供肝,依次阻断上述肝脏血管后,无肝期开始。经PV 向肝脏灌注4℃乳酸钠林格液,剪开小部分IHVC 排出肝内液体,冷灌注30 min。灌注后的肝脏逐渐变为土黄,且触之冰冷。然后去掉血管夹,恢复PV、SHVC、IHVC 及肝固有动脉血流。肝脏转为鲜红色,用温生理盐水冲洗腹腔后关闭腹腔。术后24 h 大鼠成活,即为造模成功。各组大鼠均于术前24 h 和术前1 h 经尾静脉注射给药,Sham 组和SOLT 组注射10 ml/kg 的生理盐水,Dex 各剂量组参照文献〔10〕设置射低、中、高剂量,并用生理盐水稀释成2.5、5.0、10.0 μg/ml 的Dex 溶液,10 ml/kg经尾静脉注射给药。各组大鼠均于术后24 h麻醉处死,取材进行后续试验。
1.3 标本采集 各组大鼠术后24 h 麻醉处死,取下腔静脉血3 ml,然后取肝脏组织,部分组织立即用4%多聚甲醛固定24 h;其余组织则冻存备用。下腔静脉血在4℃条件下放置30 min,3 000 r/min离心10 min,取上清液,冷冻保存。
1.4 肝脏组织HE 染色 将1.3 中固定的肝脏组织进行脱水、透明、石蜡包埋后,切成4 μm 厚的切片,按HE 染色试剂盒说明书操作,在显微镜下观察各组大鼠的肝脏组织变化。
1.5 血清肝功能指标ALT、TBIL 及肝组织炎性因子TNF-α、IL-6 含量检测 依据ELISA 试剂盒检测1.3 冻存的血清样本中的ALT、TBIL 含量;于4℃冰箱中解冻1.3 冻存的肝脏组织,匀浆后离心,取上清液,分成3 份,依据ELISA 试剂盒检测TNF-α、IL-6含量。
1.6 qRT-PCR 检测肝组织VEGFR-3、VEGF-C mRNA 水平 取1.5 剩余的其中1 份组织上清液,Trizol 试剂盒提取总RNA,逆转录成cDNA,依据试剂盒说明书进行PCR 扩增,共36 个循环,引物由生工生物公司合成,引物序列见表1。采用2-ΔΔCt法计算VEGFR-3、VEGF-C mRNA 表达水平,GAPDH 为内参。
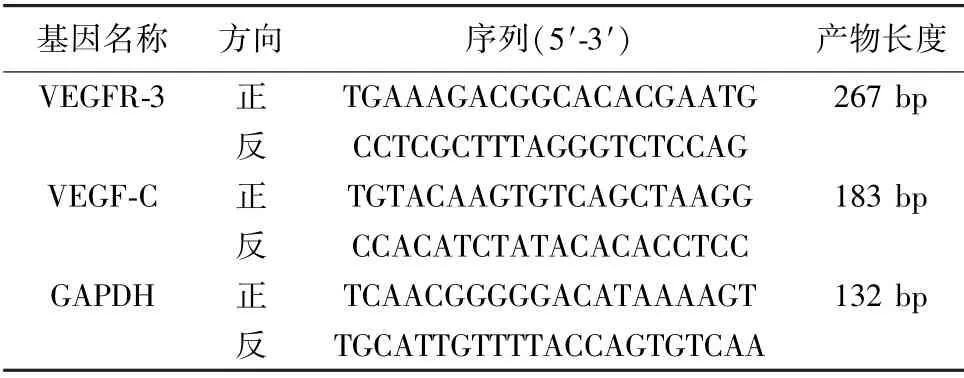
表1 q-RT-PCR 引物序列
1.7 Western 印迹检测肝脏组织VEGFR-3、VEGFC、SOCS1、p-GSK3β、TLR4 蛋白表达 取1.5 的最后一份肝脏组织上清液,提取蛋白后经BCA 试剂盒测定浓度。取50 μg 蛋白样品进行电泳、转膜,室温下用5%脱脂牛奶封闭1 h,加入VEGFR-3、VEGFC、SOCS1、p-GSK3β、TLR4、β-actin 抗体,除β-actin稀释倍数为1 ∶2 000 外,其他抗体的稀释倍数均为1 ∶1 000;4℃摇床过夜孵育,加入HRP 羊抗兔二抗(1 ∶2 000),37℃摇床孵育1 h,增强化学发光法显色后,使用凝胶成像仪观察蛋白条带并拍照,并用Image-J 软件分析蛋白的相对表达水平。
1.8 统计学分析 采用SPSS22.0 软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1 各组肝脏组织HE 染色结果 Sham 组肝脏组织正常。SOLT 组肝脏组织出现肝细胞空泡样变性,细胞核固缩、溶解、坏死,炎性细胞浸润等病理损伤。与SOLT 组相比,Dex 各剂量组可见肝血窦轻度扩张、肝细胞空泡样变性、肝细胞核固缩、坏死及炎症细胞浸润等病理损伤逐渐减少。见图1。

图1 各组肝脏组织(HE 染色,×200)
2.2 各组血清肝功能指标检测结果 与Sham 组相比,SOLT 组血清ALT、TBIL 含量显著上升(P<0.05);Dex 低、中、高剂量组与SOLT 组相比,ALT、TBIL 含量显著下降(P<0.05),且各剂量组上述指标呈剂量依赖性(P<0.05)。见表2。
2.3 各组肝组织炎性因子检测结果 与Sham 组相比,SOLT 组肝组织TNF-α、IL-6 含量显著增高(P<0.05);Dex 低、中、高剂量组与SOLT 组相比,TNF-α、IL-6 水平呈剂量依赖的方式下降,差异有统计学意义(P<0.05)。见表2。
2.4 各组肝脏组织VEGFR-3、VEGF-C mRNA 水平检测结果 与Sham 组相比,SOLT 组肝脏组织VEGFR-3 mRNA、VEGF-C mRNA 相对表达水平均显著升高(P<0.05);与SOLT 组相比,Dex 低、中、高剂量组肝脏组织VEGFR-3 mRNA、VEGF-C mRNA均呈剂量依赖的方式增加,差异有统计学意义(P<0.05)。见表2。
表2 各组血清肝功能指标ALT、TBIL 含量和肝组织炎性因子TNF-α、IL-6 含量及VEGFR-3、VEGF-C mRNA 相对表达水平比较(±s,n=10)
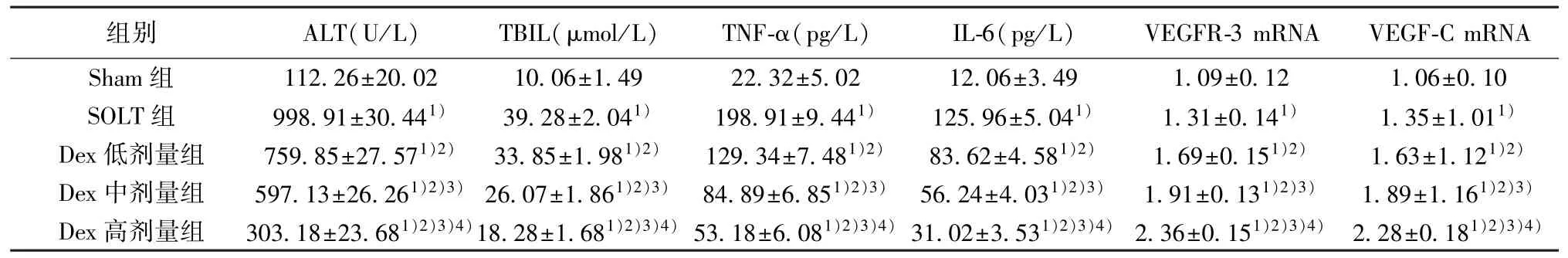
表2 各组血清肝功能指标ALT、TBIL 含量和肝组织炎性因子TNF-α、IL-6 含量及VEGFR-3、VEGF-C mRNA 相对表达水平比较(±s,n=10)
与Sham 组比较:1)P<0.05;与SOLT 组比较:2)P<0.05;与Dex 低剂量组比较:3)P<0.05;与Dex 中剂量组比较:4)P<0.05;表3 同
组别ALT(U/L)TBIL(μmol/L)TNF-α(pg/L)IL-6(pg/L)VEGFR-3 mRNAVEGF-C mRNA Sham 组112.26±20.0210.06±1.4922.32±5.0212.06±3.491.09±0.121.06±0.10 SOLT 组9 98.91±30.441)39.28±2.041)198.91±9.441)125.96±5.041)1.31±0.141)1.35±1.011)Dex 低剂量组759.85±27.571)2)33.85±1.981)2)129.34±7.481)2)83.62±4.581)2)1.69±0.151)2)1.63±1.121)2)Dex 中剂量组597.13±26.261)2)3) 26.07±1.861)2)3) 84.89±6.851)2)3) 56.24±4.031)2)3)1.91±0.131)2)3)1.89±1.161)2)3)Dex 高剂量组303.18±23.681)2)3)4)18.28±1.681)2)3)4) 53.18±6.081)2)3)4) 31.02±3.531)2)3)4) 2.36±0.151)2)3)4) 2.28±0.181)2)3)4)
2.5 各组肝脏组织VEGFR-3、VEGF-C、SOCS1、p-GSK3β、TLR4 蛋白表达结果 与Sham 组相比,SOLT 组肝脏组织蛋白VEGFR-3、VEGF-C、SOCS1、p-GSK3β、TLR4 水平均显著增高(P<0.05);Dex 低、中、高剂量组与SOLT 组相比,VEGFR-3、VEGF-C、SOCS1、p-GSK3β 蛋白表达水平均显著升高(P<0.05),TLR4 水平显著降低(P<0.05),且呈剂量依赖性,差异有统计学意义(P<0.05)。见表3、图2。
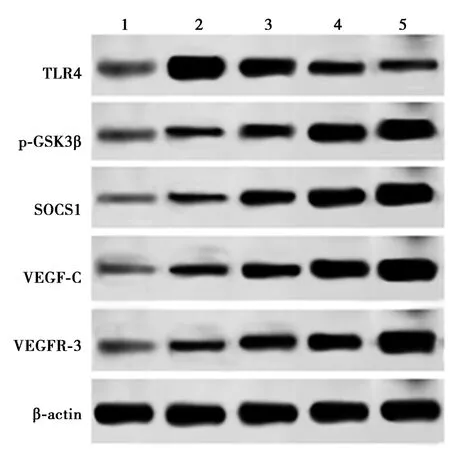
图2 各组肝脏组织VEGFR-3、VEGF-C、SOCS1、p-GSK3β、TLR4 蛋白表达
表3 各组肝脏组织VEGFR-3、VEGF-C、SOCS1、p-GSK3β、TLR4 蛋白表达比较(±s,n=10)
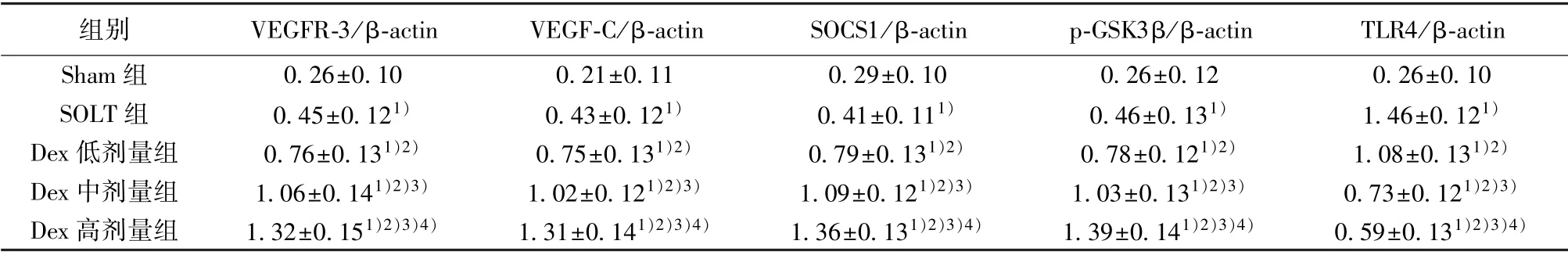
表3 各组肝脏组织VEGFR-3、VEGF-C、SOCS1、p-GSK3β、TLR4 蛋白表达比较(±s,n=10)
组别VEGFR-3/β-actinVEGF-C/β-actinSOCS1/β-actinp-GSK3β/β-actinTLR4/β-actin Sham 组0.26±0.100.21±0.110.29±0.100.26±0.120.26±0.10 SOLT 组0.45±0.121)0.43±0.121)0.41±0.111)0.46±0.131)1.46±0.121)Dex 低剂量组0.76±0.131)2)0.75±0.131)2)0.79±0.131)2)0.78±0.121)2)1.08±0.131)2)Dex 中剂量组1.06±0.141)2)3)1.02±0.121)2)3)1.09±0.121)2)3)1.03±0.131)2)3)0.73±0.121)2)3)Dex 高剂量组1.32±0.151)2)3)4)1.31±0.141)2)3)4)1.36±0.131)2)3)4)1.39±0.141)2)3)4)0.59±0.131)2)3)4)
3 讨 论
肝移植为目前治疗终末期肝病的唯一手段,也是国内外器官移植领域研究的热点之一〔11〕。但肝移植过程中,切除受体肝脏,原位植入供肝而引起的IRI 是导致肝功能损伤、肝移植失败和患者死亡的主要原因之一〔12,13〕,因此寻找降低肝移植过程中IRI 的方法,是广大学者探究方向之一。本研究提示肝移植过程中出现IRI 现象,表明造模成功。
近来研究发现Dex 对肝损伤具有保护作用。王清平等〔14〕研究发现Dex 减轻自体SOLT 术大鼠IRI的机制与抑制肝脏程序性坏死有关;陈贵珍等〔15〕研究发现在肝肿瘤切除术过程中,Dex 可降低肝脏氧化应激及炎性损伤,减轻肝脏IRI。本研究结果提示Dex 能缓解自体SOLT 术大鼠肝脏IRI 损伤,与上述文献〔14〕研究结果一致,但Dex 可缓解自体SOLT术大鼠肝脏IRI 损伤的具体分子生物学机制还不甚明确,本研究对此进行继续探讨。
VEGFR-3/VEGF-C 信号通路是调节淋巴管生成和血管生成的关键通路之一〔16〕,VEGFR-3 与VEGF-C 结合不仅可抑制炎症通路TLR4-核因子(NF)-κB 通路激活,增加抗炎因子的表达,还可能上调SOCS1 和p-GSK3β 表达,调控磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(Akt)通路,影响细胞增殖等一系列生物活动进程〔17,18〕。研究发现,VEGFR-3/VEGF-C 信号通路也参与肝移植IRI 损伤过程,研究发现〔5〕外源性VEGF-C 通过上调SOCS1 和p-GSK3β 表达,调节炎症反应、改变库普弗细胞(KCs)的极化作用,保护肝脏移植物免受IRI 的侵害。Zhang 等〔19〕发现VEGFR-3 与VEGF-C 结合后通过调节PI3K-Akt 信号通路和SOCS1 表达,抑制TLR4/NF-κB 的激活,进而抑制内毒素休克症的发生。Ren 等〔20〕发现p-GSK3β 可抑制GSK3β 活性,增加IL-10 产生,并改善肝脏IRI。本研究提示肝移植IRI过程中机体内源性VEGF-C/VEGFR-3 通路激活,可能促进SOCS1、p-GSK3β 表达,抑制TLR4/NF-κB 炎症通路激活,进而保护机体抵抗炎症损伤,然而VEGF-C/VEGFR-3 激活对NF-κB 炎症通路的抑制作用有限,肝移植后大鼠肝组织中TLR4 及下游炎性因子表达均增高,导致肝炎性损伤;Dex 可进一步激活 VEGF-C/VEGFR-3 通路, 上调 SOCS1、p-GSK3β 表达,进而抑制机体TLR4 炎症通路激活,可能是其改善肝移植IRI 的作用机制。
综上所述,Dex 可激活SOLT 肝组织VEGF-C/VEGFR-3 通路,减轻肝组织炎症,改善肝移植IRI。这可能为阐明Dex 保护肝移植IRI 的机制提供一定参考,但VEGF-C/VEGFR-3 通路靶标分子及调控机制复杂,本研究未设置通路抑制剂进行验证,具体生物学机制仍需继续研究。
