奥美拉唑和艾司奥美拉唑治疗幽门螺杆菌阳性胃溃疡的疗效和不良反应对比
2022-12-27章毅芳林峰华
章毅芳 林峰华
(1 厦门市中心血站血液供应部,福建 厦门 361000;2 厦门市海沧医院消化内科,福建 厦门 361021)
消化性溃疡是全球常见病,目前国内外对消化性溃疡致病机制的研究有多种理论,其中Shay提出的平衡失调理论学说认为,一种或数种损害因素的攻击对胃肠道黏膜造成损伤,这种损伤大于黏膜自身修复的能力,再加上其他如精神因素、遗传因素等的参与导致了一系列综合结果。早在20世纪初,Schwartz就提出了“无酸,无溃疡”的概念,为消化性溃疡(peptic ulcer,PU)病因的研究奠定了基础,也为其治疗指明了方向。抑酸剂能提高胃内pH值而降低胃酸对胃黏膜的破坏,其中质子泵抑制剂(PPIs)更是治疗消化性溃疡的首选抑酸药物。目前临床上使用的PPIs药理机制为通过H+-K+-ATP酶的跨膜部分与酶结合,抑制酶的活性而发挥疗效,各类PPIs的特性又因其在基础结构上引入的化学基团不同而有所差异。本研究选取86例胃溃疡患者分组治疗,探讨并比较奥美拉唑和艾司奥美拉唑的疗效和不良反应,报道如下。
1 资料与方法
1.1 一般资料 选取2020年7月至2021年4月在厦门市海沧医院就诊的86例Hp(+)的胃溃疡患者,随机分为两组,每组43例。其中奥美拉唑组患者的平均年龄(42.91±13.05)岁,平均病程(6.51±3.09)年;艾司奥美拉唑组患者的平均年龄(43.07±11.95)岁,平均病程(6.55±3.06)年。两组病例的一般资料采用t检验比较,结果差异无显著性(P>0.05)。本研究不违反国家法律法规,符合医学伦理原则。
1.2 病例选择标准 纳入标准:年龄在20~65周岁;以《消化性溃疡诊断与治疗规范(2016)》[1]中纳入的诊断标准为依据,经消化内镜及病理检查确诊为PU;实验室检查Hp为阳性。排除标准:既往或治疗过程中对药物发生过敏反应者;处于哺乳期或者妊娠期的患者;依从性不高者;伴有脏器功能不全或者慢性基础疾病需要长期服药者;伴有恶性肿瘤者;合并精神类疾病者。
1.3 方法 两组均给予阿莫西林(浙江金华康恩贝生物制药有限公司,国药准字H33021381)、克拉霉素(广东东阳光药业有限公司,国药准字H20183466)和复方铝酸铋(辽宁奥达制药有限公司,国药准字H10950319)治疗,同时奥美拉唑组给予奥美拉唑(山东罗欣药业集团股份有限公司,国药准字H20033444),艾司奥美拉唑组给予艾司奥美拉唑(广东东阳光药业有限公司,国药准字H20203210)。奥美拉唑组治疗方法:奥美拉唑 20 mg,每日2次;复方铝酸铋1.3 g,每日3次;阿莫西林0.5 g,每日2次;克拉霉素0.5 g,每日2次。2周后单独使用奥美拉唑20 mg,每日2次,继续治疗4周。艾司奥美拉唑组治疗方法:艾司奥美拉唑20 mg,每日 2次;复方铝酸铋1.3 g,每日3次;阿莫西林0.5 g,每日2次;克拉霉素0.5 g,每日2次。2周后单独使用艾司奥美拉唑20 mg,每日2次,继续治疗4周。
1.4 观察指标[2]①主要临床症状缓解时间:腹痛、腹胀、反酸。②治疗结束后2周行胃镜检查了解患者溃疡愈合程度及Hp根治与否。③不良反应:恶心、头晕头痛、腹泻、乏力、皮疹等。④计算两组治疗成本。
1.5 疗效判定标准[3]患者临床症状全部消失,复查胃镜溃疡愈合视为治愈;患者临床症状缓解,体征改善,复查胃镜溃疡面积缩小50%及以上视为治疗有效;患者临床症状未好转甚至加重;复查胃镜溃疡面积缩小未达50%视为治疗无效。总有效率=(治愈数+有效数)/总病例数×100%。
1.6 统计学处理 数据采用SPSS 20软件进行分析,计量资料组间差异采用t检验进行比较;计数资料组间差异采用χ2检验进行比较,P<0.05时认为差异显著,有统计学意义。
2 结果
2.1 疗效对比 从治疗的总有效率来看,艾司奥美拉唑组高于奥美拉唑组,组间比较差异显著(χ2=5.460,P<0.05)。见表1。

表1 两组患者疗效数据比较
2.2 临床症状缓解时间对比 艾司奥美拉唑组缓解腹痛症状时间短于奥美拉唑组,缓解腹胀症状时间短于奥美拉唑组,缓解反酸症状时间短于奥美拉唑组,组间差异显著(t=3.269、5.043、4.140,P<0.05)。见表2。
表2 两组患者症状缓解时间数据比较(d,)
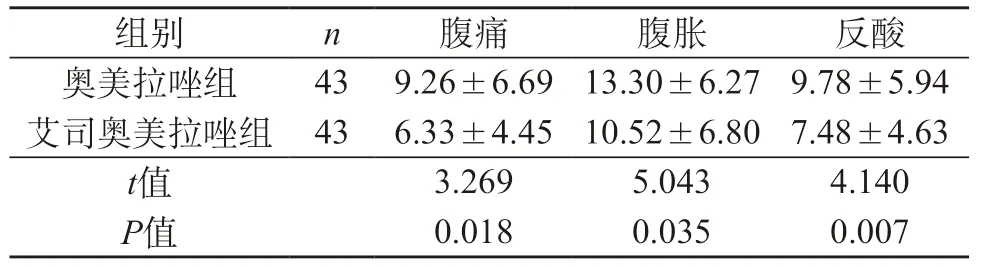
表2 两组患者症状缓解时间数据比较(d,)
2.3 不良反应发生率对比 两组病例使用药物过程中不良反应发生率差异无统计学意义(χ2=0.717,P>0.05)。见表3。
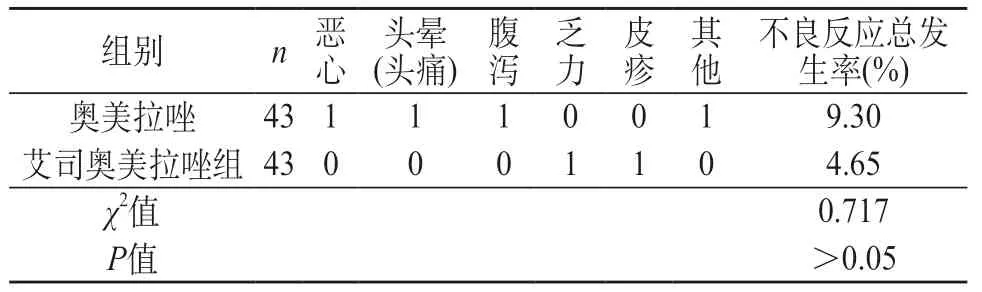
表3 两组患者不良反应发生率对比
2.4 Hp转阴率对比 两组病例治疗Hp转阴率差异无统计学意义(χ2=0.081,P>0.05)。见表4。
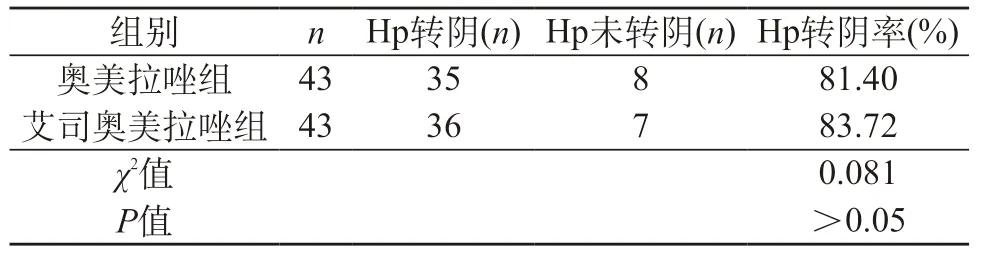
表4 两组患者Hp转阴率对比
2.5 成本对比 艾司奥美拉唑组的治疗成本高于奥美拉唑组,差异显著,P<0.05。见表5。
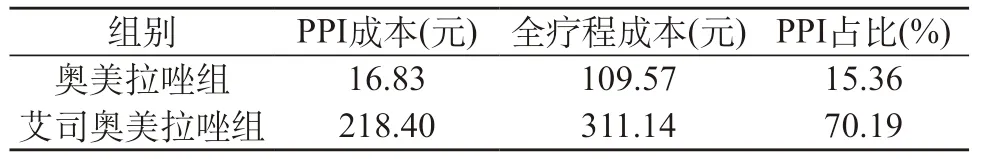
表5 两组患者治疗药物成本对比
3 讨 论
PU是一种常见的胃肠道疾病,其发病率和患病率在全球范围内均呈上升趋势[4]。闽南地区饮食杂博,饮茶风俗普及,有“早茶晚酒”的说法,浓茶、烈酒、高盐等因素均易导致胃黏膜损伤,从而增加胃溃疡发生的危险。
胃酸与胃蛋白酶自身消化是胃溃疡的致病因素之一,Hp感染也是导致胃溃疡重要的病因,目前临床上多采取抑制胃酸和根治Hp感染为主的综合性治疗措施。《Hp胃炎京都全球共识报告(2015)》中明确指出无论是否有临床症状、并发症或随后发生的疾病,幽门螺杆菌胃炎都应被视为一种传染性疾病。无论是否与症状相关,凡有幽门螺杆菌感染的人都应接受根除治疗[5]。《第五次全国幽门螺杆菌感染处理共识报告(2017)》中也指出Hp感染是消化性溃疡主要病因,应对Hp进行检测和根治,无论溃疡是否活动及是否合并并发症[6]。对于缺乏分餐制习惯的国人而言,公筷公勺的使用仍不可避免地面临一些现实的困境,这给幽门螺杆菌的治疗及预防复发带来一定困难。此外,Hp耐药性上升也是影响其根除的重要原因,我国Hp感染率高,流行病学调查显示患病率为41.35%~72.30%,随研究人群、地理区域和社会经济条件的不同而有所变化。且存在对克拉霉素、左氧氟沙星和甲硝唑普遍耐药的情况[7]。14 d三联疗法(PPIs+阿莫西林+克拉霉素;PPIs+阿莫西林+左氧氟沙星;PPIs+阿莫西林+甲硝唑)加入铋剂能提高Hp根除率[8-9]。
对于Hp(+)的消化性溃疡患者,在14 d的抗Hp治疗结束后,应继续使用质子泵抑制剂至疗程结束,胃溃疡治疗通常为6~8周[1]。奥美拉唑和艾司奥美拉唑均属于不可逆质子泵抑制剂,目前临床上使用的各类PPIs是在奥美拉唑结构的基础上,在吡啶环和苯并咪唑上引入不同的电子基,其药理活性和化学不稳定性发生相应变化。奥美拉唑和艾司奥美拉唑在体内主要由药物代谢酶P450的同工酶CYP2C19和CYP3A4代谢。由于药物代谢酶P450是优先以R-异构体为底物,因此相较于奥美拉唑,S-型异构体艾司奥美拉唑具有更高的生物利用度。AUC与奥美拉唑和艾司奥美拉唑抑酸作用有良好的相关性,口服艾司奥美拉唑后的AUC约为奥美拉唑的2倍[10],这种药代动力学的差距在临床上表现为更优越的疗效,临床效果更持久而稳定[11-12],可有效加快康复,减小溃疡面积[13-14]。
PPIs(雷贝拉唑除外)均为CYP2C19酶抑制剂,CYP2C19酶中等位基因常易产生突变,这种突变可能导致酶活力下降,在与其他药物联合使用时易产生相互作用,影响其药代动力学[16]。艾司奥美拉唑与其他药物相互作用的潜力较低,虽然由于艾司奥美拉唑主要由CYP2C19和CYP3A4代谢(前者起主要作用,埃索美拉唑对CYP3A4的亲和力比对CYP2C19的亲和力大约低10倍),因此可能会与作为这些同工酶的诱导剂或抑制剂的药物相互作用而产生不良反应[17-18],但也有研究认为这种相互作用没有临床意义[19-20]。本研究中两组总体不良反应发生率无明显差异,与徐晓阳等[21]的研究结果相符;但有研究显示,相较于奥美拉唑,艾司奥美拉唑不良反应发生率较低[11]。
质子泵抑制剂的临床应用极大地丰富了与酸相关疾病的治疗方法,降低了外科手术的实施率。PPIs通常耐受性良好,但伴随着越来越广泛和长期的使用,也带来了一些问题,如药物治疗成本的增加,以及对患者的潜在不良反应。因此,有必要在开始PPIs治疗前认真评估患者的适应证,以便在日常临床实践中正确有效地使用此类药物。
