子宫内膜息肉行宫腔镜下电切术与宫腔镜下刮除术疗效分析
2022-12-27夏叶红
夏叶红
(江苏省无锡市锡山人民医院东亭分院,江苏 无锡 214000)
2020年第5版世界卫生组织(WHO)女性生殖系统肿瘤分类将子宫内膜息肉(endometrial polyp,EP)归入子宫的肿瘤样病变中,定义为:是一种局限的息肉样良性病变,可使子宫内膜腺体发生增生紊乱和间质发生改变,病变经常伴有明显的血管成分[1]。子宫内膜息肉可引起AUB-P及不孕[2]。有部分患者无任何临床症状表现,有些部分可表现为月经过多、绝经后出血、不孕[3]。子宫内膜息肉的高发群体为育龄期女性和绝经期后的妇女。目前子宫内膜息肉的病因仍不明确,多认为与患者内分泌功能紊乱、雌激素水平变化、受妇科炎症的长时间刺激等有关。经阴道超声具有方便、安全、准确率高的优点,目前检查内膜息肉的首选影像学方法[4-5]。既往临床子宫内膜活检、刮宫、盲检对子宫内膜息肉的诊断是不准确的。手术治疗目前是子宫内膜息肉的主要治疗方法,主要方式有刮宫术、子宫切除术、宫腔镜下子宫内膜息肉电切除术及子宫内膜切除术等。但常规的刮宫术术中出血多,对患者机体损伤大,且复发率较高。而宫腔镜下子宫内膜息肉电切除术可依患者个体差异合理地调整手术方案,如子宫息肉的位置、大小、手术风险等因素[6]。本院目前对于子宫内膜息肉的治疗主要采用两种方式:宫腔镜下子宫内膜息肉刮勺刮除术、宫腔镜下子宫内膜息肉电切除术(TCRP)。有研究发现[7],宫腔镜子宫内膜息肉刮勺刮除术后子宫内膜息肉仍有复发风险,复发率达13.3%。不同的手术方式,术后复发情况不同。观察我院收治的65例子宫内膜息肉两种手术方法术后复发情况,旨在比较发现复发率更低、复发时间更迟、更符合卫生经济学的手术方法,本观察证实电切术手术时间短,术后阴道出血时间短,术后复发更低,复发间隔时间更长,但手术费用相对偏高,报道如下。
1 资料与方法
1.1 一般资料 选取我院于2018年1月1日至2020年 12月31日收治的首次超声发现子宫内膜息肉、无生育要求的65例患者作为观察对象,术后均经病理诊断证实。术前收纳标准:①经两次月经后(绝经后无症状间隔1个月)超声诊断的子宫内膜息肉直径≥1 cm,伴或不伴月经异常。②绝经后超声诊断的子宫内膜息肉直径<1 cm,经抗感染治疗1个周期后超声复查无明显缩小的子宫内膜息肉。③绝经后超声诊断的子宫内膜息肉直径<1 cm,有阴道出血的患者。④未绝经患者经超声诊断子宫内膜息肉直径<1 cm伴有异常子宫出血的患者。⑤未绝经经超声证实子宫内膜息肉直径<1 cm、无异常子宫出血患者,无口服地屈孕酮禁忌证,经过3个月孕激素:地屈孕酮(达芙通,Abbott Healthcare Products B.V,进口药品注册证号H20170221 10 mg)后半周期治疗后复查超声显示直径无明显缩小。排除标准:①有内科并发症(高血压、糖尿病等)。②有宫腔镜手术禁忌证、麻醉禁忌证。③体质量指数≥30 kg/m2。异常子宫出血诊断标准:是指与正常月经的周期频率、规律性、经期长度、经期出血量任何1项不符的、源自子宫腔的异常出血,不包含青春发育前和绝经后出血[8]。
1.2 手术方法
1.2.1 观察组 39例行宫腔镜下子宫内膜息肉电切术(使 用OLYMPUS等离子双极宫腔镜电切系统直径8.5 mm 的电切镜,电切功率200 W,电凝功率100 W,电切丝为一次性医用耗材),手术时机:月经干净后3~7 d内,术前6~8 h禁食、禁水,静脉麻醉成功后以0.9%氯化钠溶液作膨宫介质,将宫压力维持在90~100 mm Hg。宫腔镜确定内膜息肉位置、大小、数目。电切深度达蒂根下2~3 mm,避免损伤周围正常内膜。可电凝创面止血。
1.2.2 对照组 26例行宫腔镜检查(使用OLYMPUS直径6.0 mm检查镜系统),手术时机:月经干净后3~7 d内,术前6~8 h禁食、禁水,静脉麻醉成功后以0.9%氯化钠溶液作膨宫介质,将宫压力维持在 90~100 mm Hg。宫腔镜确定内膜息肉位置、大小、数目。再予相应刮勺定点刮除,尽量减少损伤周围正常内膜组织,再宫腔镜下检查,有残留则重复以上操作,均无须电凝止血。
1.2.3 术后均经病理诊断证实为子宫内膜息肉。
1.3 临床疗效评价 术后病理回报后未绝经患者(排除口服地屈孕酮禁忌证)均给予地屈孕酮每日20 mg后半周期口服,连续14 d,连续3个月,常规每3个月随访1次,如有异常症状及时随诊,共随访18个月,随访内容:手术费用、手术时间、术后阴道出血时间、术后月经复潮时间、超声诊断子宫内膜息肉复发时间、子宫内膜息肉复发率。
1.4 统计学方法 采用SPSS26.0软件统计学软件进行数据分析,分析不同手术方法在年龄、BMI、孕次、(最大)子宫内膜息肉直径(超声测量)、单发息肉比例、手术费用、术后阴道出血时间、术后月经复潮时间、子宫内膜息肉复发时间(超声测量)的差异。两组中多组样本间非正态计量资料比较采用Kruskal-Wallis秩和检验,计数资料用卡方检验做差异比较,结果用频数和百分比表示;计量资料用独立样本t检验作差异比较,结果用平均值和标准差表示。P<0.05表示差异有统计学意义。
2 结果
2.1 两组基础资料的比较 观察组与对照组在年龄、孕次、BMI、(最大)息肉直径大小、单发息肉比例方面无明显差异性(P>0.05),具有可比性。见表1。
表1 65例患者一般资料组间差异比较()
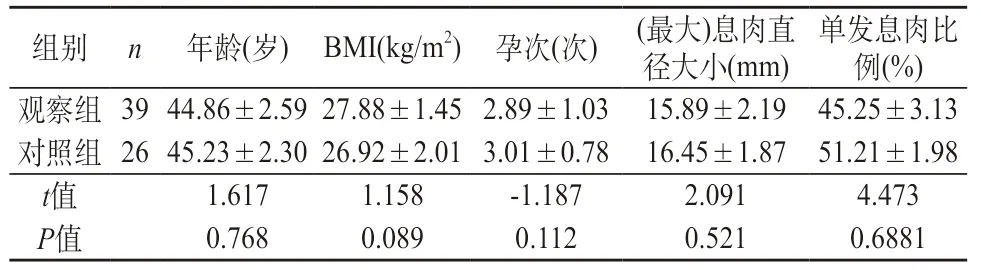
表1 65例患者一般资料组间差异比较()
2.2 两组术后观察指标的比较 观察组手术时间明显短于对照组,术后阴道出血时间明显短于对照组,复发时间长于对照组,复发率明显低于对照组,但费用明显高于对照组,有明显差异性,均P<0.05;术后月经复潮时间无明显差异性,P>0.05。见表2。
表2 65例患者术后观察指标组间差异比较()
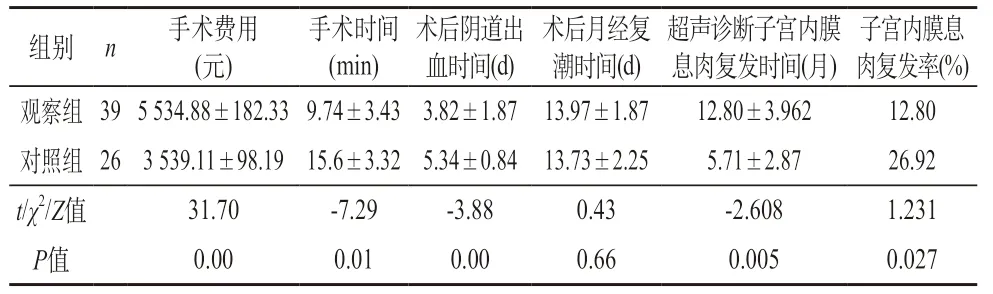
表2 65例患者术后观察指标组间差异比较()
3 讨 论
3.1 子宫内膜息肉的发生及常见类型 子宫内膜息肉是子宫局部内膜过度生长所致,数量可单发或多发,直径从数毫米到数厘米,可分无蒂和有蒂。息肉由子宫内膜腺体、间质和血管组成[9]。子宫内膜息肉是一种子宫内膜的良性增生。病理学分类中[10],增生性息肉最常见,起源于内膜基底层,对雌激素敏感;功能性息肉也对卵巢雌孕激素周期性刺激有反应,表现与周围内膜相似的腺体变化;萎缩性息肉是绝经后妇女子宫内膜息肉的主要类型,通常是功能性息肉和增生性息肉的退行性改变;腺肌瘤样息肉是息肉中含有平滑肌细胞和显微组织,可伴有不典型增生的间质;假性息肉通常为直径小于1 cm的无蒂息肉,结构与周围组织完全相同,常在经前分泌期发现,而月经来潮后可脱落。子宫内膜息肉本身的形成可能与炎症和机械损伤、局部激素环境紊乱、基底层内膜局限性过度生长、细胞增殖凋亡失衡等有关[11-12]。多因素促使了子宫内膜息肉的形成及复发。
3.2 子宫内膜息肉的影响 子宫内膜息肉可引起异常子宫出血、不孕,部分可发生恶变。内膜息肉的恶变率不到3%,绝经和异常子宫出血是内膜息肉恶变的高危因素。息肉恶变几乎均为子宫内膜样癌,浆液性癌占10%左右,也有透明细胞癌和癌肉瘤的少见类型。内膜息肉恶变的治疗与子宫内膜癌的原则是一致的。与子宫内膜癌一样,内膜息肉恶变也没有明确症状的情况,密切监测随访和恰当的干预处理同样重要[4]。随着经阴道超声等影像学的完善,子宫内膜息肉的诊断变得更便捷、高效。对于有异常子宫出血、不孕及绝经后有或无症状患者经超声检查发现的子宫内膜息肉进行适当的干预是推荐的。
3.3 子宫内膜息肉的诊断及治疗 约25%的子宫内膜息肉(直径<1 cm)可自然剥脱,对于此类患者可采用期待疗法或孕激素药物性刮宫进行治疗,但以上方式不适用于中、重度贫血患者[13]。手术可获得标本进行病理诊断。根据病史、症状、妇科检查和阴道超声检查,可做出子宫内膜息肉的初步诊断。确诊需在宫腔镜下切除子宫内膜息肉并行组织病理学检查[6]。病理是诊断子宫内膜息肉良恶性的金标准,宫腔镜是获取息肉组织的首选方案[14]。既往研究认为息肉的获取方法对病理检查结果有一定影响,当刮出组织过于破碎时,病灶与周围正常内膜混在一起,基底部较宽的息肉容易切割过于破碎,息肉碎片与内膜条混在一起,使病理医师难以判断,易增加病理诊断的难度甚至漏诊,在宫腔镜直视下获得完整的息肉将会得到更可靠的组织学判定。尤其针对绝经后患者,子宫内膜息肉大多萎缩、扁平,单纯刮宫难以刮除,无法取到标本或获取标本少,使病理诊断符合率 降低[15]。
宫腔镜下子宫内膜息肉切除的常用方法有:非能量器械包括机械性切除、冷刀切除、组织粉碎及回收一体系统(刨削系统)切除;能量器械如电刀的单极电切及双极电切[6]。目前,常应用于子宫内膜息肉手术的宫腔镜手术系统有:显微剪刀或抓钳、宫腔镜刨削系统、单/双极电切系统。目前尚无权威证据提示电切系统与冷刀系统在切除息肉的复发率及并发症方面存在差别[16]。2005年日本Olympus公司推出了等离子双极电切镜系统,用于宫腔镜子宫内膜电切、内膜息肉电切、黏膜下肌瘤电切等手术,也称为经宫颈生理盐水切除术(TCRis)[17]。等离子电切较单极电切更为安全,其能量来自生理盐水的崩解,为低温(40~70 ℃)切割。电切的优点:手术时既可以电切又可电凝,止血效果好。缺点:操作难度较大,不易掌握;电切可能损伤临近正常的内膜组织,影响子宫内膜上皮化过程,增加粘连的风险[18]。手术应由经过适当培训和经验丰富的医师进行,并应使用最小的电能,以避免医源性损伤子宫内膜腔[19-20]。诊断性刮宫可作为替代性的诊治方案[4]。
本院在2018年前后行宫腔镜检查、病损定位、刮勺刮除术,术中创面未行电凝术,是传统诊断性刮宫术的延伸,是宫腔镜下诊断性刮宫术的进一步诠释,在理论及实际操作上优于传统的诊断性刮宫术,术中不使用电能,不产生电热损伤。近几年来行宫腔镜下子宫内膜息肉电切术,术中行或不行电凝术,该方案是治疗子宫内膜息肉的主要方法。经过本观察分析,在观察组与对照组年龄、孕次、BMI、(最大)息肉直径大小、单发息肉比例方面无明显差异性的情况下:①观察组手术时间短于对照组:观察组在宫腔镜直视下电切除子宫内膜息肉,在直视下电切丝夹出标本,减少术中无效操作;对照组宫腔镜检查定位后刮勺刮除,卵圆钳取出标本,宫腔镜再次检查,如有残留需刮勺再次进入宫腔,重复前次操作步骤,可能导致宫腔镜频繁进出宫腔,导致手术时间延长。②观察组术后阴道出血时间短于对照组:观察组在直视下更精准的控制了切割范围,避免正常内膜组织的过多破坏,缩短了创面修复时间。③观察组术后的复发率明显低于对照组,复发时间明显延后于对照组:与电切术更精准切除子宫内膜息肉达子宫内膜基底层,并同时对息肉蒂部、创面血管进行电灼气化,阻止或延缓了息肉再生,虽无生育要求,但仍最大化保护了患者的生育能力,但手术技术要求高;对照组:息肉中常伴有纤维化及厚壁血管成分[2],宫腔镜下刮勺刮除术可能存在内膜基底层息肉蒂部分或完全残留,创面血管裸露,是促使息肉再次复发的因素之一。④术中使用一次性医用耗材电切丝,住院医疗费用明显增加,增加医保支出及患者负担。因本观察入组样本量有限,可能存在偏差,且本观察组为无生育要求患者,未对术后宫腔粘连、妊娠率等进行统计分析。
本观察提示:宫腔镜下子宫内膜息肉电切术(除医疗费用外)优于宫腔镜下刮勺刮除术。但本院使用的电切丝为一次性医用耗材,目前仍未划入医保目录,在一定程度上增加了患者住院负担,也引起了一些不必要的医患矛盾。购买其他新型设备需要进一步申请、论证、审批,已购置的设备将面临使用率降低、搁置的问题。期待一次性使用的电切丝进入医保目录,在DRGS控费的医疗政策下,寻求最优医疗路径及方法。医疗费用和治疗效果总是医患双方讨论及关注的焦点。日后我们需要对能量器械与非能量器械在切除息肉的复发率、术后并发症、治疗费用、术后妊娠率等方面的差别进行临床随机对照试验及前瞻性研究,以使得患者获益最大化(创伤更小、花费更低、手术风险更小、术后复发率更低、复发时间更迟)的手术方法。
