血清miR-30b、miR-199a在新生儿缺氧缺血性脑病患儿中的表达及意义*
2022-12-26鲁利群
杨 欣,鲁利群,贺 静,黄 莉,汪 燕
成都医学院第一附属医院儿科,四川成都 610500
新生儿缺氧缺血性脑病(HIE)是导致新生儿死亡及神经系统发育障碍的重要因素。有研究表明,约有50%的脑瘫患儿是由于HIE所引起[1]。目前研究发现,早期对HIE进行治疗能够改善HIE患儿预后[2],因此寻找HIE早期诊断的生物学标志物具有重要意义。微小RNA(miRNA)是一类具有调控功能的内源性小RNA分子,参与机体多种生理、病理过程[3]。研究表明,miR-30b、miR-199a在神经系统疾病中存在异常表达,与神经系统病变有密切关系[4-6]。神经元特异性烯醇化酶(NSE)、S100B蛋白、信号素3A(SEM3A)、纤溶酶原激活物抑制剂-1(PAI-1)均是与神经系统疾病有密切关系的蛋白[7-9]。但目前关于血清miR-30b、miR-199a表达水平与HIE患儿神经损伤和预后的关系鲜有报道。本研究拟探讨血清miR-30b、miR-199a在HIE患儿中的表达及意义,现报道如下。
1 资料与方法
1.1一般资料 选择2018年1月至2020年6月本院收治的HIE患儿90例。纳入标准:(1)符合HIE的诊断标准[10];(2)足月出生儿,胎龄37~42周;(3)母体妊娠期间无严重并发症。排除标准:(1)先天性颅脑畸形者;(2)伴有颅内出血者;(3)合并脑组织感染者;(4)合并会影响研究结果的其他系统疾病者。根据患儿病情程度将其分为轻度组29例、中度组36例、重度组25例。另选择同期在本院出生的足月健康新生儿30例作为对照组。各组基线资料比较差异无统计学意义(P>0.05),具有可比性,见表1。入组新生儿家属均了解本研究内容并签署知情同意书,本研究经本院伦理委员会批准。
1.2方法
1.2.1检测标本采集及保存 于分娩后24 h内采集所有受试新生儿外周静脉血4 mL,在室温条件下静置10 min后,以4 000 r/min离心10 min,离心半径为12 cm,分离血清,并将分离的血清编号保存在-20 ℃冰箱中。
1.2.2血清miR-30b、miR-199a表达水平检测 应用实时荧光定量聚合酶链反应(qRT-PCR)检测血清miR-30b、miR-199a表达水平。取新生儿外周静脉血血清1 mL,应用Trizol法提取血清总RNA,Trizol试剂购自美国Invitrogen公司(生产批号20190392),应用分光光度计测量样品浓度,再应用Taq Man RT kit(日本Takara公司生产,批号:190284)进行反转录,提取总RNA。应用TaqMan microRNA assay(广州锐博生物公司生产,批号190528)进行扩增反应,以U6为内参,引物序列由广州锐博有限公司合成,见表2。反应体系:cDNA底物1.33 μL,TaqMan 2×Universal PCR Master Mix 10.00 μL,TaqMan microRNA assay 1.00 μL,ddH2O 7.67 μL。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,共计45个循环,每个指标设置3个复孔重复3次,完成后通过2-ΔΔCt法计算miR-30b、miR-199a表达水平。

表2 miR-30b、miR-199a及内参U6的引物序列
1.2.3血清NSE、S100B蛋白、SEM3A、PAI-1水平检测 取剩余血清中1 mL应用电化学发光法测定血清NSE水平,测定仪器为罗氏ELecsys2017电化学发光仪,试剂盒购自罗氏公司,批号:180359J;应用酶联免疫吸附试验测定血清S100B蛋白、SEM3A、PAI-1水平,试剂盒购自上海纪宁实业有限公司,批号:180719、180213、181104。严格按照试剂盒说明书进行操作。
1.2.4神经功能评估 于出生后30 d应用新生儿20项行为神经(NBNA)评分[11]评估所有受试新生儿的神经功能,该评分系统包括一般评估3项、行为能力6项、肌张力8项、原始反射3项,共20项,总分40分,评分越高表明神经功能越好。
1.2.5随访及预后评估 所有HIE患儿以门诊复查的形式随访1年,观察记录患儿神经发育情况。根据患儿预后情况将其分为预后良好组和预后不良组。患儿无神经系统异常、无智力缺陷为预后良好;存在脑瘫、癫痫等神经系统疾病、智力缺陷或死亡则为预后不良。

2 结 果
2.1各组血清miR-30b、miR-199a表达水平及神经功能、神经损伤指标水平比较 HIE患儿的血清miR-30b、miR-199a表达水平及NBNA评分低于对照组(P<0.05);趋势检验显示病情越重,HIE患儿的血清miR-30b、miR-199a表达水平及NBNA评分越低(P<0.05)。HIE患儿的NSE、S100B、SEM3A、PAI-1水平高于对照组(P<0.05);趋势检验显示病情越重,HIE患儿的NSE、S100B、SEM3A、PAI-1水平越高(P<0.05)。见表3、4。HIE患儿血清miR-30b、miR-199a及内参U6 qRT-PCR扩增曲线见图1~3。
图1 miR-30b qRT-PCR扩增曲线

表3 各组血清miR-30b、miR-199a表达水平比较

表4 各组血清神经功能及神经损伤指标水平比较

续表4 各组血清神经功能及神经损伤指标水平比较
2.2HIE患儿血清miR-30b、miR-199a表达与神经功能及神经损伤指标水平的相关性 Pearson相关分析显示,HIE患儿血清miR-30b表达与NSE、S100B、SEM3A、PAI-1水平呈负相关(r<0,P<0.05),与NBNA评分呈正相关(r>0,P<0.05);血清miR-199a表达与NSE、S100B、SEM3A、PAI-1水平呈负相关(r<0,P<0.05),与NBNA评分呈正相关(r>0,P<0.05)。见表5。
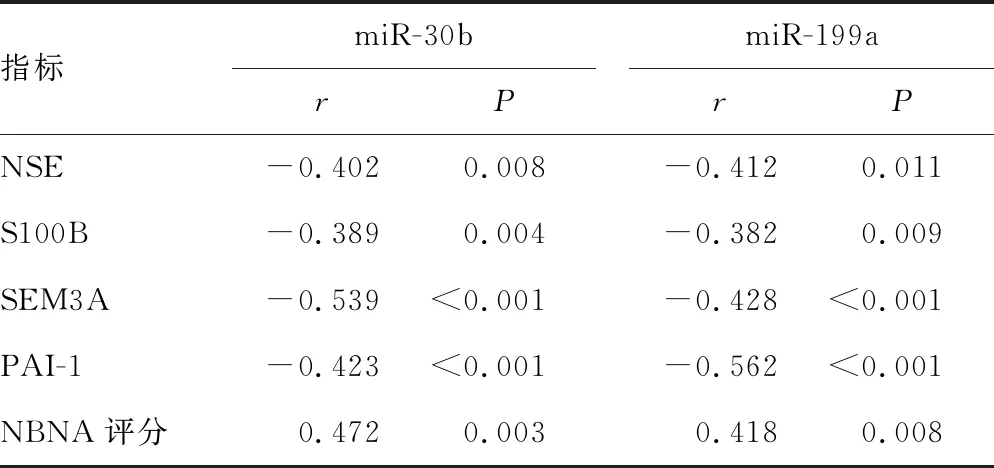
表5 HIE患儿血清miR-30b、miR-199a表达与神经功能及神经损伤指标水平的相关性
2.3不同预后HIE患儿血清miR-30b、miR-199a表达及神经功能、神经损伤指标水平比较 共87例患儿完成随访,失访3例,根据患儿预后情况将其分为预后良好组60例,预后不良组27例。预后不良组的血清miR-30b、miR-199a表达水平及NBNA评分明显低于预后良好组,NSE、S100B、SEM3A、PAI-1水平则明显高于预后良好组,差异均有统计学意义(P<0.05),见表6。

图2 miR-199a qRT-PCR扩增曲线
图3 U6 qRT-PCR扩增曲线
2.4影响HIE患儿预后的多因素Logistic回归分析 建立多因素非条件Logistic回归模型,以本研究HIE患儿为样本,HIE患儿的预后情况为因变量(预后良好=0,预后不良=1),以表6中差异有统计学意义的指标为自变量,并以所有HIE患儿各指标均值为临界值(根据实际情况适当取整),将各指标转化成二分类变量,赋值见表7。回归采用逐表后退法,α进=0.05,α退=0.10。回归结果显示:NSE≥35 g/L、S100B≥100 ng/L、SEM3A≥45 ng/mL、PAI-1≥100 pg/mL是HIE患儿预后不良的危险因素(P<0.05),miR-30b≥0.85、miR-199a≥1.25、NBNA评分≥32分则是HIE患儿预后不良的保护因素(P<0.05),见表7。

表6 不同预后HIE患儿血清miR-30b、miR-199a表达及神经功能、神经损伤指标水平比较
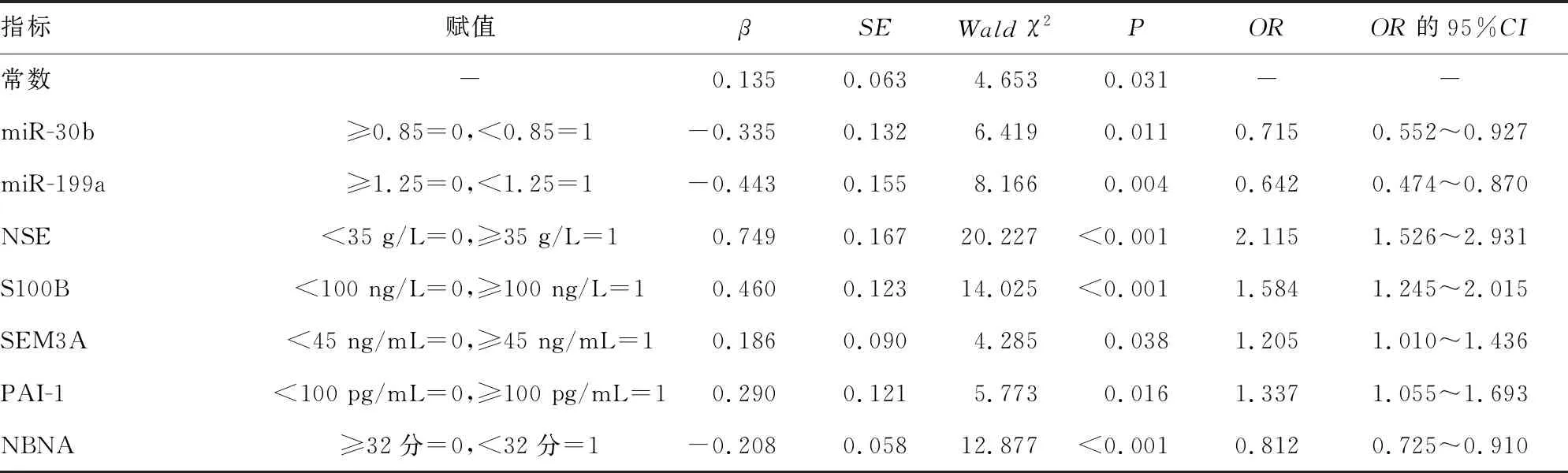
表7 影响HIE患儿预后的多因素Logistic回归分析
3 讨 论
HIE是导致新生儿神经系统功能障碍和残疾的严重疾病,其致残率和致死率均较高,患儿常遗留共济失调、脑瘫、癫痫和智力障碍等后遗症,不仅给患儿的健康带来严重的威胁,也给家庭和社会带来了沉重的负担。HIE的早期诊断并及时对患儿的神经损伤程度进行判断,有助于降低患儿病死率,改善预后。目前临床上对于HIE的诊断主要包括颅脑超声检查、头颅CT检查、脑干听觉诱发电位检查及血清学检测等[12]。其中血清学检测具有操作简单、诊断迅速、可重复观察的优点,并且血清学指标的动态变化可以反映疾病发展情况,受到临床医生的青睐。
miRNA是一类单链非编码RNA,可以在组织和血液中稳定存在。研究表明,miRNA可以与靶基因的3′非编码序列结合,调控基因表达[13]。目前已有研究发现,在新生儿HIE发生、发展中存在miRNA的异常表达,影响HIE的发展和患儿的预后[14]。PAGACZ等[15]报道,当脑组织缺氧后有23种miRNA表达上调、32种miRNA表达下调。miR-30b和miR-199a均是与大脑神经功能密切相关的miRNA。SONG等[16]研究指出,miR-30b可以通过调控多种蛋白和信号通路影响大脑突触功能,进而影响阿尔茨海默病患者的认知功能,并在大脑神经退行性病变的发生、发展中起到重要作用。miR-199a与大脑神经功能及组织缺氧有密切关系。TIAN等[17]报道,miR-199a具有促进血管内皮新生的功能。LE等[18]研究指出,miR-199a下降可以引起血管内皮功能失调,并导致血流供应障碍。SUN等[19]报道,当组织发生缺氧时,miR-199a表达水平显著降低,引起组织中缺氧诱导因子水平升高。本研究结果发现,HIE患儿血清miR-30b、miR-199a低表达,并与HIE的病情密切相关,病情越重,患儿血清miR-30b、miR-199a表达水平越低,推测当发生HIE时,脑组织缺氧缺血,导致miR-30b、miR-199a水平降低。miR-30b可以通过调控信号通路影响与神经功能相关的蛋白,加重神经元损伤,而miR-199a则可能通过引起血管内皮功能失调,引起脑组织血流供应障碍,加重患儿脑组织损伤。
本研究结果还发现,HIE患儿的NSE、S100B、SEM3A、PAI-1水平高于对照组;趋势检验显示病情越重,HIE患儿的NSE、S100B、SEM3A、PAI-1水平越高。NSE主要存在于神经细胞的胞质内及神经内分泌组织中,与神经系统的增殖、分化和代谢有密切关系[20]。S100B是一类特异性钙结合蛋白,主要存在于中枢神经系统垂体前叶细胞和星形胶质细胞中[21]。当发生HIE时,神经细胞发生缺氧损伤,血清内NSE、S100B水平升高[22]。SEM3A是一种以半胱氨酸富集区域为特征的分泌型蛋白,具有调控神经轴突生长、发育的功能[23]。PAI-1是一种促进血栓形成的因子,与心脑血管疾病的发生有密切关系[24]。笔者推测,当发生HIE时,脑血管发生缺血缺氧,PAI-1水平升高,并进一步引起脑血管内皮损伤,促进微血栓形成[25]。而HIE患儿SEM3A水平升高可能是一种代偿性升高,表明此时神经元受到损伤。通过NBNA评分可以了解新生儿行为能力,并能早期发现颅脑损伤。NBNA评分由20项内容组成,评分越低表明神经功能受损越严重[26]。本研究HIE患儿NBNA评分低于对照组,趋势检验显示病情越重,HIE患儿NBNA评分越低,表明患儿神经功能受损也逐渐加重。
KHANDELWAL等[27]研究报道SEM3A是miR-30b的调控靶基因。而LUCA等[28]报道PAI-1是miR-199a的调控靶基因。本研究中,HIE患儿血清miR-30b表达与SEM3A水平呈负相关,也提示miR-30b水平降低后可能导致其对SEM3A的抑制作用降低,导致SEM3A水平升高。miR-199a表达与血清PAI-1水平呈负相关,则提示miR-199a水平降低后可能导致其对PAI-1抑制作用降低,PAI-1水平升高,促进血栓形成从而促进HIE的发展。另外,HIE患儿血清miR-30b表达与NSE、S100B、PAI-1水平呈负相关,与NBNA评分呈正相关;血清miR-199a表达与NSE、S100B、SEM3A水平呈负相关,与NBNA评分呈正相关。这也提示miR-30b、miR-199a、NSE、S100B、SEM3A、PAI-1可能共同参与了HIE的发生和发展,其具体机制仍有待于今后深入研究。
本研究多因素分析得出:NSE≥35 g/L、S100B≥100 ng/L、SEM3A≥45 ng/mL、PAI-1≥100 pg/mL是HIE患儿预后不良的危险因素(P<0.05),miR-30b≥0.85、miR-199a≥1.25、NBNA评分≥32分则是HIE患儿预后不良的保护因素(P<0.05),提示通过对HIE患儿血清miR-30b、miR-199a表达水平进行观测,可以为HIE患儿的预后评估提供一定依据。
综上所述,本研究发现,HIE患儿血清miR-30b、miR-199a表达水平异常降低,且患儿神经损伤程度越严重其表达水平越低。miR-30b、miR-199a、NSE、S100B、SEM3A、PAI-1可能共同参与了HIE的发生和发展。血清miR-30b、miR-199a的表达水平对HIE的诊断和预后判断具有一定参考价值。
