荧光假单胞菌快速检测方法优化及在鸭肉中的检测效果评价
2022-12-26王雨涵程家耕韩千慧侯温甫
王雨涵,程家耕,张 毅,韩千慧,周 敏,侯温甫
(武汉轻工大学 食品科学与工程学院,湖北武汉 430023)
鸭肉作为中国历史悠久的肉类食材,深受消费者青睐,但其品质易受到微生物尤其是优势腐败菌的影响[1-3]。白卫东等[4]对鸭腿中的菌群结构进行了测定,发现假单胞菌在冷藏末期成为了主要的腐败菌。吴忌等[5]通过研究发现鸭腿中腐败微生物组成复杂多样,其中假单胞菌是优势腐败菌,丰度高达93.69%。因为腐败能力强,对鸭肉的品质以及新鲜度会造成影响,所以假单胞菌是评价鸭肉品质的一个重要指标。
荧光假单胞菌(Pseudomonas fluorescens)属于革兰氏阴性菌,在低温条件下也能生长,具有嗜冷特性,广泛存在于自然环境中,具有条件致病性。在低温贮存条件下,假单胞菌会在牛奶等高蛋白食物的食品原料中大量繁殖,迅速成为优势腐败菌。假单胞菌不仅会导致食品腐败变质,且有研究发现荧光假单胞菌在生长代谢过程中会产生多种溶血内毒素,进入人体血液中会导致严重休克。虽然由荧光假单胞菌导致的食品中毒事件还未见报道,但随着人们饮食习惯的改变和冷链物流体系的快速发展,假单胞菌对人体健康的潜在危害不容忽视。
生鲜肉的腐败主要起因于环境中的致腐微生物,而荧光假单胞菌是冷鲜鸭肉中重要的优势腐败菌,对其进行检测对保证冷鲜鸭肉的鲜度和安全性具有重要意义。本研究以冷鲜鸭肉中的荧光假单胞菌为研究对象,优化了荧光假单胞菌的快速检测方法,并对实际应用效果进行评估,以期以更加方便快捷的方法实现对冷鲜鸭肉中荧光假单胞菌的快速检测,及早掌握食品中腐败菌的变化,进而快速评估食品质量与安全性。
1 材料与方法
1.1 材料与试剂
本实验所涉及菌株中,4株假单胞菌标准株(铜绿假单胞菌ASI.1129、恶臭假单胞菌ATCC 14909、产碱假单胞菌ATCC 17485和荧光假单胞菌ATCC 17397)购于广东省微生物研究所,其余菌株均来源于武汉轻工大学食品科学与工程学院生鲜食品加工与安全团队实验室,为实验室前期从鸭肉中分离所得。CFC假单胞菌选择性培养基、MRS琼脂培养基、STAA培养基、气单胞菌培养基和肠道菌计数琼脂培养基(青岛海博生物技术有限公司);Probe qPCR Mix、MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0(大连宝生物工程有限公司);TaKara细菌DNA提取试剂盒(北京诺博莱德科技有限公司)。
1.2 仪器与设备
YXQ-30SII立式压力蒸汽灭菌器(上海博迅公司);DRP-9082型电热恒温培养箱(上海森信公司);CFX96Touch荧光定量PCR仪(美国伯乐公司);SW-CJ-2FD型双人单面净化工作台(苏州净化公司);HBM-400D系列样品均质器(天津恒奥公司)。
1.3 实验方法
1.3.1 荧光定量PCR引物和探针的设计
选择gyrB基因为检测的基因靶点,参考杨一林[6]的相关研究设计合成了PCR引物及相应的TaqMan探针。
1.3.2 细菌培养和DNA的提取
将荧光假单胞菌株ATCC 17397划线接种于CFC假单胞菌选择性培养基后置于30 ℃培养箱中,于30 ℃下培养36~48 h,将平板上的单菌落挑入10 mL LB液体培养液中,于30 ℃下摇动培养16 h,获得种子液,待用。参照TaKara细菌DNA提取试剂盒的使用说明对60株细菌的DNA进行提取,-20 ℃保存待用。
变型式模块创建模式充分利用现有的设计知识和设计成果,最大限度地利用现有的模块进行变型设计,创建出符合要求的新模块,基于实例的推理技术、基于变量参数的变型设计理论是该模式的理论基础和根本依据.核心环节为模块推理、模块特征参数检索和模块变型设计.
1.3.3 荧光定量PCR体系的建立与条件优化
采用20 μL体系进行PCR扩增,即Probe q PCR Mix(2X)12.5 μL、Probe(10 μM)1 μL、dd H2O 6.2 μL、上下游引物各0.4 μL及模板DNA 2 μL。
在引物设计软件推荐Tm值(56.6 ℃)附近设置10个温度梯度(53~62 ℃),对退火温度进行优化。根据试剂说明书,设置6个探针浓度,对添加的引物浓度进行优化。根据上述设置的条件进行PCR扩增,测定相应的Cq值,每组样品重复测定3次,结果取平均值。
1.3.4 荧光定量PCR特异性验证
选择来源于鸭肉中的60株供试菌进行特异性验证,将60株供试菌的DNA用优化后的参数进行PCR扩增,以无菌水作为空白对照。结果若扩增循环数(Cq值)小于35,则结果为假阳性。
1.3.5 荧光定量PCR标准曲线的构建及扩增效率
选用纯培养和人工接种两种方法测定荧光定量PCR反应的标准曲线。采用计数结果和荧光定量PCR输出的Cq值分别为横坐标和纵坐标,建立纯培养和人工接种两种方法的标准曲线,并用E=10-1/Slope-1计算荧光PCR反应的扩增效率。
1.3.6 荧光定量PCR最低检出限(LOD)的评估
将荧光假单胞菌培养到109CFU·mL-1,再用无菌生理盐水按比例稀释,获得T1(10 CFU·g-1)、T2(102CFU·g-1)、T3(103CFU·g-1)和T4(104CFU·g-1)的菌液。在无菌操作台中将生鲜鸭肉置于上述4种不同浓度的菌液浸泡30 min,沥干水分,静置20 min。取上述4组接种不同浓度假单胞菌的鸭肉样品,用荧光定量PCR技术进行PCR检测,获得相应的Cq值。同时,对鸭肉样品的菌落总数进行测定。设置3个样品平行,结果取平均值。
1.3.7 荧光定量PCR检测体系在实际样品中的应用
取鸭胸肉,随机分为两组。减菌组用50 mg·L-1二氧化氯浸泡5 min,以冰水混合物清洗去除残留后,沥干。对照组鸭胸肉以冰水混合物清洗,沥干。两组样品均在4 ℃贮藏条件下贮藏。从第0 d开始,每3 d进行一次取样,进行荧光定量PCR反应,测得相应的Cq值。
1.4 数据统计方法
实验结果用平均值±标准差的形式表达,使用IBM SPSS Statistics 25软件进行方差分析并进行Duncan检验,P<0.05表示显著差异,使用Origin 9.0绘制图形。
2 结果与分析
2.1 荧光定量PCR反应体系建立与优化
本研究对荧光定量PCR反应体系中的退火温度和探针浓度进行了优化,结果如图1所示。由图1可知,当退火温度为60 ℃时,Cq值显著低于其他退火温度(P<0.05)。在PCR反应中,退火温度升高,可大大减少引物与模板间的非特异性结合,提高PCR反应的特异性,但过高的退火温度不能导致引物序列有效退火,造成假阳性。由图2可知,随着添加的探针浓度的升高,Cq值整体呈减小的趋 势,当 探 针 浓 度 为600 nmol·L-1和500 nmol·L-1时,Cq值显著低于其他探针浓度(P<0.05)。综上所述,优化得到的退火温度为60 ℃,探针浓度为500 nmol·L-1。
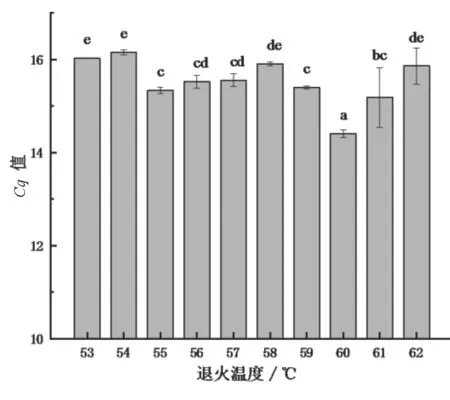
图1 不同退火温度对应的Cq值
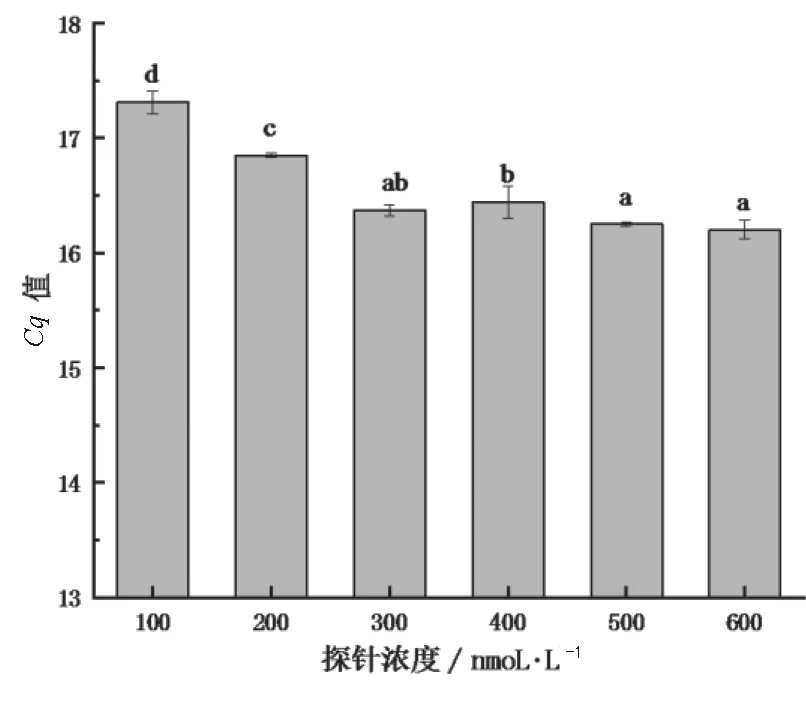
图2 不同探针浓度对应的Cq值
2.2 荧光定量PCR特异性验证
对60株供试菌进行特异性检测,其中包含21个属,有8株荧光假单胞菌,52株非荧光假单胞菌。结果表明,8株荧光假单胞菌检测结果均为阳性,其他52株菌株中有9株出现了微弱的扩增现象,其中葡萄球菌、布丘氏菌、水拉恩氏菌、沙雷氏菌和耶尔森氏菌有一定概率出现假阳性,这可能是优化后的条件对这些菌株而言不合适,不能导致引物序列有效退火,从而造成假阳性。特异性验证结果表明,本研究设计的引物对荧光假单胞菌检测具有良好的特异性,可用于对荧光假单胞菌的检测。
2.3 荧光定量PCR的标准曲线及扩增效率评价
建立以纯培养和人工接种为基础的荧光定量PCR的标准曲线。结果显示,以纯培养方法建立的PCR标准曲线为Y=-3.135X+41.328,相关系数r2为0.994,以人工接种方法建立的PCR标准曲线为Y=-3.214X+42.406,相关系数r2为0.992。两者均具有很好的线性关系,拟合结果很好。纯培养和人工接种方法建立的曲线斜率分别为-3.135和-3.214。用标准曲线对扩增效率进行计算,分别为108%和105%,扩增效率良好,与张昭寰等[7]的研究结果一致。
2.4 最低检出限(LOD)值评估
采用4种不同污染水平的鸭胸肉,对其荧光定量PCR系统的最低检出限进行测定,结果如表1所示,T1未检测到荧光假单胞菌,PCR检测结果呈现阴性;T2、T3、T4测得的荧光假单胞菌菌落数分别为2.50 lg(CFU·g-1)、3.42 lg(CFU·g-1)、4.47 lg(CFU·g-1),PCR结果均为阳性。综上,本研究建立的荧光定量PCR法最低检出限为102CFU·g-1。

表1 生鲜鸭肉中荧光假单胞菌的最低检出限(LOD)
2.5 快速检测方法在生鲜鸭肉中的检测效果评价
根据所构建的荧光定量PCR方法对鸭肉冷藏期间的Cq值进行测定,结果如表2所示。对照组鸭肉从第3 d开始检测结果呈阳性,且随着贮藏时间的延长,Cq值先趋于稳定后开始逐渐减小。减菌组生鲜鸭肉在整个贮藏期间检测始终呈阴性。两组鸭肉中荧光定量PCR反应输出Cq值与实际检测到的荧光假单胞菌的数量变化趋势一致,当荧光假单胞菌数量达到检出限,检测结果呈阳性,且随着假单胞菌数量的增加,Cq值逐渐减小。建立的荧光定量PCR检测方法对于荧光假单胞菌污染程度不同的样品具有良好的区分效果,可通过Cq值对生鲜鸭肉中荧光假单胞菌的数量进行定量检测。统计从样品处理到结果分析等整个检测过程,用时控制在5 h以内。综上,利用优化后的方法,检测效率高,可有效用于鸭肉中的荧光假单胞菌的快速检测。

表2 贮藏期间生鲜鸭肉产品中荧光假单胞菌的检测结果表
3 结论
通过对假单胞菌快速检测条件的优化,得到的最佳退火温度为60 ℃和探针浓度最佳为500 nmol·L-1,所构建的荧光定量PCR方法的特异性、最低检出限以及在实际样品中的应用效果的评估结果表明,该方法对鸭肉中的荧光假单胞菌具有极高的特异性和良好的扩增效率,最低检出限低至102CFU·g-1。根据检测出的Cq值,可对假单胞菌污染程度不同的样品进行良好的区分,且整个检测过程时间控制在5 h以内,检测效率高。本文为荧光假单胞菌的快速检测提供了一种可行的方法,有利于更加准确快速地掌握假单胞菌的生长或动态变化,保障冷鲜鸭肉在生产加工环节的质量与安全性。
