术后早期进食方案对行肠息肉内镜下切除术患者康复效果的影响
2022-12-26李苏静张治萍居娴静
李苏静, 张治萍, 居娴静
(江南大学附属医院 全科医学科,江苏 无锡,214000)
肠息肉是一种肠内腔黏膜表面凸起的组织,恶变率较高,临床一般采用内镜下切除术进行治疗[1]。近年来,尽管肠息肉内镜下切除术愈发成熟,但部分患者在术后仍会出现并发症,包括出血、穿孔或灼伤等,对患者的恢复质量及营养状态均存在负面影响[2]。有学者[3]指出,肠息肉内镜下切除术后长期禁食是导致患者血压、血糖及营养水平下降的重要原因,且与患者手术相关并发症的发生和康复效果受限有关。临床提出术后早期进食的观点,即术后6 h开始摄入流食,以降低分解代谢水平、促进术后恢复。基于此,为明确术后早期进食对患者康复效果的影响,本研究选取120例患者的资料进行了回顾性分析。
1 资料与方法
1.1 一般资料
选取2020年12月至2022年5月江南大学附属医院收治的120例行肠息肉内镜下切除术患者的临床资料,开展回顾性分析,并经本院医学伦理委员会审批通过后开展研究。纳入标准:① 经内镜及病理学检查明确诊断为肠息肉;② 年龄18~65岁;③ 于本院接受肠息肉内镜下切除术治疗;④ 临床资料完整。排除标准:① 合并结直肠憩室;② 合并精神障碍;③ 合并其他消化道病变;④ 术前24 h有影响胃肠道排空的药物使用史。按照患者术后进食方案的不同,将术后早期进食者纳入观察组(73例),将术后传统进食者纳入对照组(47例)。比较2组患者的息肉类型等资料,均未见统计学差异(P均>0.05),见表1。
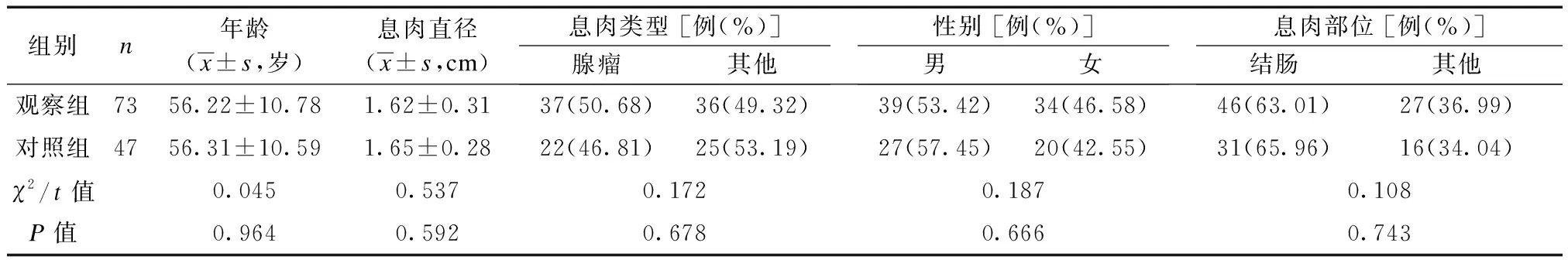
表1 2组一般资料比较
1.2 方法
1.2.1 术前准备及护理 2组患者的术前准备及护理方案相同。① 术前护理:向患者耐心、全面地讲解手术的意义、方法和注意事项,提高其对肠息肉内镜下切除术的认知,促使其配合治疗及术后的观察。术前3 d,告知患者仅进食半流食,并于术前1 d限定为流食,手术当日禁食。嘱患者术前适当增加饮水量,对便秘者给予开塞露等通便药物。向患者及其家属强调避免进食产气食物,包括豆浆和牛奶等。鼓励患者表达自身诉求,并帮助其疏解负面情绪,使其以正确的认知和良好的心态面对治疗。② 术前准备:术前4 h,给予患者聚乙二醇电解质溶液(137 g聚乙二醇溶解于2 000 mL纯净水)口服,嘱其在120 min内饮用完毕,并及时排便,直至大便呈清水样,若仍见粪便残渣,则使用0.9%氯化钠溶液行机械性肠道准备。
1.2.2 术后传统进食 对照组患者术后禁食,通过静脉滴注给予1 000~1 500 mL的葡萄糖溶液,术后次日给予流食,第3天给予半流质食物,术后第4天起逐渐向普食过渡。禁食期间所有营养素经静脉滴注补充,术后3 d内每日补充的总能量为25 kcal/kg。
1.2.3 术后早期进食 观察组患者在术后行早期进食。术后2 h,进食30~50 mL的米汤或藕粉,若未见消化系统不适或其他不良反应,则逐渐增加进食量;术后第2天开始进食半流质食物,并于术后第3天开始逐步过渡至普食。
1.3 观察指标
① 比较2组患者的术后肠鸣音恢复时间(以听诊结果为准)、肛门首次排气时间(以首次肠腔积气排出时间为准)和首次排便时间。② 比较2组患者的手术相关并发症发生情况,包括腹痛和腹胀的消化系统并发症,以及低血糖和出血等其他并发症。③ 比较2组患者在术前1 d、术后1 d、术后3 d和术后5 d的血清白蛋白(ALB)水平。④ 比较2组患者在术后1 d、3 d和5 d的视觉模拟评分法(VAS)[4]评分变化,以评估其舒适度,评分范围0~10分,评分越低则表示患者的舒适度越高。
1.4 统计学方法
2 结果
2.1 胃肠道功能恢复时间
观察组的术后肠鸣音恢复时间、肛门首次排气时间和首次排便时间均早于对照组(P均<0.05),见表2。
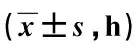
表2 2组术后胃肠道功能恢复时间比较
2.2 手术相关并发症
观察组的手术相关并发症发生率为5.48%(4/73),其中,腹胀2例、低血糖1例、出血1例;对照组的手术相关并发症发生率为19.15%(9/47),其中,腹痛1例、腹胀1例、低血糖5例、恶心/呕吐2例。观察组的手术相关并发症总发生率低于对照组(χ2=5.531,P=0.019)。
2.3 营养状态
2组在术后1 d的血清ALB水平与术前1 d比较,均无统计学差异(P均>0.05);观察组在术前1 d和术后1 d的ALB水平与对照组比较,无统计学差异(P>0.05)。2组在术后3 d和5 d的血清ALB均较术前1 d下降,但观察组在术后3 d和5 d的血清ALB水平均高于同期对照组,差异均有统计学意义(P均<0.05),见表3。

表3 2组围手术期血清ALB水平比较
2.4 舒适度
2组在术后3 d和5 d的VAS评分均较术后1 d降低,且观察组在术后3 d和5 d的VAS评分均低于同期对照组,差异均有统计学意义(P均<0.05),见表4。

表4 2组术后VAS评分比较分)
3 讨论
肠息肉的发生和进展受多种因素的影响,包括年龄、饮食结构、饮食习惯和作息特点等,且好发于左半结肠和直肠部位,其原因与此处黏膜易受滞留食物残渣反复摩擦和刺激有关,且远端结肠上皮细胞对外源性致癌物质的敏感性更强[5]。因此,对于肠息肉患者而言,早期切除以避免恶变风险,是保障其身心健康的重要方式。肠息肉内镜下切除术的创伤较小,但患者仍存在手术相关并发症的发生风险,直接影响着患者的康复效果甚至导致医患矛盾的发生。因此,近年来针对肠息肉的切除术已不仅仅强调早期发现和完整切除,也重视围手术期并发症的控制和术后肠黏膜的恢复,以及患者术后康复质量的提高[6]。有研究[7]表明,行内镜手术患者在围手术期长期禁食是影响其机体营养状态、引发机体应激反应、降低免疫功能和提高手术相关并发症发生率的重要因素之一。而伴随麻醉药物及手术操作的发展和手术学习曲线的日趋平滑,传统术后长期禁食观念已无法适应当今医学技术的进步,故临床提出术后早期进食的观点[8]。但目前关于肠息肉内镜下切除术后进食时机的选择尚无统一标准。
本研究尝试将肠息肉内镜下切除术后进食时间缩短至术后2 h,并鼓励患者早期进食半流食,逐步过渡至普食,结果表明,观察组术后早期进食使患者的肠鸣音恢复时间、肛门首次排气时间和首次排便时间均较对照组提前(P均<0.05)。原因分析为,术中创伤刺激可导致机体儿茶酚胺的分泌量增多,并伴随胃动素和促胃液素分泌的减少,此时患者普遍会出现胃肠道功能紊乱的症状,而术后长期禁食往往会导致胃肠道功能紊乱的持续存在[9]。与之不同的是,术后尽早进食能够借助食物对消化道的机械刺激,激活迷走神经,从而引发胃肠反射性活动,促使胃肠激素释放,对于促进胃肠蠕动有积极意义[10]。得益于上述机制,本研究中观察组患者的术后胃肠道功能恢复速度更快。此外,观察组的手术相关并发症总发生率较对照组更低(P<0.05),重点表现为低血糖发生率的减少。原因与对照组长期禁食所致糖分和能量摄入不足有关,而早期进食不仅能够补充机体所需能量,还可避免低血糖所致机体不良反应的发生,从而促进患者早期恢复。本研究中,2组患者在术后1 d的营养状态(血清ALB水平)均未较术前1 d发生显著变化,但在术后3 d开始,血清ALB水平均有所下降(P均<0.05)。其原因可能与患者在术后恢复期间机体对蛋白质、脂肪和能量的大量消耗有关。因此,术后早期补充能量不仅具有可行性,还具有必要性。但观察组在术后3 d和5 d的血清ALB水平均较同期对照组更高(P均<0.05),说明观察组患者经过早期进食,营养得到了及时补充。同时,观察组在术后2 h的肠内营养支持方式并不会对胃肠道功能的恢复造成负面影响,且可通过促进胃肠早期蠕动,达到提高机体免疫功能的目的。而术后免疫功能的恢复也能减轻机械性肠道准备、术中肠黏膜组织物理损伤所致的肠黏膜防御能力下降的问题,一方面有助于避免肠道菌群失调及代谢紊乱,另一方面对于肠黏膜愈合及营养状态的恢复也有着积极作用。在今后的护理实践中,可考虑在术后鼓励患者增加蛋白质、粗纤维、维生素和微量元素的摄入,从而提升其营养状态的恢复速度及恢复质量,为患者康复效果的进一步提升打造更加坚实的基础。另外,尽可能减少或避免术前的机械性肠道准备,也有助于减少肠黏膜损伤,进而为术后早期进食和早期过渡至普食创造良好条件。得益于观察组患者术后早期进食,使其获得营养补充,故在术后3 d和5 d的VAS评分较对照组均更低(P均<0.05),表明观察组患者的舒适度高于对照组。
综上所述,对于行肠息肉内镜下切除术治疗的患者而言,术后早期进食不仅有助于其胃肠道功能的早期恢复,还有助于降低手术相关并发症发生风险、改善营养状况和提高舒适度,值得临床推荐。
