金荞麦提取物对百草枯中毒大鼠急性肺损伤和MAPK/NF-κB信号通路的影响
2022-12-25陈永生郑永先
陈永生,付 斌,郑永先
(海口市人民医院 急诊医学部,海南 海口 570208)
百草枯(Paraquat,PQ)是一种全世界广泛使用的非选择性季胺类除草剂,具有价格低廉、除草效能高等优点[1],但其能够通过人畜皮肤接触和呼吸道吸入等方式造成急性中毒,导致全身性器官衰竭。PQ中毒致死剂量极低,因而致死率极高[2]。肺是PQ中毒的靶器官,PQ进入体内,选择性地在肺中聚集,募集大量炎性细胞浸润、诱导氧化应激反应与脂质过氧化反应发生,最终引起急性肺损伤、肺水肿和肺纤维化,导致患者死亡[3]。由于PQ中毒急且迅速,目前没有特效药,急性肺损伤以及抗炎抗氧化治疗药物对PQ中毒效果不够理想,且PQ中毒事故频发,寻找PQ中毒特效药物已成为主流。研究发现,氧化应激和炎症反应是PQ中毒急性肺损伤的主要病理机制,而丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)/核因子κB(Nuclear factor kappa-B,NF-κB)信号通路是氧化应激与炎症反应过程中的关键传导途径,下调p38MAPK/NF-κB通路表达,可显著降低PQ中毒大鼠炎症反应程度,保护受损肺组织[4]。金荞麦(Fagopyri dibotryis rhizoma,FDR)是一种临床常用的中药,具有抗炎、抗氧化、抗病毒以及改善肺纤维化、止咳平喘的作用,在慢性阻塞性肺疾病中能够显著下调NF-κB的表达,抑制炎症反应发生,保护肺组织[5]。FDR主要包括黄酮类、多酚类以及有机酸等化学成分,研究发现,FDR提取物可能通过MAPK信号通路治疗糖尿病肺病[6],但其在PQ中毒肺损伤大鼠中的研究尚少。本实验通过建立PQ中毒致大鼠急性肺损伤模型,探究FDR提取物调控MAPK/NF-κB信号通路,保护大鼠肺损伤的机制。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠60只,6周龄,体重200~220 g,购自浙江维通利华实验动物技术有限公司,动物生产许可证号为SCXK(浙)2019-0001,动物质量许可证号为110322211100491267。饲养条件:温度为22~25℃,湿度为45%~50%,自由采食饮水。本研究实验过程均符合伦理要求。
1.2 实验药物与试剂 20% PQ水剂(SNA8F03206)购自江苏先正达南通农作物保护有限公司;FDR提取物(纯度99%,每克相当于生药20 g)购自陕西斯诺特生物公司;地塞米松(A1746,100 mg,纯度≥98%)购自北京康纳瑞生物技术有限公司;SOD(A001-3-2)、MDA(A003-1-2)检测试剂盒及IL-1β(H002)、TNF-α(H052-1)ELISA试剂盒均购自南京建成生物工程研究所;HE染色试剂盒(G1120)、Masson染色试剂盒(G1340)、RIPA高效蛋白裂解液(R0010)、BCA蛋白浓度测定试剂盒(PC0020)均购自北京索莱宝生物技术有限公司;ERK(9102S)、p-ERK(9101S)、JNK(9252S)、p-JNK(4668S)、p38MAPK(9212S)、p-p38MAPK(9215S)、p-NF-κB(3031S)、NF-κB(8242S)一抗、β-actin(4967S)、羊抗兔二抗(HRP,7074S)均购自美国CST公司。CollagenⅠ(ab270993)、CollagenⅢ(ab6310)一抗、羊抗小鼠二抗(ab6789)均购自英国Abcam公司。
1.3 实验仪器 Premier3500全自动血气分析仪(美国GEM公司);OlympusBX53-P光学显微镜(日本奥林巴斯公司);JY04S-3D凝胶成像分析系统(北京君意华鑫科技有限公司);Thermo 微量离心机Heraeus Fresco 21(美国ThermoFisher公司);MiniProTMEpPlus增强型电泳仪电源(上海翌圣生物科技股份有限公司)。
1.4 模型建立与分组 给药将50只SD大鼠固定,一次性腹腔注射20% PQ水剂30 mg/kg建立PQ中毒大鼠急性肺损伤模型[7],且造模过程中未见大鼠死亡。造模成功后随机分为模型组、阳性对照组、FDR-L、FDR-M、FDR-H组,其中阳性对照组腹腔注射地塞米松2.5 mg/kg[8],FDR-L、FDR-M、FDR-H组分别灌胃给予140、280、560 mg/kg[9]金荞麦提取物,每天1次,连续给药3 d。另取10只大鼠不进行PQ水剂注射,仅灌胃等体积生理盐水,作为正常组。
1.5 动脉血PaO2、PaCO2的检测 给药结束24 h后麻醉大鼠,收集大鼠颈动脉血,迅速采用全自动血气分析仪对动脉血PaO2、PaCO2进行检测。
1.6 血清氧化应激指标、炎性 因子水平的检测收集动脉血,1 200×g离心15 min,分离血清,按照试剂盒说明书严格进行操作,检测SOD活性与MDA、IL-1β、TNF-α水平。
1.7 苏木精-伊红染色法(Hematoxylin-eosin staining,HE)观察肺组织病理学变化大鼠 麻醉取血后将其断头处死,分离肺组织,4%多聚甲醛固定,采用常规酒精脱水、二甲苯透明、石蜡包埋切片,进行HE染色。光镜下观察肺组织病理学变化。对肺泡充血、组织出血、中性粒细胞浸润以及肺泡壁增厚这4个方面进行组织损伤评分,其中未见损伤:0分;轻度损伤:1分;中度损伤:2分;重度损伤:3分;极重损伤:4分。以各项指标评分总和为最终组织损伤评分。
1.8 Masson染色观察肺组织纤维化程度 取“1.7项”制备好的肺组织切片,脱蜡水化后,采用苏木精染色,再使用酸性乙醇分化液进行分化,流动水冲洗,Masson蓝化液返蓝,冲洗后采用品红染色,磷钼酸、弱酸溶液浸洗,苯胺蓝染色后再次使用弱酸溶液浸洗,梯度乙醇脱水、二甲苯透明后封片,光学显微镜下观察大鼠肺组织纤维化程度。
1.9 免疫组化法检测肺组织中 CollagenⅠ、CollagenⅢ的表达取“1.7项”中制备好的肺组织切片,过氧化氢酶修复抗原后加入胰酶消化,于37 ℃ 5%山羊血清中封闭1 h,加入1∶100稀释的CollagenⅠ、CollagenⅢ一抗,4℃孵育过夜,再加入1∶100稀释的二抗,37 ℃孵育1 h,采用DAB显色,苏木精复染,脱水封片,显微镜下观察,以棕色为阳性表达,使用Image J软件分析积分光密度(整个视野内所有阳性细胞反应强度的总和)作为目的蛋白的相对表达。
1.10 Western blotting法检测肺组织MAPK/NF-κB信号通路相关蛋白的表达 采用RIPA高效蛋白裂解液提取大鼠肺组织总蛋白,BCA法进行蛋白定量。取20 μg蛋白上样,行电泳、转膜等操作,5%BSA封闭2 h,TBST洗膜,加入1∶1 000稀释的p-ERK、ERK、p-JNK、JNK、p-p38MAPK、p38MAPK、p-NF-κB、NF-κB一抗孵育液,4 ℃孵育过夜,TBST洗膜,加入1∶1 000稀释的二抗,37 ℃孵育2 h,TBST洗膜,采用ECL发光检测,凝胶成像分析系统扫描图像,分析灰度值,以β-actin为内参,计算p-ERK/ERK、p-JNK/JNK、p-p38MAPK/p38MAPK、p-NF-κB/NF-κB比值。
2 结果
2.1 各组大鼠动脉血气指标的变化 与正常组比较,模型组大鼠PaO2下降、PaCO2升高(P<0.05);与模型组比较,阳性对照组与FDR各剂量组大鼠PaO2升高、PaCO2下降(P<0.05),其中FDR各剂量组具有剂量依赖效应(P<0.05);与阳性对照组比较,FDR-H组上述指标差异无统计学意义(P>0.05,见表1)。

表1 各组大鼠动脉血中PaO2、PaCO2的比较
2.2 各组大鼠血清中SOD活性 与MDA、IL-1β、TNF-α水平的变化与正常组比较,模型组大鼠血清中MDA、IL-1β、TNF-α水平升高,SOD活性降低(P<0.05);与模型组比较,阳性对照组与FDR各剂量组大鼠血清中MDA、IL-1β、TNF-α水平降低,SOD活性升高(P<0.05),且FDR各剂量组间差异有统计学意义(P<0.05);与阳性对照组比较,FDR-H组大鼠血清中上述指标差异无统计学意义(P>0.05),见表2。

表2 各组大鼠血清中SOD活性与MDA、IL-1β、TNF-α水平的比较
2.3 各组大鼠肺组织病理学变化 大鼠肺组织病理切片HE染色结果显示,正常组大鼠肺组织结构清晰,肺泡间隔正常,未见中性粒细胞浸润;模型组大鼠肺组织病变严重,肺泡被大量破坏,肺泡壁增厚,中性粒细胞大量浸润,视野中可见大量病灶,肺损伤评分显著升高(P<0.05);阳性对照组以及FDR各剂量组肺组织病理损伤显著减轻(P<0.05),炎性因子浸润现象减少,肺组织评分降低;其中FDR各剂量组间具有剂量效应(P<0.05)。阳性对照组与FDR-H组肺组织病理损伤表现更轻,且两组肺组织损伤评分比较差异无统计学意义(P>0.05),见图1、表3。
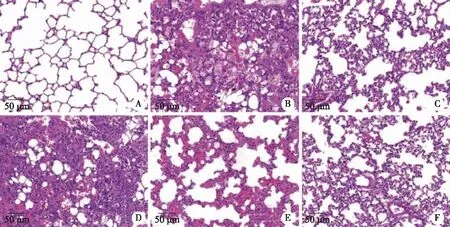
A:正常组;B:模型组;C:阳性对照组;D:FDR-L组;E:FDR-M组;F:FDR-H组;HE:×200。
表3 各组大鼠肺组织评分比较
2.4 各组大鼠肺组织纤维化情况 Masson染色结果显示,正常组大鼠肺组织结构清晰,未见纤维化;模型组大鼠肺组织明显纤维化;与模型组比较,阳性对照组与FDR各剂量组肺组织纤维化程度明显减轻,其中FDR各剂量组具有剂量依赖效应;阳性对照组与FDR-H组肺组织纤维化程度最轻(见图2)。
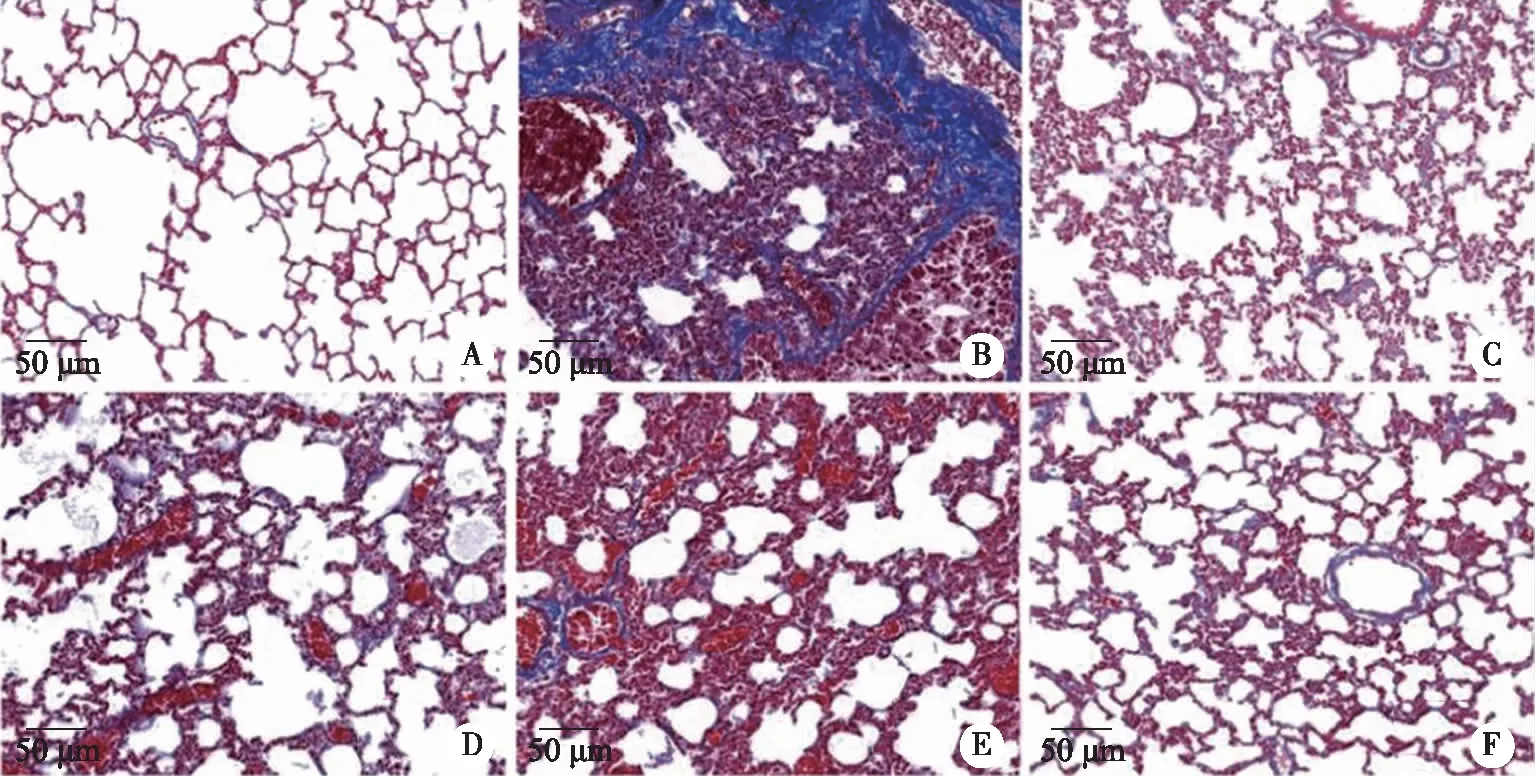
A:正常组;B:模型组;C:阳性对照组;D:FDR-L组;E:FDR-M组;F:FDR-H组;Masson:×200。
2.5 各组大鼠肺组织中CollagenⅠ、CollagenⅢ蛋白表达 与正常组比较,模型组大鼠肺组织中CollagenⅠ、CollagenⅢ表达均升高(P<0.05);与模型组比较,阳性对照组与FDR各剂量组大鼠肺组织中CollagenⅠ、CollagenⅢ表达均降低(P<0.05),其中FDR各剂量组间差异有统计学意义(P<0.05);与阳性对照组比较,FDR-L组、FDR-M组大鼠肺组织中CollagenⅠ、CollagenⅢ表达均升高(P<0.05),FDR-H组上述指标差异无统计学意义(P>0.05),见图3、表4。

A:正常组;B:模型组;C:阳性对照组;D:FDR-L组;E:FDR-M组;F:FDR-H组;×400。
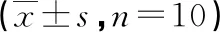
表4 各组小鼠肺组织中CollagenⅠ、CollagenⅢ表达的比较
2.6 各组大鼠肺组织中MAPK/NF-κB信号通路相关蛋白表达的变化 与正常组比较,模型组大鼠肺组织中p-ERK/ERK、p-JNK/JNK、p-p38MAPK/p38MAPK、p-NF-κB/NF-κB比值均升高(P<0.05);与模型组比较,阳性对照组与FDR各剂量组大鼠肺组织中p-ERK/ERK、p-JNK/JNK、p-p38MAPK/p38MAPK、p-NF-κB/NF-κB比值均降低(P<0.05),其中FDR各剂量组间差异有统计学意义(P<0.05),见图4。

A:正常组;B:模型组;C:阳性对照组;D:FDR-L组;E:FDR-M组;F:FDR-H组。a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与阳性对照组比较,P<0.05;d:与FDR-L组比较,P<0.05;e:与FDR-M组比较,P<0.05。
3 讨论
PQ中毒事故在全世界范围内频发,其致死量小,发病迅猛,加之肺可主动吸收外界摄入的PQ导致肺组织受损程度远大于其他器官[10]。目前研究认为,PQ中毒引起急性肺损伤的主要原因是PQ诱导氧自由基的产生,引发氧化应激与脂质过氧化反应过程[11],由于PQ具有强烈刺激性与腐蚀性,能够直接破坏细胞结构并募集炎性细胞,引起全身性炎症反应的发生[12],最终导致肺组织发生不可逆的纤维化反应。本研究结果亦证实了这一结果:PQ中毒致急性肺损伤模型大鼠血清中IL-1β、TNF-α水平升高,炎症反应被激活;MDA水平升高,SOD活性下降,提示过氧化反应发生;肺组织受损严重,肺泡壁增厚,大量炎性细胞浸润,肺组织发生明显纤维化反应。
FDR黄酮具有很强的清除氧自由基的功能,能够抑制糖脂代谢与氧化应激水平[13]。本研究发现,FDR能够有效减轻PQ中毒致急性肺损伤大鼠肺组织病理损伤,下调MDA水平,上调SOD活性,抑制氧化应激反应;另外,还能够降低IL-1β、TNF-α表达,减轻炎症反应,下调CollagenⅠ、CollagenⅢ表达,从而改善肺组织纤维化,保护肺损伤。本实验结果表明,FDR在疾病中具有剂量依赖性,其高剂量组抑制氧化应激以及抗炎作用与地塞米松效果一致,但其具体调控机制尚不明确。
MAPK是一类重要的蛋白激酶家族,主要包括p38MAPK、ERK和JNK3种平行通路,在机体中参与细胞增殖、分化以及凋亡等生理过程[14]。p38MAPK信号通路在肺损伤的炎症反应及细胞凋亡过程中发挥重要作用,NF-κB是其下游因子,参与诱导促炎因子的表达以及细胞凋亡、分化[15-16]。本研究结果显示,PQ中毒大鼠肺组织中p38MAPK、ERK和JNK磷酸化表达上调同时NF-κB磷酸化表达上调,提示MAPK/NF-κB通路被激活,加大炎症反应的发生,加重肺组织损伤。而FDR干预后的肺损伤大鼠肺组织中p-ERK/ERK、p-JNK/JNK、p-p38MAPK/p38MAPK、p-NF-κB/NF-κB均明显降低,提示FDR能够下调p38MAPK、ERK、JNK和NF-κB磷酸化表达,抑制MAPK/NF-κB通路激活,发挥抗炎、抗氧化应激作用。
综上所述,FDR能够有效抑制MAPK/NF-κB信号通路的激活,并通过抑制氧化应激、减轻炎症反应,发挥改善肺纤维化,保护肺损伤的作用,为临床上使用FDR减轻PQ中毒导致的肺损伤提供了新的理论依据。由于PQ中毒发病机制复杂,反应通路多样,具体机制仍需进一步探索。
