脑肿瘤激光间质热疗温度场仿真技术研究综述
2022-12-24毕思欣南群
毕思欣 南群
0 引言
脑肿瘤是引发全世界关注的健康问题之一,其发病率逐年上升且可发生于任何年龄,占成人肿瘤发病率的5%,占儿童肿瘤发病率的70%[1],在所有癌症中,脑肿瘤占1.4%,其致死率占所有癌症死因的2.4%[2]。常见的治疗方法包括手术、放疗和化疗,但目前对于位置较深、毗邻脑功能区、手术路径难以达到、全身状态差的脑肿瘤患者以上方法均具有局限性,因此热消融术已成为科学有效的方法之一。该术式的治疗原理是通过局部高温使得脑肿瘤细胞凝固性坏死,并尽可能少地损伤周围正常脑组织。目前热消融技术包括:射频消融、微波消融、冷冻消融、激光间质热疗(laser interstitial thermal therapy,LITT)、高强度聚焦超声消融[3-4]。LITT技术具有安全、微创、有效等特点,更适合于通过开放入路更难进入的病灶、更深的病灶以及可能无法耐受开放手术的患者,已成为世界上治疗脑肿瘤最常用的消融技术。
LITT技术的核心是精准预测病灶区的温度变化与损伤情况,为此越来越多的学者提出通过有限元仿真技术,对靶区肿瘤/周围组织进行实时模拟和重构,来探究其温度场的变化[5-6]。本文重点针对脑肿瘤激光间质热疗原理、温度场模拟的关键技术与影响因素等内容展开综述,最后提出目前在仿真建模中存在的不足以及未来发展方向。
1 脑肿瘤激光间质热疗原理
LITT主要是利用光在组织中产生光热效应使得脑肿瘤细胞凝固性坏死[7]。临床应用时由磁共振成像技术引导,将一根或多根光纤传送到患者脑部肿瘤中,激光以低功率和长曝光时间沉积,从而导致目标区域的温度升高,达到对组织破坏的目的[8]。消融颅内未充分曝光的肿瘤时,LITT的目标温度设定在45~90℃,既能达到组织发生坏死的临界温度,又避免因温度过高导致组织发生炭化和汽化现象。同时,由于靶区和周围正常脑组织间的过渡区小于1 mm,也避免了水肿现象的发生。因此,LITT技术中的温度场仿真建模和影响因素分析环节尤为重要。激光与生物组织相互作用原理[9],见图1。
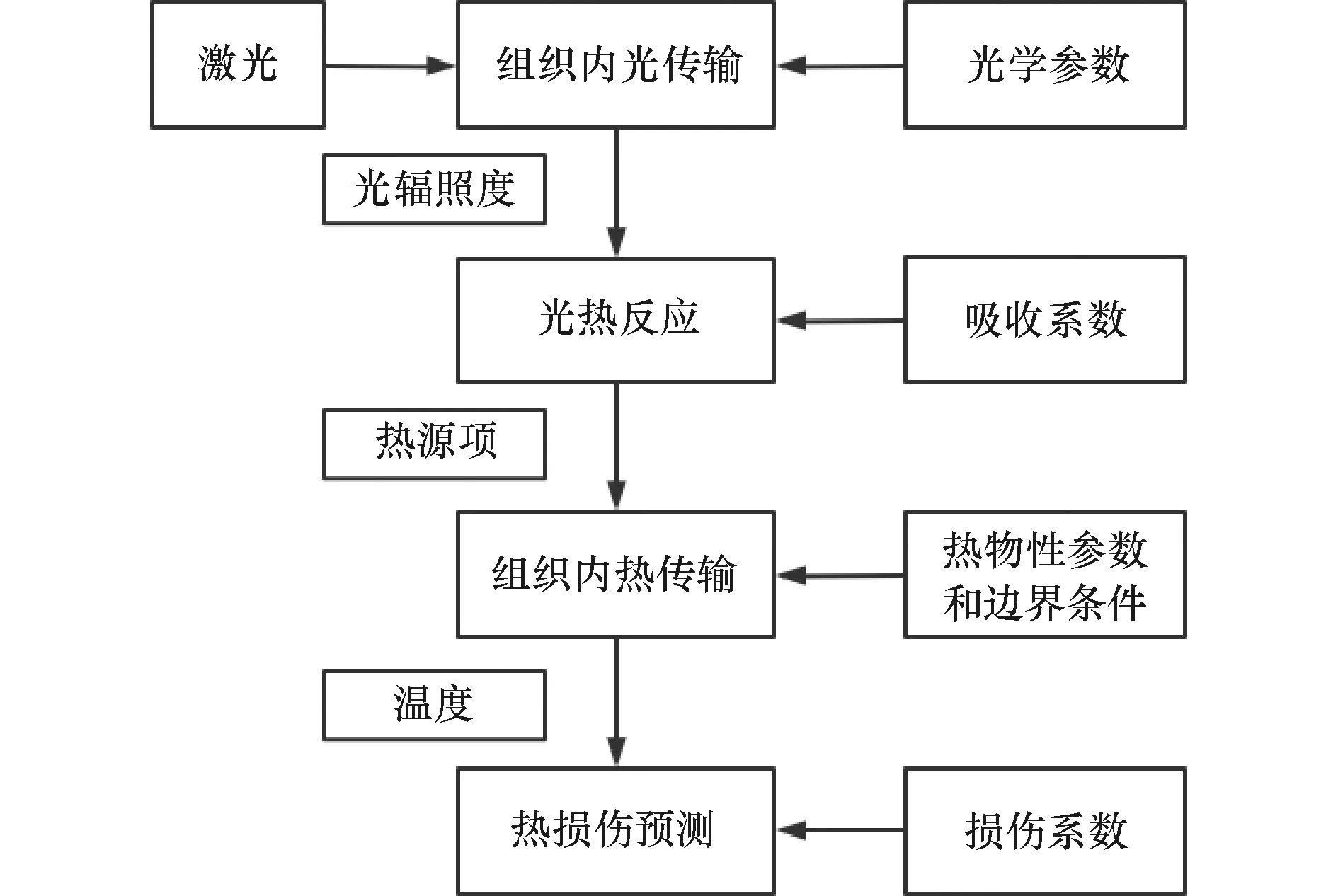
图1 激光与生物组织相互作用原理Figure 1 The principle of interaction between laser and biological tissue
2 LITT温度场仿真的关键技术
光在生物组织中的传输与热量沉积、生物传热方程的求解、生物组织特性参数的敏感性分析和肿瘤的热损伤程度分析等内容是激光间质热疗温度场仿真建模中的关键技术,每一步都影响着肿瘤是否能够达到完全消融。
2.1 生物组织的光传输理论
光在组织中的传播通常被认为是光子在组织中的多次散射叠加效应,主要表现为光子的粒子性,因此多应用光传输理论进行建模仿真,以期能够定量测量出光子在组织中传播的空间分布情况。常用的传输理论有:Kubelka-Munk理论[10]、蒙特卡罗模拟[11]、漫射近似方程[12]。
苏万钧等[10]、张禄鹏等[13]通过积分球技术实验测量,获得了离体动物组织的漫反射率、漫透射率和全衰减系数,采用Kubelka-Munk理论模型计算出组织的光学特性参数,结果表明热变性使组织透射减弱,吸收和散射增强。
蒙特卡罗模拟是光在生物组织传输中的非实验检验标准,该模拟方法多用于研究激光照射组织表面时的光传输情况。针对实际的激光间质热疗法,丁乐明等[14]在内插光纤的双层球体模拟脑组织和肿瘤模型的基础上,建立了光子在组织体内、球体边界处及内插光纤表面的新的传输方式,解决了传统蒙特卡罗模拟激光传输方式为外部光源的局限性,因此更接近光子在肿瘤与组织内部传播的实际情况。
基于有限元法的漫射近似方程具有计算量小、计算时间短的优点,Martelli等[15]、王光珍[12]、张西阳[16]通过实验仿真对比漫射近似方程与蒙特卡罗模拟光在组织中的分布情况,得到了相似的结果,证明该方法能正确描述散射介质中光的传输行为。
综上,3种方法均是光传输理论的表达,Kubelka-Munk理论只考虑在平面波入射情况下的组织,侧重于光学特性参数的计算,对于LITT技术中光纤插入组织内部照射的情况具有局限性。蒙特卡罗模拟和漫射近似方程均多用于光在复杂的、多层的、非均匀的生物组织中的传播,侧重于光子空间分布的计算。蒙特卡罗模拟对算法和计算机的性能要求较高;漫射近似方程理想化光子传播过程,默认入射光全部进入组织内被吸收或者弹性散射。因近红外波段照射下的生物组织的散射系数远大于吸收系数[17],满足漫射近似方程的适用条件,因此更适用于LITT温度场仿真研究。
2.2 生物组织的传热理论
光在组织中沉积产生光热效应,在LITT温度场的建模仿真中通常利用传热方程来研究热量在组织内的传递问题,目前被广泛使用的传热方程有:Pennes生物传热方程[18]、非傅里叶传热模型[19]、多孔介质传热模型[20],具体见表1。
由于Pennes方程假定血液灌注率是均匀的,没有考虑血流的方向和循环网络系统的重要解剖特征,同时只考虑了静脉血流作为与组织平衡的血流。近年来Pennes方程被多次修正,Yang等[21]在原有基础上加入了由蒸发引起的蒸发水所需的能量;Gupta等[22]考虑了血液灌注对温度的依赖性,对传统Pennes方程进行了扩展,还计算出在直角坐标、柱坐标或球坐标下求解Pennes方程的解析解;Sheu等[23]提出了关于组织加热的能量方程,将感兴趣的区域划分为有组织灌注的区域和包含血管的毛细血管区域。
非傅里叶传热模型的关键在于热弛豫时间τq和相位滞后弛豫时间τT的获取。但由于所涉及的组织的特殊性质导致测量比较困难,以往文献报道的生物组织的热弛豫时间也普遍存在较大差异。在激光消融应用中,徐岩[19]对连续性光源、单脉冲光源和周期性光源下各向异性层状材料的二维非傅里叶传热情况进行了研究。许光映等[24]提出双相滞后非傅里叶传热模型应与非傅里叶边界条件相匹配。Maillet[25]指出以前文献中的非傅立叶模型在实验验证上具有实验边界条件未经直接模拟验证、实验源项的量化存在不确定性、热物理参数中存在不确定性等缺点,因此非傅里叶传热模型仍值得更深入的分析研究。

表1 生物组织的传热理论模型Table 1 Theoretical models of heat transfer in biological tissues
多孔介质模型考虑到生物组织是一个复杂的多孔结构,包括血管、细胞和间质3个部分,较Pennes方程和非傅里叶传热模型更复杂。Singh和Repaka[26]指出并验证了多孔介质模型中的微血管灌注是指在毛细血管水平进行的灌注,而大血管灌注是指由大血管引起的热沉效应。Hassanpour和Saboonchi[27]提出了将圆柱形平行小血管模拟为正流和逆流血管网的研究方法,以评估小血管在生物组织加热过程中的热传递机制。Andreozzi等[20]考虑了在毛细血管、末梢动脉、动脉终端分支、三级分支4种不同血管对消融情况的影响,使模拟更真实。总之,多孔介质传热模型适用于预测含有小血管的生物组织温度分布的情况。
总体来说,在LITT仿真中,多建立组织/肿瘤的理想化模型,因此常用Pennes方程来计算热沉积。也有研究采用非傅里叶传热方程,发现在激光照射期间,组织温度的升高较Pennes方程更大,当激光停止照射后,组织温度下降速度较Pennes方程缓慢,且出现温度的波动性下降,对于温度的预测更加准确,但此方程依赖于组织的热弛豫时间。而多孔介质模型在LITT中研究较少。考虑到仿真模型的准确性,后续研究也可在健康组织中采用多孔介质模型,在肿瘤中采用非傅里叶传热模型,但仍需进一步的研究与分析。
2.3 生物组织的热损伤评估
评估生物组织热损伤的方法有:等温线、热等效剂量、Arrhenius模型等。其中最简单的方法是设定50℃、55℃或59℃[26,28]作为阈值等温线,当组织温度超过该阈值时表示组织已损伤。Liang等[29]提出了一种数学模型,即在MRI平面下确定产生消融时的双实时热损伤估计参数,通过Matlab运用两种定积分方法,计算实时的热损伤体积值。Amini等[30]用数值方法模拟了二元分布激光模型和一元分布激光模型对任意形状肿瘤的消融,结果表明当采用肿瘤边界上的双分布时,光子的分布模式与肿瘤是一致的,消融区温度的升高定性地遵循肿瘤边界。同时由于组织的损伤不仅取决于消融区温度,还取决于组织的类型和加热时间,因而Arrhenius模型作为判定靶区组织消融后的损伤情况的标准,已被广泛应用于LITT仿真建模中。因此不断优化损伤评估方法,以适应各种形状的肿瘤仍是目前研究的热点。
3 LITT温度场仿真中的影响因素
当激光波长、消融功率和消融时间固定时,LITT温度场仿真中的影响因素主要有生物组织的特性参数、激光光纤的排布以及LITT联合纳米粒子技术等。
3.1 生物组织特性参数
LITT过程中涉及的生物组织特性参数有光学参数(如吸收系数、散射吸收、各向异性因子)和热物性参数(如密度、比热容、导热率、血液灌注率等)。健康组织与肿瘤组织的组织特性参数有很大不同[31],且同一组织不同位置处的特性参数也有较大的差异[32]。生物组织内的光热效应是一个复杂的过程,当温度大于50℃时,组织内酶活性会减弱,细胞的分子结构将发生变化;同时随着温度的升高和组织内水含量的减少,组织的光学参数和热物性参数会发生可逆和不可逆的动态变化,进而影响消融的效果[33]。
早期的研究中这些参数常选用固定值,通过分析不同温度的静态光热参数下的光分布和温度分布能定性说明组织光分布和温度分布的变化趋势,但会高估激光入射点的温度,与实际消融效果存在一定的偏差。而动态模型中组织的光学特性受温度和热损伤的影响较大,可由热损伤积分的对数函数近似表达光学参数的动态变化[34]。因脑组织内含水量丰富,虽然缺乏准确的温度依赖和损伤依赖的热物性参数的数据,但组织的热性能可以根据在20~100℃[34]范围内的含水量和水的热性能的动态变化来近似。使用动态光热参数进行模拟时,随着加热时间的增加,光分布范围和温度分布范围在逐渐变大,组织的吸收系数变小,散射系数变大,热学参数变大,入射点的光通量密度和温度随之增加,但温度随加热时间的增长逐渐趋于平缓[35],更符合组织加热过程中实际的变化趋势。同时脑白质是人体灌注率最高的物质之一[36],血液灌注率的动态变化用温度或损伤程度的动态变化来近似[37-38],忽略血液灌注的影响将导致对损伤区域大小的高估。
3.2 光纤各因素的影响
LITT消融过程中激光的波长、光纤的类型、插入的深度、多光纤的排布等因素对消融区的几何形态、大小体积等均有重要的影响。
Schwarzmaier等[36]评估了在紫外光谱、可见光谱和近红外光谱下的正常脑组织和脑肿瘤的光学特性,Yaroslavsky等[17]采用可见光和近红外波段下的激光,分别对天然的脑组织和凝固的脑组织进行了光学特性的实验。研究结果表明无论是天然脑组织、凝固脑组织还是脑肿瘤,都在1 000~1 150 nm波长范围(近红外)内产生了最深的热凝固区域和最大的激光穿透深度,因此最适宜LITT消融的波长为近红外波段的波长。
在LITT仿真中多是建立裸光纤模型,致使仿真后热损伤体积较真实情况更大。Fasano等[39]建立了光纤改进模型,它由一根玻璃光纤和一个被冷却剂包围的扩散尖端组成,考虑了内部冷却剂流动的影响。实验结果和仿真结果的比较表明,该模型能够较好地预测实验中所获得的温度。Salavati等[40]对激光光纤扩散端的位置、长度和直径对组织温度和损伤情况的影响进行了模拟,结果表明垂直放置于肿瘤中心的光纤较水平放置的光纤,获得的组织温度更高,热损伤体积更大,同时长度和直径越小的光纤能量越强。由此看来,激光光纤模型对于LITT消融效果的影响是不可忽略的。
LITT多适合消融直径小于3 cm的肿瘤,对于较大直径的肿瘤,Hafez等[41]提出可以采用分次移动消融法。根据肿瘤形状制定消融次数、进针轨迹与光纤能量,可以最大化地实现最佳消融。因LITT单光纤消融只能产生椭圆形坏死,针对不规则的大体积肿瘤有一定的局限性。Ivarsson等[42]提出了多光纤LITT的数学模型并进行实验,结果表明4根光纤较单光纤产生的消融体积大6倍,最高组织温度出现在主要受漫射激光影响的区域,可以使用仿真建模的方法来获得多个激光光纤相对于温度分布的最佳定位。Klingenberg等[43]研究了多光纤在肿瘤适形照射中的应用,包括使用光源和磁共振测温技术,将光纤按三角形、矩形、四边形和梯形等方式进行排布,初步证明了多光纤消融复杂形状病变的可能性,同时还保留了相邻正常组织的结构。O’Connor等[44]通过对临床案例进行收集和分析,证实了病灶大小与光纤数量之间存在相关性,每根光纤治疗的平均肿瘤体积为4.5 mL。综上所述,从仿真和实验方面都验证了多光纤消融较大肿瘤的可行性。
3.3 LITT联合纳米粒子技术
随着纳米技术的发展,纳米粒子已经越来越多应用于肿瘤中,它使得电磁波产生的热量被定位和加强,将组织损伤严格限制在感兴趣的区域[45]。在近红外激光诱导热疗的情况下,一些研究[46-47]使用了光学吸收率高的贵金属纳米颗粒、纳米聚合物和氧化物纳米颗粒作为热剂。Leung等[48]将低于100 nm的金纳米粒子用于激光诱导肿瘤热疗研究,使用40 nm金纳米壳的光热治疗导致细胞存活率降低约70%。Lamien等[49]将氧化铁纳米粒子注入模拟肿瘤的体膜中,估算激光间质热疗实验中的温度场变化,实验表明纳米粒子将热量集中在肿瘤区域,改善了局部入射激光的辐照吸收性,减轻了正常组织暴露于高温下产生的热损伤。李景华等[50]进行了磁热疗肿瘤域温度场的仿真研究,建立了磁性纳米颗粒弥散运动和热传递温度场耦合的数学模型;Zhang等[51]进行了多光纤和可降解纳米颗粒联合应用的LITT数值模拟。这些研究都为加入磁纳米粒子肿瘤模型的建立提供了参考,表明了LITT联合纳米粒子技术仿真研究的可行性和研究前景。
4 小结
虽然众多学者在LITT消融脑肿瘤温度场的仿真研究中进行了不断的优化分析,但仍存在以下问题:① 目前研究的脑肿瘤模型大多都是球体、椭球体等理想化模型,然而忽略了人体的个性化模型;② 脑肿瘤有胶质细胞瘤、神经细胞瘤、星形细胞瘤等多种类型,不同肿瘤类型对LITT的反应不同,具有相似组织学特性的同类型不同分级的肿瘤对热消融的反应也不同,因此在肿瘤、组织的特性参数选取上有一定的差异;③ 在肿瘤特异性病理的治疗中,为LITT开发标准化方案存在困难;④ 为了简化模型,仿真中仍多用裸光纤和传统Pennes生物传热方程进行建模。
因此,随着影像学技术和计算机技术的发展,发展基于磁共振图像的脑肿瘤识别和分析方法,可以使建模更加精细化;同时对目标组织特性参数进行敏感性分析,对消融效果影响显著的参数采用温度依赖函数,可以减小仿真误差;对于联合纳米粒子技术建立耦合数学模型,可以更准确地把握激光能量与温度场的分布情况。综上所述,采用多种方法的结合可以使仿真建模更接近临床真实,达到适形消融的目的,并通过人工神经网络、三维重建技术建立LITT手术规划系统,为医生选择最佳的LITT治疗参数,提供量化参考将是今后脑肿瘤激光间质热疗研究的热点。
