低剂量地西他滨联合CAG 方案治疗老年MDS 的疗效
2022-12-23蒲娟罗文丰刘洋翟红谢坤莹赵攀
蒲娟 罗文丰 刘洋 翟红 谢坤莹 赵攀
MDS 是由于造血干细胞等损伤诱发的一组异质性克隆性疾病,临床特征为无效造血或难治性血细胞减少,具有较高的急性髓细胞性白血病(AML)转化风险[1]。研究表明,DNA 的异常甲基化是MDS 发生及发展的主要机制之一,故近年来临床考虑采用去甲基化药物进行治疗,以抑制或逆转MDS 病情进展[2]。地西他滨是目前治疗MDS 的特异性DNA 甲基化转移酶抑制剂,可通过去甲基化诱导肿瘤细胞的分化和凋亡。已有诸多临床试验证实,地西他滨单用或与化疗方案联用均对MDS 具有良好疗效,但其不良反应较多,临床应用仍有一定的局限性[3,4]。较高危尤其是原始细胞比例增高的MDS 患者往往预后较差,选择非造血干细胞移植(HSCT)者多需接受化疗,目前推荐采用低强度、无较差耐药的联合化疗方案,如CAG 方案、HAG方案(阿糖胞苷+高三尖杉酯碱+G-CSF)等[5]。国内研究指出,低或超低剂量的地西他滨即可发挥去甲基化作用,且不良反应较低,更适合老年患者[6]。本研究对老年MDS 患者使用低剂量地西他滨联合CAG 方案治疗,随访观察其近期预后、安全性等,为临床治疗提供参考。现报告如下。
1 资料与方法
1.1 一般资料 选取2018 年1 月~2021 年1 月期间本院接受CAG 治疗的82 例老年MDS 患者,根据是否联合低剂量地西他滨治疗分为联合组(44 例,CAG 联合低剂量地西他滨)与CAG 组(38 例,单用CAG)。联合组患者中,男28 例,女16 例;年龄60~80 岁,平均年龄(66.37±5.02)岁;血红蛋白(Hb):40~126 g/L,平均Hb(83.69±16.44)g/L,<100 g/L 者36 例;血小板计数(PLT) :(6~239)×109/L,平均PLT(82.01±11.44)×109/L,<100×109/L者25例。CAG组患者中,男26例,女12例;年龄60~80 岁,平均年龄(65.74±4.96)岁;Hb:43~128 g/L,平 均Hb(84.26±16.58)g/L,<100 g/L 者32 例;PLT:(6~239)×109/L,平 均PLT(84.12±12.03)×109/L,<100×109/L 者23 例。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。患者本人和(或)家属均知晓且签署知情同意书,研究获得医院伦理委员会审核并批准通过。
1.2 纳入标准 ①符合MDS 的临床诊断标准[1],经骨髓细胞形态学分析、细胞化学染色、分子生物学检测及细胞遗传学检测等确诊;②根据世界卫生组织(WHO)2016 年MDS 修订分型标准且经MDS 的国际预后积分系统(IPSS)判定为中、高危患者,具备化疗条件;③年龄≥60 岁;④治疗前东部肿瘤学协作组体力状态评估(ECOG-PS)评分为0~2 分;⑤心、肝、肾功能基本正常,能够耐受化疗。
1.3 排除标准 ①合并严重心、脑、肝、肺、肾等重要器官功能不全或其他因素临床评估难以耐受化疗者;②合并其他恶性肿瘤者;③合并活动性肝炎、人类免疫缺陷病毒(HIV)抗体阳性、活动性全身严重感染者;④合并代谢性疾病者;⑤治疗前已经转化为AML 者;⑥治疗依从性较差或不配合临床评估者。
1.4 方法
1.4.1 CAG 组 给予患者CAG 方案治疗,即阿糖胞苷(Ara-C) 皮下注射,10 mg/m2,每12 小时注射1 次,d1~14;阿柔比星(Acla)静脉滴注,6 mg/m2,1 次/d,d1~4;G-CSF 皮下注射,200 μg/m2,1 次/d,d1~14,每4 周为1 个化疗周期,连续治疗4 个周期后获得CR 者,根据个体情况给予巩固治疗,获得部分缓解(PR)或单纯血液学改善(HI)者继续治疗2 个周期后再行疗效评价。治疗期间,如中性粒细胞计数(ANC)>5×109/L 或白细胞计数(WBC)>20×109/L,则酌情降低G-CSF 用药量;Hb≤60 g/L 出现明显贫血症状时,给予同型浓缩红细胞输注;如PLT≤10×109/L 或具有明显出血倾向,则给予同型单采血小板输注。治疗期间酌情予以水化、碳酸氢钠碱化、止吐、护胃及肝肾功能保护等处理。
1.4.2 联合组 给予患者低剂量地西他滨联合CAG方案治疗,CAG 方案同CAG 组,地西他滨于G-CSF 注射12 h 后静脉用药,7 mg/(m2·d),持续静脉泵注>1 h,d1~5,用药周期及其余支持治疗同CAG 组。
1.5 观察指标及判定标准
1.5.1 比较两组治疗前后血清sCD44、GDF11、sTfR/E水平 治疗前及疗程结束后(治疗后),晨取空腹静脉血5.0 ml,室温下以3000 r/min 转速离心10 min,分离上层清液。采用酶联免疫吸附法(ELISA)检测血清sCD44、GDF11、可溶性转铁蛋白(sTfR),并计算sTfR/E以评价造血功能,sTfR/E=sTfR/[骨髓造血组织中有核细胞含量(%)×骨髓红幼稚细胞数(%)]。
1.5.2 比较两组近期预后 疗效判定标准参照《骨髓增生异常综合征中国诊断与治疗指南(2019 年版)》[1]和《血液病诊断及疗效标准》[7]进行评价:CR:临床症状消失,血象均恢复正常,骨髓增生恢复正常,幼稚细胞<5%,疗效维持≥4 周;PR:临床症状明显减轻,血象部分恢复正常且绝对值持续>2 个月;疾病稳定(SD):未达到PR 最低标准,但>8 周无疾病进展证据;疾病进展(PD):临床症状及血象加重。总缓解率=(CR+PR)/总例数×100%。
1.5.3 比较两组不良反应发生情况 观察并统计不良反应发生情况,并根据WHO 化疗药物不良反应分级标准[8]进行不良反应严重程度评价。
1.5.4 比较两组随访结果 所有患者均接受电话和(或)门诊随访等形式进行随访,统计OS,即从确诊日至末次随访或任何原因导致死亡之日,随访截止日期为2021 年12 月1 日。
1.6 统计学方法 采用SPSS22.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,两组间比较采用独立样本t检验,组内治疗前后比较采用配对样本t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组治疗前后血清sCD44、GDF11、sTfR/E 水平比较 治疗前,两组的sCD44、GDF11、sTfR/E 水平比较,差异均无统计学意义(P>0.05);治疗后,两组的sCD44、GDF11 均低于治疗前,sTfR/E 高于治疗前,且联合组的sCD44、GDF11 均低于CAG 组,sTfR/E 高于CAG 组,差异具有统计学意义 (P<0.05)。见表1。
表1 两组治疗前后血清sCD44、GDF11、sTfR/E 水平比较()
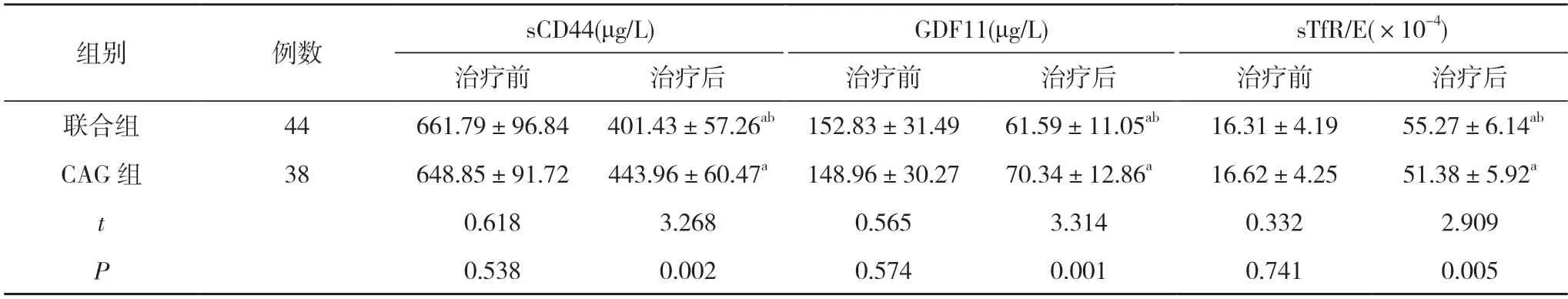
表1 两组治疗前后血清sCD44、GDF11、sTfR/E 水平比较()
注:与本组治疗前比较,aP<0.05;与CAG 组治疗后比较,bP<0.05
2.2 两组近期预后比较 联合组的CR 率和总缓解率均高于CAG 组,差异具有统计学意义 (P<0.05)。见表2。
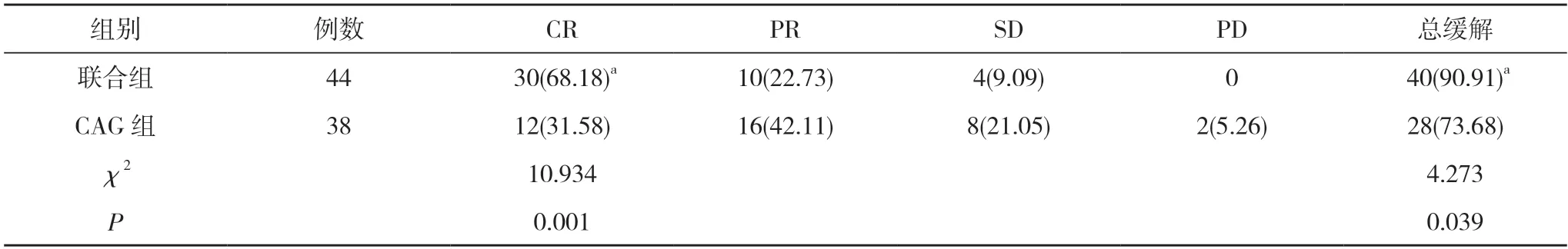
表2 两组近期预后比较[n(%)]
2.3 两组不良反应发生情况比较 治疗期间,两组非血液毒性及Ⅲ~Ⅳ级血液毒性反应发生率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组不良反应发生情况比较[n(%)]
2.4 两组随访结果比较 两组患者随访至2021 年12 月1 日,中位随访时间22.4(6~36)个月。联合组的中位OS 为18.3(3~36)个 月,CAG 组的中位OS 为12.6(2~29)个月,联合组的中位OS 长于CAG 组。
3 讨论
中高危MDS 患者往往预后不良,尤其是老年患者往往难以从小剂量化疗中明显获益,整体缓解率不高,生存情况并不理想;强烈化疗虽缓解情况尚可,但因老年患者常伴随多种基础性疾病,且主要脏器、系统功能存在年龄相关性减退,化疗耐受性较差,导致相关病死率极高[9]。CAG 方案是目前应用较多的MDS 及AML 化疗方案之一,其中,阿糖胞苷可抑制DNA 多聚酶的活性,有效抑制肿瘤;阿柔比星为细胞周期非特异性抗肿瘤药,可有效抑制DNA、RNA 及蛋白质等的生物合成,且对DNA 多聚酶Ⅰ也具有较强的抑制作用,且心脏毒性及蓄积毒性作用较小;G-CSF 则可选择性作用于粒系造血祖细胞,有效促进其繁殖和分化,还可提高粒系终末分化细胞的活性,可促进患者身体机能的恢复,并可减少ANC 减少等并发症,有助于减少感染发生风险[10,11]。目前,已有研究证实CAG 方案半量或低剂量治疗MDS 的不良反应相对较轻微,但整体预后仍有待提升[12]。
DNA 高度甲基化在MDS 的发生及发展中具有重要作用,故抗甲基化治疗也是MDS 治疗的常用方法之一[13]。地西他滨是5-氮杂-2'-脱氧胞嘧啶核苷,是一种特异性DNA 甲基转移酶抑制剂,可通过抑制DNA甲基化转移酶的活性,诱导DNA 去甲基化,并可促使细胞分化或凋亡,从而发挥抗肿瘤作用[14]。地西他滨使用剂量较大(15~20 mg/m2)时虽可有效抑制DNA 的合成诱导肿瘤细胞毒性,但也具有明显的细胞毒性作用,容易发生严重的骨髓抑制,尤其是Ⅲ~Ⅳ级血液毒性发生风险较高,增加感染、出血风险[15]。较低剂量的地西他滨也可通过与DNA 甲基化转移酶共价结合而诱导去甲基化,从而发挥抗肿瘤作用,且安全性较好,但单独应用时疗效并不理想,在OS 方面与最佳支持疗法相比并无明显优势[16]。近年来,越来越多研究开始探寻地西他滨的最佳使用剂量及联合治疗模式,以提高其治疗效果。有学者指出,对初发中高危MDS 或其诱导的AML 采用常规剂量的地西他滨联合CAG 方案具有良好疗效,但其所致胃肠道反应、感染、出血等发生率较单独CAG 方案明显增多[17]。近年来有研究显示,降低地西他滨用药剂量并与CAG 方案联用,能够在兼顾安全性的同时提高疗效[18]。另有研究显示,低剂量地西他滨可调节外周血T 细胞受体,并可诱导T 调节细胞的扩增,从而改善免疫功能,有利于降低机会感染风险[19]。此外,由于地西他滨的价格相对昂贵,减低用药剂量也有利于减轻患者的经济负担。
基于上述认识,本研究中联合组采用地西他滨7 mg/(m2·d)静脉滴注联合CAG 方案治疗,结果显示,联合组的CR 率达68.18%,高于冷青等[20]报道;总缓解率也高达90.91%,较单纯CAG 组的73.68%明显提高,且中位OS 较CAG 组明显延长(18.3 个月vs 12.6 个月)。且与李章坤等[21]方案相比,本研究中地西他滨用药剂量低,总用药时长短,患者的CR 率及总缓解率均较高,提示低剂量地西他滨联合CAG 方案治疗老年MDS 仍可提高临床获益,可能取得更高的临床缓解率和更长的生存周期。在不良反应方面,两组的非血液毒性及血液毒性(包括Ⅲ~Ⅳ度PLT 减少、Hb 减少、ANC 缺乏)发生率比较,差异无统计学意义(P>0.05)。说明低剂量地西他滨联合CAG 方案不会导致不良反应明显增加,整体安全性良好。
贫血是MDS 的常见临床表现之一,主要是由于无效红细胞生成、晚期红细胞过早凋亡等[22]。sCD44主要由CD44 胞浆外段在蛋白水解酶等作用下脱落产生,而快速增殖的恶性肿瘤细胞可释放出大量蛋白水解酶,故sCD44 也被认为与肿瘤的发生及进展密切相关[23]。GDF11 属于转化生长因子-β(TGF-β)超家族成员之一,其过表达可能影响晚期红细胞的成熟与分化,还有研究显示TGF-β 抑制剂可能抑制GDF11信号通路,从而促进贫血患者晚期红细胞的成熟、分化[24]。MDS 患者由于幼稚红细胞的发育及代谢异常,存在明显的功能缺陷,对于铁的摄取及利用明显减弱,Hb 合成障碍,从而导致无效造血[25]。因此,sTfR/E 可在一定程度上反映患者的造血功能状态,sTfR/E 减低且与造血细胞增生程度不相符时,多提示MDS。本研究结果发现,治疗后,两组的sCD44、GDF11 均低于治疗前,sTfR/E 高于治疗前,且联合组的sCD44、GDF11均低于CAG 组,sTfR/E 高于CAG 组,差异具有统计学意义 (P<0.05)。进一步证实CAG 单用或低剂量地西他滨联合CAG 方案均可下调sCD44 和GDF11 水平,改善患者的造血功能,而低剂量地西他滨联合CAG 方案的作用优于单纯CAG 方案治疗,这与近期疗效基本一致。
综上所述,低剂量地西他滨联合CAG 治疗老年MDS 是安全有效的,相比于单纯CAG 治疗有望提高缓解率并延长生存期,下调sCD44 和GDF11 水平,改善患者的造血功能,且不会导致不良反应明显增加,可作为中高危老年MDS 治疗的新选择。但本研究的样本量较小,仍需进一步大样本、多中心、随机对照研究验证。
