GPR97、HuR和Sema3A蛋白在细粒棘球蚴感染小鼠肝脏中的表达
2022-12-23王勃陈瑞花王昆李志强魏琴姜涛张春
王勃, 陈瑞花, 王昆, 李志强, 魏琴, 姜涛, 张春**
(1.新疆医科大学 动物实验中心, 新疆 乌鲁木齐 830011; 2.新疆医科大学 新疆医学动物模型研究重点实验室, 新疆 乌鲁木齐 830011)
细粒棘球蚴病是一种因感染细粒棘球蚴绦虫虫卵所致的慢性人兽共患寄生性传染病,可对人的肝脏、肺以及其他器官造成严重伤害[1]。细粒棘球蚴虫随血液循环迁移至中间宿主的肝、肺和其他脏器中,出现原发囊性病变,其中在肝脏中最为常见[2]。细粒棘球蚴虫早期定植引起机体急性炎症反应而被清除,残留的幼虫待包囊形成,产生代谢产物[3],影响免疫细胞和细胞趋化因子功能,可逃避宿主的免疫反应[4]。G蛋白偶联受体(G protein-coupled receptors,GPCRs)是最大的受体超家族,位于细胞膜表面,参与介导生物过程与多种疾病[5]。G蛋白偶联受体97(G protien-coupled recepter 97,GPR97)具有经典的黏附GPCR结构,具有7个跨膜螺旋、1个N端片段和1个C端片段,通过与下游G蛋白相互作用,介导细胞内信号转导[6-7]。在免疫细胞中,GPR97在白细胞中表达,如中性粒细胞、嗜酸性粒细胞和肥大细胞[8],GPR97有可能与炎症相关,但GPR97对免疫细胞的调节作用及机制仍然不清楚。GPR97基因敲除的肾脏保护作用是通过脑信号蛋白3A(semaphorin 3A,Sema3A)信号通路进行的,同时在体外基因沉默GPR97可减轻低氧细胞模型引起的肾小管上皮的凋亡和促炎因子的产生,加入Sema3A重组蛋白可逆转这一作用,而GPR97对Sema3A的表达调控是通过人抗原R(human antigen R,HuR)蛋白进行的。HuR蛋白在肝脏多种疾病中均扮演着重要的角色[9],如在肝炎中,HuR可以促进炎症介质表达[10]、还可调控巨噬细胞的活性[11]。目前,关于GPR97、Sema3A和HuR蛋白在细粒棘球蚴感染小鼠肝脏中的表达情况还未见报道。因此,本研究通过建立细粒棘球蚴感染小鼠模型,采用免疫组织化学法观察GPR97、Sema3A和HuR蛋白在细粒棘球蚴感染小鼠肝脏中的表达情况,为进一步阐述这3种蛋白与细粒棘球蚴病的相互作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1实验动物及细粒棘球蚴原头蚴 选择6~8周龄雌性C57BL/6小鼠12只,饲养在新疆医科大学动物实验中心屏障系统环境[SYXK(新)2018-0002]。购买当地屠宰场感染细粒棘球蚴病的羊肝脏,抽取病灶组织囊液,收集原头蚴。
1.1.2主要试剂与仪器 兔抗GPR97、Sema3A、HuR多克隆抗体(Affinity公司,美国),辣根过氧化物酶标记山羊抗兔IgG抗体、DAB显色试剂盒、苏木精和伊红染液、天狼星红染液、磷酸盐缓冲液PBS(北京索莱宝科技有限公司)。试验仪器主要有石蜡切片机(Leika公司,德国)和生物显微镜(Motic实业有限公司,厦门)等。
1.2 研究方法
1.2.1建立细粒棘球蚴感染肝脏模型 检测原头蚴活力并计数,通过小鼠肝门静脉注射细粒棘球蚴500个,建立细粒棘球蚴感染小鼠肝脏模型。
1.2.2采集、处理肝脏标本 感染细粒棘球蚴2周和8周的小鼠经二氧化碳安乐处死,采集肝脏组织,经4%多聚甲醛固定后,经梯度乙醇脱水、石蜡包埋,制备肝脏石蜡切片。
1.2.3苏木精-伊红染色法 (hematoxylin-eosin staining,HE)和天狼星红染色 肝脏石蜡切片置于60 ℃恒温箱中烘烤30 min后,经脱蜡、二甲苯、梯度乙醇复水,用于进行苏木素-伊红染色和苦味酸-天狼星红染色,再梯度乙醇脱水、二甲苯透明,中性树胶封片,显微镜下观察肝组织病理变化。
1.2.4免疫组织化学染色 经梯度乙醇复水后的肝脏石蜡切片,依次进行柠檬酸盐溶液微波中火加热15 min,3%过氧化氢处理15 min,加封闭液室温孵育1 h,PBS洗3次;加GPR97、Sema3A、HuR一抗4 ℃孵育过夜,PBS洗3次,加二抗室温孵育2 h,PBS洗3次,加DAB显色,显微镜下观察,苏木素复染,梯度乙醇脱水后,中性树胶封片。显微镜下观察GPR97、Sema3A、HuR蛋白表达情况,每个样本随机选取5张切片,每张片子随机选取不重叠的5个包囊放大视野(200×),在Motic生物显微镜下拍照、记录,进行蛋白表达染色评分。染色评分由染色强度与程度的乘积确定,染色强度按照不着色为阴性(0分)、着浅黄色为弱阳性(1分)、着中黄色或着棕色且无背景着色或者着深棕色但有浅棕色背景为中等阳性(2分)、细胞着深棕色或棕褐色且无背景着色为强阳性(3分),染色程度阳性细胞的频率<5%为0分(-)、5%~25%为1分(+)、26%~50为2分(++)、51%~75%为3分(+++)、>75%为4分,包囊相关阳性细胞的频率为占包囊的整体细胞。综合评分分为0~1分为阴性(-)、2~4分为弱阳性(+)、5~8分为中度阳性(++)、9~12分为强阳性(+++)。
1.3 统计学分析
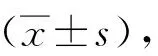
2 结果
2.1 肝组织细胞学
HE染色和苦味酸-天狼星红结果显示,细粒棘球蚴感染第2周时小鼠的肝组织结构完整、肝索排列整齐,偶见纤维细胞大量增生、肉芽肿形成,炎性细胞增多,将炎症组织放大观察可见纤维化包囊逐渐成型;感染第8周时小鼠肝组织结构不完整,肝索排列紊乱,部分肝细胞被破坏、有炎性病灶,包囊出现空泡化,外囊外膜层纤维化组织增生且致密。见图1、图2。
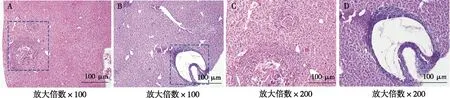
注:A、C为第2周肝组织,B、D为第8周肝组织。图1 细粒棘球蚴感染小鼠肝组织感染第2周和第8周时小鼠肝组织HE染色结果Fig.1 HE staining of liver tissues in mice with echinococcus granulosus infection in 2nd and 8th week
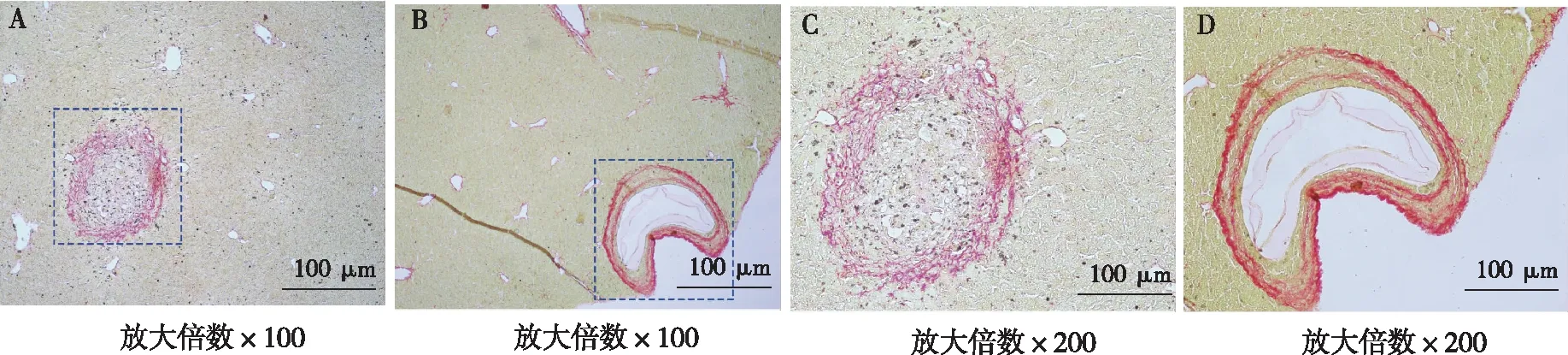
注:A、C为第2周肝组织,B、D为第8周肝组织。图2 细粒棘球蚴感染小鼠肝组织第2周和第8周时苦味酸-天狼星红染色结果Fig.2 Picric acid-Sirius red staining of liver tissues in mice with echinococcus granulosus infection in 2nd and 8th week
2.2 肝组织GPR97蛋白表达
GPR97蛋白免疫组化染色结果显示,第2周时,小鼠肝组织初步形成的包囊内部分呈黄褐色阳性着色,肝细胞胞质有不同程度的黄色着色;第8周时,包囊空泡化后生发层细胞呈黄褐色阳性着色,外囊层无阳性表达;与感染第2周时比较,感染第8周时细粒棘球蚴感染小鼠肝内囊生发层细胞、外囊外膜层细胞、周围肝组织细胞的GPR97蛋白表达免疫评分均升高(P<0.05)。见图3。
2.3 肝组织HuR蛋白表达
HuR蛋白免疫组化染色结果显示,第2周时,小鼠肝组织形成的包囊内基本无阳性表达,偶见褐色阳性着色,肝胞质呈黄色阳性;第8周时,包囊空泡化后生发层细胞呈黄色或黄褐色阳性着色,外膜层无阳性表达,周边肝细胞胞质为黄色阳性;与感染第2周时比较,感染第8周时细粒棘球蚴感染小鼠肝内囊生发层细胞、外囊外膜层细胞、周围肝组织细胞的HuR蛋白表达免疫评分均升高(P<0.05)。见图4。
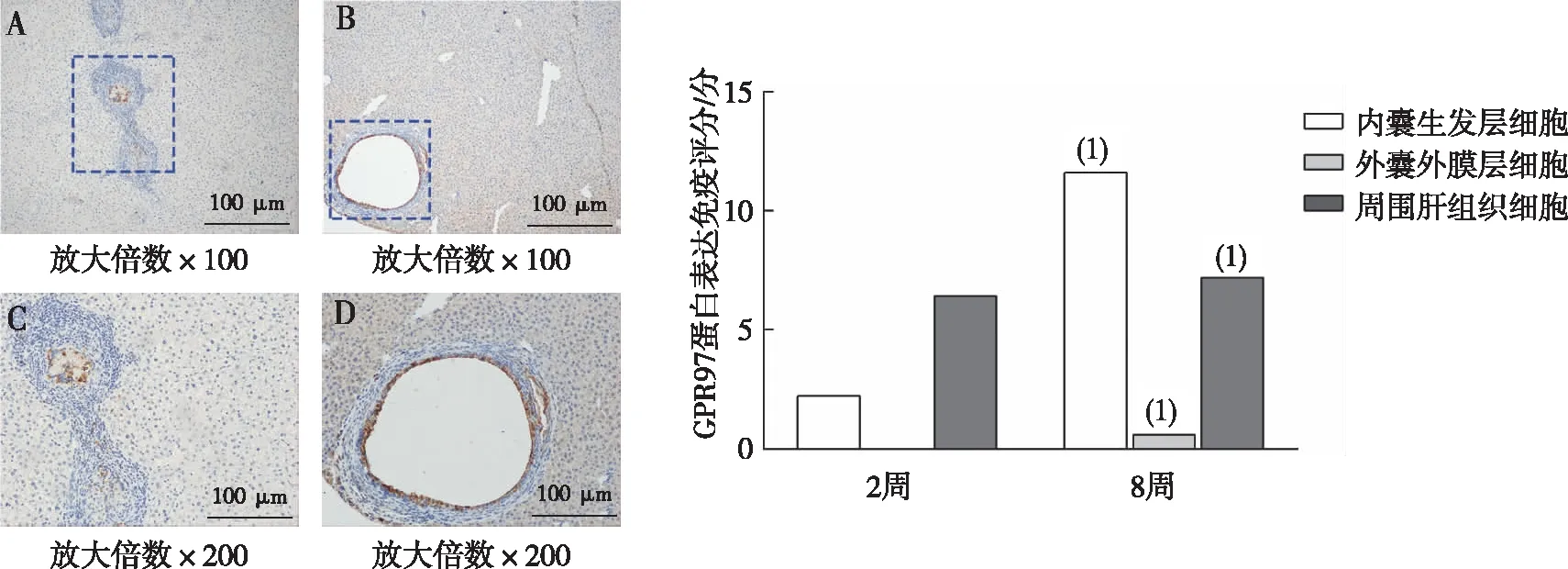
注:A、C为第2周肝组织GPR97蛋白免疫组化,B、D为第8周肝组织GPR97蛋白免疫组化。(1)与感染肝脏第2周时比较,P<0.05。图3 细粒棘球蚴感染小鼠肝组织的GPR97蛋白表达Fig.3 Expression of GPR97 protein in liver tissues of mice with echinococcus granulosus infection

注:A、C为第2周肝组织HuR蛋白免疫组化,B、D为第8周肝组织HuR蛋白免疫组化。(1)与感染肝脏第2周时比较,P<0.05。图4 细粒棘球蚴感染小鼠肝组织的HuR蛋白表达Fig.4 Expression of HuR protein in liver tissues of mice with echinococcus granulosus infection
2.4 肝组织Sema3A蛋白表达
Sema3A蛋白免疫组化染色结果显示,第2周时,小鼠肝组织包囊内有黄褐色阳性着色,肝细胞质呈不同程度的黄色阳性;第8周时,包囊空泡化后生发层细胞呈黄色阳性,外膜层无阳性表达,周边肝细胞质呈黄色阳性着色;与感染第2周时比较,感染第8周时细粒棘球蚴感染小鼠肝内囊生发层细胞、外囊外膜层细胞、周围肝组织细胞的Sema3A蛋白表达免疫评分均升高(P<0.05)。见图5。

注:A、C为第2周肝组织Sema3A蛋白免疫组化,B、D为第8周肝组织Sema3A蛋白免疫组化。(1)与感染肝脏第2周时比较,P<0.05。图5 细粒棘球蚴感染小鼠肝组织Sema3A的蛋白表达Fig.5 Expression of Sema3A protein in liver tissues of mice with echinococcus granulosus infection
3 讨论
细粒棘球蚴病是由细粒棘球绦虫引起的一种人畜共患疾病,其在人体中通常保持无症状,直到包囊破裂或不断生长变大,足以对周围组织施加压力,产生类似于占位性肿块的症状[12]。本研究建立细粒棘球蚴感染小鼠模型,HE染色和天狼星红染色结果表明,感染第2周时炎性细胞明显增多、纤维化包囊逐渐形成,纤维化组织逐步增生且致密;第8周时,包囊空泡化,形成内囊和外囊结构。包虫囊内侧的生发层向囊腔内产生育囊,外侧为无细胞角质层,具有弹性、机械抗性和过滤器的作用,保护生发层不被宿主细胞接触。寄生虫的生存策略不仅依赖于谋划物理屏障,还依赖于下调宿主反应。囊外侧被宿主炎症细胞以及不同数量的纤维组织包围[13],常见情况还有包虫立即被未过滤的胶原层包围,而在寄生虫较远的地方发现一些炎症灶[14]。在免疫细胞中,GPR97在白细胞中表达,如中性粒细胞、嗜酸性粒细胞和肥大细胞[8],GPR97最初发现于小鼠肠淋巴管内皮细胞,在调节B细胞命运和淋巴内皮细胞迁移中起重要作用[15]。本研究结果显示,在细粒棘球蚴感染小鼠模型中,GPR97在初形成的包囊中有弱阳性表达。感染初期炎性细胞增多,局部炎症的维持与寄生虫活力低下有关,而炎症的消退与幼虫的繁衍有关[13]。GPCRs位于细胞表面可以调控多种生理功能,但是关于GPR97在调节炎症反应中的作用仍存在争议。在高脂饮食喂养诱导的肥胖型小鼠体内,GPR97基因敲除可减轻脂肪组织炎症,减少M1型巨噬细胞浸润,增加M2型巨噬细胞浸润,从而导致促炎因子表达降低,抑炎因子表达升高[16],但在卵清蛋白诱导的过敏性哮喘的小鼠体内,GPR97基因敲除对炎症因子产生没有影响[17]。本研究结果表明,随着包囊空泡化的形成,内囊生发层细胞中GPR97呈现强阳性表达,炎性病灶增多,可能参与介导炎症反应。
HuR作为一类RNA结合蛋白,参与炎症和免疫反应基因转录后调控。研究表明,糖尿病患者心脏HuR表达升高与炎症标志物水平增高相关[18]。本研究结果显示在细粒棘球蚴感染初期,包囊内基本无HuR阳性表达,待包囊空泡化后,HuR在内囊生发层细胞呈中等阳性,与GPR97阳性表达趋势相近。Wei Fang等[19]发现缺血再灌注损伤模型小鼠肾脏HuR表达上调且与GPR97表达量呈正相关,并且GPR97通过影响HuR蛋白表达可对Sema3A进行转录后调节,从而影响Sema3A蛋白表达。Sema家族参与调节机体免疫反应,Sema3A与巨噬细胞共同培养时,诱导M1型巨噬细胞凋亡,而炎症因子会下调Sema3A受体,阻止Sema3A诱导巨噬细胞凋亡[20-21]。本研究结果显示,细粒棘球蚴感染初期时,Sema3A在形成的纤维化包囊中心细胞为弱阳性表达,在空泡化包囊生发层细胞也为弱阳性表达,提示炎性病灶增多可能会影响Sema3A蛋白表达。
综上所述,GPR97、HuR和Sema3A在细粒棘球蚴感染小鼠第2周和第8周肝脏空泡化包囊中均有不同程度的阳性表达,可能参与感染相关的炎症反应,是否为膜蛋白GPR97影响RNA结合蛋白HuR参与Sema3A信号通路调控,需进一步研究。
