右美托咪定通过AMPK/mTOR通路对老年大鼠术后认知功能障碍的影响
2022-12-23张倩张志卓王欢李瑞冰
张倩, 张志卓, 王欢, 李瑞冰
(1.河北省邢台市第三医院 麻醉科, 河北 邢台 054000; 2.河北省邢台市第三医院 手术室, 河北 邢台 054000; 3.河北省邢台市第三医院 心外科, 河北 邢台 054000)
术后认知功能障碍(post-operative cognitive dysfunction,POCD)是指在麻醉手术后患者中枢神经系统出现的一种并发症[1],多发于老年患者,主要表现为认知、注意力、意识及抽象思维等方面的障碍[2-3]。对POCD发病原因目前尚无统一观点,在一些国内外研究中认为手术麻醉因素会诱导中枢神经细胞结构发生改变,进而引发神经系统紊乱,导致神经细胞的凋亡与炎症,是引发POCD的重要原因[4-5]。目前临床尚未明确治疗POCD的方法,因此寻找安全有效的治疗药物是临床亟需的。右美托咪定作为选择性α2-肾上腺素受体激动剂,具有良好的镇静、镇痛及抗交感作用[6-7]。腺苷酸活化蛋白激酶和丝氨酸/雷帕霉素靶蛋白[adenosine 5’-monophosphate (AMP)-activated protein kinase/mammalian target of rapamycin, AMPK/mTOR]信号通路是一组在细胞营养与能量代谢、细胞生长和细胞内环境稳态中发挥作用的重要调控途径[8],在多项研究中表现出与神经细胞的凋亡有一定的作用[9-10]。为了探究右美托咪定对POCD 的改善作用及其相关机制,本研究通过对老年大鼠进行肝部分切除术并进行一系列分子生物学实验,以期为POCD的临床治疗及药物研发提供一定的思路及参考依据。
1 材料与方法
1.1 材料
1.1.1实验试剂与药物 盐酸右美托咪定注射液(国药准字H20090248,江苏恒瑞医药股份有限公司),β-肌动蛋白(β-actin)、AMPK、雷帕霉素靶蛋白(mammalian target of rapamycin , mTOR)、线粒体促凋亡蛋白(BCL2 Associated X, BAX)与胱天蛋白酶3(cysteinyl aspartate specific proteinase-3, Caspase-3)抗体及鼠抗二抗(北京博奥森生物技术有限公司),TUNEL细胞凋亡原位检测试剂盒(德国Roche公司,批号11782418713),PCR引物(上海生工生物工程股份有限公司),ELISA试剂盒(上海酶联生物科技有限公司)。
1.1.2实验动物 选取SPF级健康SD大鼠60只,由江苏艾菱菲生物科技有限公司提供,均为16~20月龄老年雄性大鼠,体质量为(550±50)g,大鼠随机分为假手术组、模型组、右美托咪定低剂量组及右美托咪定高剂量组,每组15只;采用标准饲料与饮用水喂养,饲养温度保持在(25±2)℃,相对湿度保持在(40±2)%,动物房进行定期消毒和通风,适应性饲养7 d进行实验。
1.2 研究方法
1.2.1术后认知障碍模型大鼠的制备 正常适应性喂养7 d,所有大鼠均以2%戊巴比妥钠(50 mg/kg)腹腔注射麻醉,模型组、低剂量组、高剂量组大鼠均在左侧最后1根肋骨下3 cm处打开1个切口,沿皮肤组织逐层分离,暴露出游离肝脏左叶,将肝左叶切除,确认无出血后缝合等待大鼠苏醒,完成老年大鼠术后认知功能障碍模型的制备[11]。假手术组麻醉后仅打开腹腔,不予以肝脏部分切除,其余步骤与另外3组一致。
1.2.2给药 低剂量组术前30 min以20 μg/kg盐酸右美托咪定腹腔注射给药,高剂量组以40 μg/kg盐酸右美托咪定腹腔注射给药,模型组与假手术组大鼠每天相同时间点腹腔注射等量生理盐水。术后模型组、高剂量组死亡各2只,剔除;右美托咪定低剂量组死亡1只,剔除;最终每组选取10只动物进行后续实验。
1.3 观察指标
1.3.1Zea-Longa评分大鼠认知障碍情况 采用 Zea-Longa 评分法于术前及术后1、6、12、24、72 h时对大鼠神经功能进行评分,无神经功能缺损症状为0分、无法充分伸展前爪为1分、行走时出现偏瘫转圈状况为2 分、行走时出现向左侧倾斜状况为3分、完全无法自发行走并出现意识丧失为4分,得分越高神经功能障碍越严重。术前各组大鼠Zea-Longa评分为0,待Zea-Longa评分处死大鼠,并取其海马组织备用,保存于-80 ℃冰箱。
1.3.2免疫印迹试验(Western blot)检测AMPK、mTOR、BAX与Caspase-3蛋白表达水平 取出部分大鼠海马组织,通过组织破碎仪加入RIPA 裂解液和PMSF蛋白酶抑制剂提取总蛋白,变性后放入-20 ℃冰箱备用。以Western Blot法分别通过电泳、转膜后进行相关抗体孵育,包括AMPK、mTOR与凋亡相关蛋白BAX、Caspase-3等抗体孵育,孵育完成洗膜后,用辣根过氧化物酶标记的鼠抗二抗孵育,最后将含有蛋白标记的膜洗净,涂上化学发光显影液通过显影仪拍照,结果用ImageJ软件对灰度值进行系统性分析。
1.3.3实时荧光定量试验(Real-time PCR)检测AMPK/mTOR通路相关mRNA水平 取出部分大鼠海马组织,将大鼠海马组织于液氮中磨碎,加入适量TRIzol试剂,通过匀浆机进行匀浆处理,随后进行分层、沉淀、清洗及溶解等步骤制得RNA备用。取制备的RNA进行反转录成cDNA,然后加入SYBR Green染料与AMPK、mTOR、BAX及Caspase-3上下游引物混合离心(引物序列见表1),随后于PCR仪上进行扩增,循环完成后做溶解曲线。以采集到的荧光信号值(Ct值)进行相对定量分析,比较各组心海马组织AMPK/mTOR通路相关mRNA的表达水平。

表1 所选基因引物序列Tab.1 Primer sequences of selected genes
1.3.4海马组织TUNEL染色病理学观察 将各组大鼠海马组织包埋后进行切片、脱蜡至脱水,随后浸润在H2O2中孵育30~40 min以消除其中的内源性过氧化酶活性;之后按照TUNEL染色试剂盒说明书步骤处理样本、并染色,随后在400倍显微镜下观察各组样本中海马CA1区神经元染色情况,阳性结果为出现细胞核固缩且细胞核被染成近褐棕色。
1.3.5ELISA检测海马组织炎症水平 取出部分大鼠海马组织,以25 mL/g 加入生理盐水混合研磨匀浆,离心后转移上清液至干净的EP管,按照ELISA试剂盒步骤对样本IL-1β与TNF-α进行标记,通过酶标仪测量450 nm处的吸光度,并以标准曲线来计算其中IL-1β与TNF-α含量。
1.4 统计学处理

2 结果
2.1 Zea-Longa认知障碍评分
术后各时间点各组大鼠的Zea-Longa认知障碍评分结果显示,模型组、低剂量组与高剂量组大鼠神经功能缺损评分显著高于假手术组,低剂量组与高剂量组大鼠神经功能缺损评分显著低于模型组,差异有统计学意义 (P<0.05)。见表2。
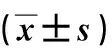
表2 各组大鼠Zea-Longa认知障碍评分情况Tab.2 Zea-Longa cognitive impairment scores of rats in each
2.2 海马组织AMPK、mTOR、BAX及Caspase-3蛋白表达
术后低剂量组与高剂量组大鼠海马组织AMPK、mTOR、BAX与Caspase-3的蛋白水平相对高于假手术组,但明显低于模型组,同时高剂量组较低剂量组AMPK、mTOR、BAX与Caspase-3的蛋白水平较低,差异有统计学意义(P<0.05)。见图1。

注:(1)与假手术组比较, P<0.05;(2)与模型组比较, P<0.05;(3)与低剂量组比较, P<0.05。图1 各组大鼠海马组织AMPK、mTOR、BAX及Caspase-3的蛋白水平Fig.1 Protein level of AMPK, mTOR, BAX, and Caspase-3 in the hippocampus of rats in each group
2.3 海马组织AMPK、mTOR、BAX及Caspase-3的mRNA水平
低剂量组与高剂量组大鼠海马组织AMPK、mTOR、BAX及Caspase-3 mRNA水平相对高于假手术组,但明显低于模型组,差异有统计学意义(P<0.05)。见图2。
2.4 神经元细胞病理学形态
结果如图3所示,模型组大鼠海马CA1区神经元细胞排列紊乱,细胞核出现固缩状态,右美托咪定组大鼠海马CA1区神经元数量与模型组相比明显增加,神经元凋亡指数明显降低,大鼠海马CA1区部分神经细胞结构恢复正常,细胞膜基本完整、且高剂量组凋亡情况低于低剂量组,差异有统计学意义(P<0.05)。

注:(1)与假手术组比较,P<0.05;(2)与模型组比较,P<0.05;(3)与低剂量组比较,P<0.05。图2 各组海马组织AMPK、mTOR、BAX及Caspase-3的mRNA水平Fig.2 Levels of AMPK, mTOR, BAX, and Caspase-3 mRNA in the hippocampus of rats in each group
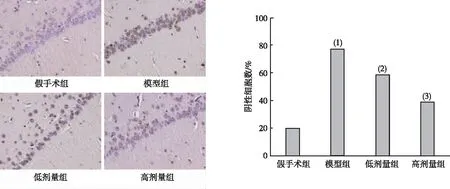
注:(1)与假手术组比较,P<0.05;(2)与模型组比较,P<0.05;(3)与低剂量组比较,P<0.05。图3 各组大鼠海马组织神经元细胞病理学形态(TUNEL染色,×400)Fig.3 Pathological morphology of neuronal cells in the hippocampal tissues of each group(TUNEL staining, ×400)
2.5 IL-1β、TNF-α水平
ELISA结果显示术后各组大鼠海马组织匀浆中L-1β与TNF-α水平均显著升高,但与模型组相比右美托咪定能一定程度上减轻炎症水平、且高剂量组降低IL-1β与TNF-α水平较低剂量组更高,差异有统计学意义(P<0.05)。见表3。

表3 各组大鼠海马组织匀浆中IL-1β与TNF-α水平Tab.3 Levels of IL-1β and TNF-α in the hippocampal
3 讨论
术后认知功能障碍的发生机制目前尚不明确,目前认为是多重因素共同作用的结果[12]。在神经退行性疾病中,神经细胞的凋亡往往发挥着重要作用,它通过基因表达调控从而导致细胞自主并且程序性的死亡[13],如果神经细胞凋亡水平的平衡失调,则会导致神经退行性疾病的发生发展,如阿尔兹海默症[14]、帕金森病[15]、亨廷顿氏舞蹈症[16]等存在认知功能障碍的疾病。本研究通过肝部分切除术进行老年大鼠术后认知功能障碍模型的制备和相应的实验研究发现,模型组大鼠较模型建造前Zea-Longa认知功能障碍评分明显升高,大鼠出现不同程度的行走偏瘫、倾斜或意识丧失,提示术后认知功能障碍大鼠模型制备成功。同时本研究实验结果还显示,右美托咪定组大鼠海马组织神经细胞凋亡率虽略高于假手术组,但明显低于模型组,该结果表明右美托咪定能有效抑制海马区神经细胞的凋亡,从而产生直接的神经保护作用。陈燕桦等[17]与康文越等[18]研究结果显示右美托咪定通过拮抗神经细胞的凋亡发挥一定的神经保护作用,与本研究结果一致。另有研究表明,在术后认知障碍大鼠中其海马区AMPK/mTOR信号通道表达异常[19]。AMPK是一种进化上保守的丝/苏氨酸蛋白激酶[20],mTOR也是一个保守的丝/苏氨酸激酶,是细胞生长和增殖的中枢控制器[21]。在目前的研究中,AMPK/mTOR信号通路是细胞能量代谢、内环境稳态和细胞凋亡进程中重要调控途径[22],在多种神经退行性疾病中发挥着重要作用。在本研究中,模型组大鼠海马区AMPK、mTOR蛋白与凋亡相关蛋白BAX、Caspase-3的表达明显上升,同时mRNA水平检测结果与蛋白表达检测结果一致,提示其凋亡水平增加,这可能与手术应激条件下AMPK被激活导致出现代谢衰竭状态后诱导产生大量的活性氧促使大鼠海马神经细胞凋亡有关,其下游mTOR同样会参与级联反应导致的神经细胞凋亡[23]。当给予盐酸右美托咪定后,术后认知障碍模型大鼠海马组织AMPK与mTOR表达量显著降低,神经细胞凋亡程度同样减轻,提示右美托咪定或许通过抑制AMPK/mTOR信号通路发挥作用,且提高给药浓度后,其抑制AMPK与mTOR的蛋白表达水平与抑凋亡作用明显提升,进一步说明了右美托咪定能通过抑制AMPK/mTOR信号通路发挥抑凋亡作用。
此外,在一些研究中由于手术应激反应导致的脑内炎症的发生,从而出现一系列中枢神经系统退行性变化,具有神经毒性的炎症介质,会影响神经元功能,从而导致认知功能的减退[24]。在本研究结果中,术后各组海马组织IL-1β与TNF-α水平升高,与其他研究一致。与模型组相比,右美托咪定能一定程度上减轻炎症水平,且高剂量组降低IL-1β与TNF-α水平较低剂量组更高,这可能与右美托咪定的中枢性拟交感作用和激活胆碱能抗炎通路从而发挥抗炎作用有关,国外的一些研究同样证实右美托咪定具有一定的抗炎作用[25]。
综上所述,本研究通过建立术后认知障碍老年大鼠模型,应用右美托咪定治疗发现右美托咪定改善其海马区神经细胞的凋亡进程,减轻手术应激产生的海马区炎症反应,从而发挥改善老年大鼠海马组织损伤后的认知功能障碍情况,其机制可能与调控凋亡相关信号通路AMPK/mTOR有关。本研究为开展老年患者手术应激产生的认知障碍的预防与治疗提供了新的思路与研究证据。
