支气管哮喘患儿血清lncRNA TUG1、miR-326水平与气道炎症的关系
2022-12-23李晓娜赵和萌周进进王娟
李晓娜,赵和萌,周进进,王娟
连云港市第一人民医院儿内科,江苏 连云港 222000
支气管哮喘(BA)是儿童时期常见的慢性呼吸道炎症性疾病,近年来,随着环境污染的加重,儿童BA患病率逐年上升。据统计,我国儿童BA患病率为2.12%[1],其反复发作不仅严重损害患儿身心健康,而且导致儿童误学率和家长误工率居高不下,给其家庭乃至社会带来负担[2]。尽管目前针对儿童BA的诊治已取得较大进展,但仍有超过20%的儿童BA未达到良好控制[3],研究BA发生、发展的机制是目前研究热点。气道炎症是BA发生、发展的关键机制[4]。近年越来越多研究表明,长链非编码RNA(lncRNA)、微小RNA(miRNA)等非编码RNA参与气道炎症发生、发展[5-6]。牛磺酸上调基因1(lncRNA TUG1)是新近发现的一种lncRNA,研究报道,lncRNA TUG1在BA大鼠模型中表达上调[7]。miR-326是一种保守的miRNA,研究报道,miR-326在BA气道平滑肌细胞中表达下调[8]。目前,关于lncRNA TUG1、miR-326与BA患儿气道炎症的关系报道较少。本研究我们探讨BA患儿血清lncRNA TUG1、miR-326水平与气道炎症的关系,旨在为儿童BA防治提供参考。
1 资料与方法
1.1 临床资料选取2019年1月—2022年1月我院收治的106例BA患儿,根据病情严重程度分为两组,急性发作期组43例,男24例、女19例,年龄1~14(7.41±2.68)岁。临床缓解期组63例,男36例、女27例,年龄1~14(7.35±2.53)岁。另选取同期57例健康儿童为对照组,男32例、女25例,年龄1~14(7.27±2.19)岁。三组性别、年龄比较差异无统计学意义(P均>0.05)。BA患儿纳入标准:①经肺通气功能检测确诊,符合《儿童支气管哮喘诊断与防治指南(2016年版)》[9]诊断标准;②年龄1~14岁;③临床资料完整;④患儿家属或监护人知情并签署同意书。排除标准:①合并过敏性鼻炎、支气管扩张、肺结核等气道内阻塞性疾病或先天性气道、肺组织发育异常;②合并造血、免疫系统损害;③合并严重心肝肾功能损害;④近3个月内使用糖皮质激素;⑤近3个月内呼吸道感染史。本研究经医院伦理委员会批准(2019-213)。
1.2 观察指标与方法
1.2.1 血清指标检测收集BA患儿入院次日清晨和对照组体检时6 mL空腹静脉血,3 000 r/min离心15 min(离心半径10 cm),取上层血清,分置两管保存-80℃冰箱至检测。取1管血清标本,使用TRIzol试剂盒(北京百奥莱博科技有限公司,编号:ALH011)提取血清总RNA,微量分光光度计(赛默飞世尔科技有限公司,型号:NanoDrop)验证纯度、浓度合格(光密度260/280),使用TaKaRa反转录试剂盒(北京智杰方远科技有限公司,编号:RR036A)合成cDNA。以cDNA为模板,按照SYBR®Premix Ex Taq™试剂盒(上海赫果生物科技有限公司,编号:DRR820A)进行PCR扩增:lncRNA TUG1正向引物:5'-GGACACAATTCGCCACGACTT-3',反 向 引 物:5'-GCGCAGTCCCAGATTCCA-3';内参GAPDH正向引物:5'-AGAAGGCTGGGGCTCATTTG-3',反向引物:5'-AGGGGCCATCCACAGTCTTC-3';miR-326正向引物:5'-TGAAAGACGTGATGGCACAC-3',反向引物:5'-CTTCCATTTTGGGGTTTTTGG-3';内参U6正向引物:5'-CCCCGTCAGATAATCTGTG-3',反向引物:5'-CTTGTCAGATACGGGAGG-3'。PCR反应体积20 µL:SYBR®Premix Ex Taq 10 µL、正反向引物各0.8 µL、cDNA模板2.0 µL、ROX Reference Dye(50×)0.4 µL、RNase Free H2O 6.0 µL;反应条件:95℃90 s、95℃30 s、63℃30 s、72℃15 s共循环40次,收集Ct值,采用2-ΔΔCT法计算血清lncRNA TUG1、miR-326相对表达量。另1管血清标本采用酶联免疫吸附试验检测血清白细胞介素-4(IL-4)、IL-10、IL-13、干扰素-γ(IFN-γ),试剂盒均购自武汉亚科因生物技术有限公司,编号:KET6015-1、KET6019-1、KET6021-1、KET6011-1。
1.2.2 气道炎症指标检测BA患儿入院次日清晨和对照组体检时,采用瑞士ANALYZER CLD 88 sp分析仪,通过多重潮气呼吸法在线测定呼出气一氧化氮(FeNO),连续测定3次,取平均值。
1.3 统计学方法采用SPSS28.0统计软件。计量资料符合正态分布以±s表示,多组间比较采用F检验,两两比较采用t检验。偏态分布计量资料以M(P25,P75)表示,组间比较采用H检验,事后多重比较用Bonferroni校正。Pearson/Spearman相关法分析BA患儿血清lncRNA TUG1、miR-326水平与FeNO和炎症因子的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 三组血清lncRNA TUG1、miR-326水平比较对照组、临床缓解期组、急性发作期组血清lncRNA TUG1水平依次升高,miR-326水平依次降低(P均<0.05)。见表1。
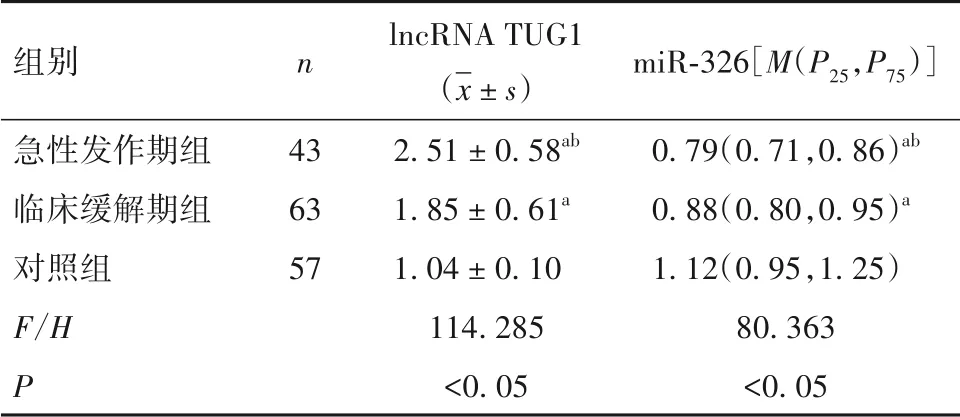
表1 三组血清lncRNA TUG1、miR-326水平比较
2.2 三组FeNO和血清炎症因子水平比较对照组、临床缓解期组、急性发作期组FeNO和血清IL-4、IL-13水平依次升高,IL-10、IFN-γ水平依次降低(P均<0.05)。见表2。

表2 三组FeNO和血清炎症因子水平比较
2.3 BA患儿血清lncRNA TUG1、miR-326水平与FeNO和炎症因子的相关性经https://starbase.sysu.edu.cn/网站预测,lncRNA TUG1与miR-326存在互补序列(图1)。Pearson/Spearman相关性分析显示,BA患儿血清lncRNA TUG1水平与miR-326、IL-10、IFN-γ水 平 呈 负 相 关(r分 别 为-0.625、-0.581、-0.667,P均<0.05),与FeNO和IL-4、IL-13水平呈正相关(r分别为0.701、0.634、0.651,P均<0.05);miR-326水平与IL-10、IL-13水平呈负相关(r分别为-0.558、-0.602,P均<0.05),与FeNO、IL-4、IFN-γ水平呈正相关(r分别为0.689、0.614、0.638,P均<0.05)。
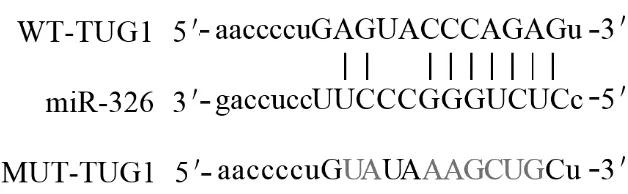
图1 lncRNA TUG1与miR-326的互补序列示意图
3 讨论
BA是多种细胞和细胞组分参与的一种以慢性气道炎症和气道高反应性为特征的异质性疾病,以喘息、咳嗽、胸闷、气急等症状反复发作为主要临床表现,随着病情进展可引起气道增厚狭窄甚至阻塞性通气功能障碍,严重危急患儿生命安全,探索其发病机制有助于早期诊断和提升治疗效果[10]。气道重塑是BA发生、发展以及难以根治的主要原因,慢性、持续的气道炎症可导致气道上皮反复损伤和修复,从而引起炎症细胞和结构细胞释放生长因子、趋化因子等多种细胞因子,驱动气道重塑。因此,抑制气道炎症对改善BA肺功能和提升患者生活质量有重要意义[11]。
FeNO是气道细胞产生的一种生物调节因子,其浓度与气道炎症细胞数目呈高度相关,因此被国内外指南作为BA气道炎症和BA控制水平的检测指标[10,12]。气道炎症能引起上皮细胞损伤和修复,进而诱导大量炎症细胞产生,IL-4、IL-10、IL-13、IFN-γ是常见的炎症细胞因子,其中IL-4、IL-13作为促炎细胞因子,能进一步促进BA进展,IL-10、IFN-γ作为抗炎细胞因子,能通过抑制嗜酸性粒细胞活化、分化和募集等抑制气道炎症发展[13-14]。本研究中,对照组、临床缓解期组、急性发作期组FeNO和血清IL-4、IL-13水平依次升高,IL-10、IFN-γ水平依次降低,说明BA患儿存在明显气道炎症,且与BA进展有关,符合BA病理过程。目前主要认为,BA气道炎症启动和持续过程由遗传机制、神经调节机制、免疫机制等多种机制共同参与。近年来,随着表观遗传学的深入,发现表观遗传学中非编码RNA调控、组蛋白修饰、DNA甲基化等在BA发生、发展中发挥重要作用[15]。lncRNA是一类新兴的表观遗传学调控分子,能通过竞争性占有胞内miRNA海绵样干涉miRNA活性,间接调控靶mRNA表达,进而参与气道炎症发生、发 展[5]。lncRNA TUG1定 位 于22号 染 色 体q12.2,最初因其在新生小鼠视网膜细胞中随着牛磺酸加入而表达上调,故被称为lncRNA TUG1。多项研究发现,lncRNA TUG1能通过促进核因子-κB(NF-κB)通路活化参与炎症反应过程,如敲低lncRNA TUG1能抑制NF-κB通路活化来抑制椎间盘盘髓核细胞炎症和凋亡[16]。lncRNA TUG1能通过促进NF-κB p65转录激活NF-κB通路,促进系统性红斑狼疮小鼠肾间质炎症反应[17]。上述研究均提示lncRNA TUG1能通过NF-κB通路参与炎症反应。气道平滑肌细胞的异常增殖和迁移是气道炎症反应刺激的一个重要表现。近年研究发现,抑制lncRNA TUG1能抑制气道平滑肌细胞的异常增殖和迁移[18]。本研究结果显示,对照组、临床缓解期组、急性发作期组血清lncRNA TUG1水平依次升高,说明血清lncRNA TUG1高水平参与BA发生、发展。进一步分析发现,BA患儿血清lncRNA TUG1水平与FeNO和IL-4、IL-13水平呈正相关,与IL-10、IFN-γ水平呈负相关,提示血清lncRNA TUG1高水平可能通过促进气道炎症参与BA发生、发展。分析其机制可能与lncRNA TUG1能促进NF-κB通路活化有关。NF-κB是参与多种炎症蛋白基因转录的重要转录调节因子,在BA气道炎症中发挥重要作用[19]。体外实验发现,上调lncRNA TUG1能促进NF-κB信号通路活化,激活气道炎症反应[20]。此外,气道炎症是BA气道高反应性的重要原因。近期实验发现,lncRNA TUG1作为竞争性内源RNA能促进PM2.5暴露诱导的气道高反应性[21]。
miRNA是一类新兴的表观遗传学调控分子,能通过降解或抑制蛋白质翻译调控靶基因表达,参与气道炎症发生、发展[6]。miR-326定位于11号染色体q13.4。近年研究发现,miR-326能通过NF-κB通路参与炎症过程,如上调miR-326能通过Toll样受体4/髓样分化初级反应基因88/NF-κB信号通路抑制肝星状细胞炎症反应[22]。上调miR-326能靶向程序性细胞死亡因子4使NF-κB信号通路失活,抑制肺炎发展[23]。上述研究说明miR-326参与抑制NF-κB信号通路激活,但关于miR-326与BA患儿气道炎症的关系尚未可知。本研究结果显示,对照组、临床缓解期组、急性发作期组血清miR-326水平依次降低,说明血清miR-326低水平参与BA发生和发展。进一步分析发现,BA患儿血清miR-326水平与FeNO和IL-4、IL-13水平呈负相关,与IL-10、IFN-γ水平呈正相关,提示血清miR-326低水平可能通过促进气道炎症参与BA发生和发展,分析其机制可能与miR-326能抑制NF-κB通路活化有关。环境污染物尤其是PM2.5暴露是诱导RA气道炎症的重要原 因[3]。在PM2.5暴 露 诱 导 的 炎 症 反 应 中,上调miR-326能抑制NF-κBp65的磷酸化,进而抑制NF-κB信号通路激活[24]。同时实验发现,miR-326能靶向肿瘤坏死因子超家族成员14,抑制气道平滑肌细胞炎症、异常增殖和气道重塑[25]。笔者通过Starbase数据库预测发现,lncRNA TUG1与miR-326存在互补序列。相关性分析发现,BA患儿血清lncRNA TUG1与miR-326水平呈负相关,提示二者可能共同参与BA患儿气道炎症发生、发展。李青华等[26]通过双荧光素酶实验也证实,沉默lncRNA TUG1能靶向抑制miR-326,促进BA患儿气道平滑肌细胞炎症因子释放。进一步佐证了本研究结果。
综上所述,BA患儿血清lncRNA TUG1水平升高,miR-326水平降低,可能共同参与BA患儿气道炎症发生、发展。但本研究样本量较少,关于lncRNA TUG1、miR-326参与BA发生、发展的机制有待进一步研究。
