消毒剂副产物在地下水环境中行为研究进展
2022-12-21刘大为焦珣万博柴娟芬刘丹张文静
刘大为,焦珣,万博,柴娟芬,刘丹,张文静
(1.陕西省环境科学研究院,陕西 西安 710061;2.吉林大学 地下水资源与环境教育部重点实验室,吉林 长春 130021;3.吉林大学 新能源与环境学院,吉林 长春 130021;4.山东省水利科学研究院,山东 济南 250014)
消毒剂可以对病原微生物进行消杀,降低病原微生物对人体健康的风险,消毒剂应运而生,已成为保障人民生活环境安全卫生的必要武器。然而,消毒带来的水环境二次污染问题也日益暴露出来,有关水环境中消毒剂副产物的污染问题引起了越来越多国内外学者的关注[1]。新型冠状病毒肺炎疫情爆发以来,消毒已经成为各国居民日常生活中必不可少的一部分。北京市疾控中心曾表示,过度消毒所带来的残留消毒剂会对环境造成威胁,因此要求各地规范使用消毒水,避免过度消毒对地表地下水体造成污染。
目前已被监测并确认的消毒剂副产物超过700余种,大部分具有三致性,对人类的生活和身体健康造成直接威胁。尽管目前WHO以及美国、德国、中国等制定了有关水环境中消毒剂副产物部分指标的浓度限值,可将消毒剂的投放量控制在较为安全的浓度水平,但是当这些含有消毒剂的水源进入到地下含水层时,由于其赋存环境、接触介质发生了明显变化,地下水中是否存在消毒剂副产物的二次形成?消毒剂副产物在地下水中的迁移转化归宿究竟会如何发展?是否会给地下水环境质量带来安全隐患?目前还尚未有答案。
因此,针对消毒剂副产物给地下水环境安全带来的新挑战,本文在检索国内外相关研究的基础上,结合前期研究基础,分别从消毒剂副产物的种类特征、形成机制及其影响因素、地下水中迁移转化机制进行总结分析,为地下水中消毒剂副产物污染的科学防控提供支撑与参考。
1 消毒剂副产物
消毒剂副产物(DBPs)是指消毒剂(或其中间体)与水中前体物(常为水中有机物)在一定条件下发生氧化还原反应生成的副产物。自20世纪70年代Rook等首次发现三氯甲烷以来,水环境中DBPs研究越来越受关注,且随着水环境污染日趋严重,水体中所含的有机物种类和浓度均有所增加,有机组分日益复杂,这使得为消毒剂副产物生成提供的有效前体物(NOM)也不断复杂化,使得水环境中 DBPs 种类日益繁多(表1)[2],被检出且已确认DBPs种类更是高达700余种。主要包括四大类:三卤甲烷(THMs)、卤代乙酸(HAAs)、卤代乙腈(HANs)和致诱变化合物(MX)。其中,三卤甲烷、卤代乙酸、卤代乙腈所占比例较大,三者含量总和超过80%。

表1 消毒剂副产物结构式及其限值Table 1 Disinfectant by-product and water quality standard
DBPs经过饮用进入体内会在细胞内积聚,当浓度或剂量达到一定水平则会促使细胞发生癌变。动物实验数据证实,109种DBPs具有致癌、致畸和致突变效应[3]。除此之外,DBPs毒理学效应还包括肝毒性、神经毒性、生殖毒性等。表2数据表明水中含量最大的消毒副产物THMs普遍具有致肿瘤毒性(除了BDCM),而含量次之的HAAs、HANs单位致癌风险却远远高于THMs。
为降低饮用水健康风险,世界各国、联合国及地区组织都对饮用水中某些DBPs浓度进行了限制,或提出浓度建议值以保证饮用水水质安全,具体见表1。但随着DBPs研究的深入,更多DBPs被检出并确认,其数量远远多于饮用水水质标准所关注的种类。除了单列某种副产物限值,也可对一类DBPs作出规定。如欧盟要求饮用水中THMs总量(TTHMs)限值为100 μg/L,溴酸盐限值为10 μg/L,美国规定TTHMs、THAAs、溴酸盐、亚氯酸盐的限值分别为40,30,10,1 000 μg/L;而我国在《生活饮用水卫生标准》(GB 5749—2006)中规定四种THMs的浓度与其限值的比值之和不得超过1。
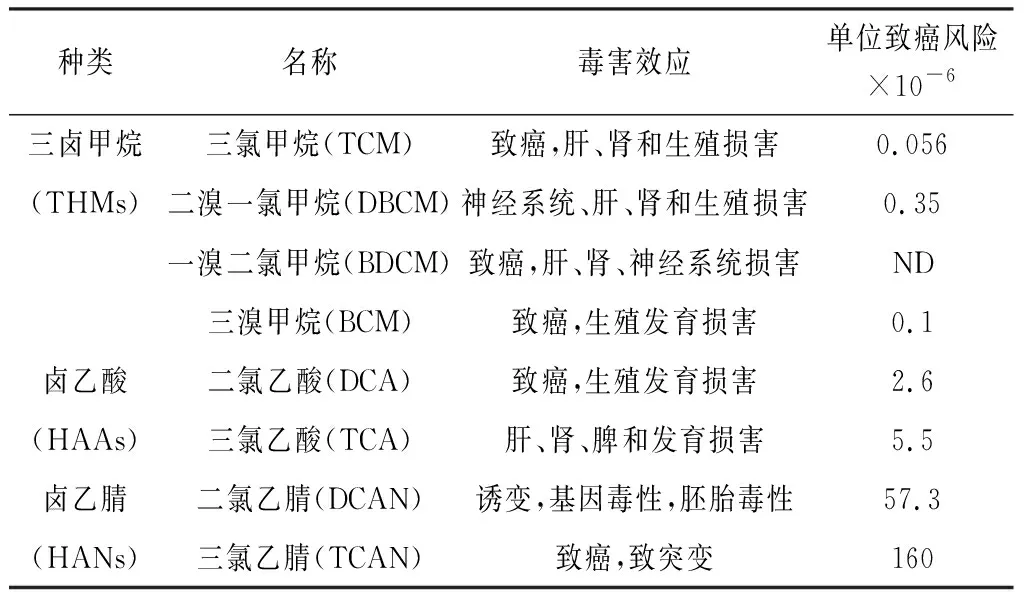
表2 消毒剂副产物的毒理学信息汇总Table 2 Summary of toxicological information of disinfectant by-products
2 地下水消毒副产物形成机制及其影响因素
2.1 地下水消毒副产物的形成机制
1974年Rook在研究消毒剂副产物三氯甲烷时,提出其形成过程包括水解反应和氯化反应两个过程。消毒剂通过水解形成次氯酸,次氯酸在水中不稳定,进一步解离,以离子态存在。HClO和OCl-均具有强氧化性,通过破坏细胞膜和部分酶系统,从而致死病原微生物达到消毒目的;但与此同时强氧化性的次氯酸也与水中DBPs前体物发生开环、氧化、取代、加成等反应形成DBPs。例如,THMs的形成过程首先是氯原子取代或加成前体物部分结构,然后使前体物中的烯醇式结构发生互变异构生成醛酮结构,随后发生开环、水解、脱酸作用形成。
作为地下THMs的主要前体物,腐殖质广泛存在于地下水中,其富含的腐殖酸、富里酸等化学结构复杂,普遍含有羧基、羟基、酚基、酮基等官能团,为强氧化性消毒剂提供了丰富的活性反应基团[4-5]。苯酚类结构是消毒剂副产物形成作用的重要前体物,其中间二苯酚是THMs的主要前体物,在强氧化作用下氯或溴加成生成卤代苯酚,脱羟基后形成三卤代甲基酮等中间产物,再开环使C—C键断裂形成CHCl3。黄君礼等[6]通过生成实验发现,两个羟基或羰基之间的活性空位碳原子是形成CHCl3的最有效活性点。此外,还有β-二酮、柠檬酸等也是重要前驱物化合物。Gallard[7]从反应动力学角度将THMs前体物分为快速反应前体物和慢速反应前体物两种,二苯酚类化合物是主要的快速反应前体物,而酚类化合物则属于慢速反应前体物。
由于土壤基质复杂性和地下水的非直视性,与饮用水相比,地下水DBPs形成机制的研究还较少。尤其是在大规模应用自来水回灌地下以解决地下水漏斗和地面沉降等实践后,地下水DBPs的深入研究已迫在眉睫。
2.2 地下水消毒剂副产物生成影响因素
消毒剂副产物的生成主要取决于水源水质特征和消毒过程中消毒剂投加条件。在地下水源作为饮用水的前处理消毒过程中,消毒剂副产物的生成与消毒剂的种类及剂量、有机前体物的性质和浓度、温度、pH值、溴化物及碘化物浓度、离子强度以及水环境中的胶体浓度等因素相关。其中,由于地下水中天然存在的有机前体物相对复杂,是在消毒剂种类以外的又一决定性因素。
2.2.1 消毒剂种类及投加量 DBPs是伴随消毒过程产生的副反应,因此消毒剂的种类及消毒机理对DBPs的种类及形成过程有决定性影响。采用氯消毒剂时主要形成THMs、HAAs等;采用氯胺消毒则更容易生成HANs;采用二氧化氯消毒则形成氯乙醛;采用臭氧消毒则形成以甲醛为主的DBPs;而采用紫外光、光照法以及光芬顿、电芬顿法进行水体消毒处理,因未引入化学试剂故基本上不会生成消毒剂副产物。实践中往往采用多种消毒方法对水体进行消毒以满足深度处理要求,联合消毒较之单独消毒,其灭活效果得到显著提高,与此伴生的DBPs种类也更加复杂。
消毒剂投加量直接决定消毒反应的进程,也是消毒副反应的关键影响因素。通常随着投氯量的增加,DBPs的形成速率越快,形成量也越多。以氯倍率(有效率/总有机碳)为指标,当氯倍率<0.2时,THMs生成较少,当氯倍率逐渐增加到2时,余氯的衰减量与THMs呈正相关,当氯倍率>2后,前体物相对于有效氯不足,限制THMs进一步生成,THMs生成量趋于稳定。李聪[8]研究了紫外线-氯联合消毒模式下,随着紫外线强度增加,水中有机碳(反应前体物)质量浓度下降,但THMs的生成量却明显增大。
2.2.2 反应前体物 反应前体物物性不同,生成DBPs的种类和机制存在较大差异。按照亲水性差异,疏水性、高分子量有机物在氯消毒过程中比亲水性、低分子量有机物形成更多THMs;而亲水性、低分子量有机物更易与溴、碘结合生成THMs和HAAs[9]。在形成DBPs过程中,前体物中芳香族基团优先开始氯化反应,脂肪族基团则优先进行溴化、碘化反应。
地下水受土地利用类型、生物活动和地球化学循环等因素影响,含有的天然有机物性质各异,直接决定了DBPs的生成潜力[10]。主要前体物为腐殖质中的腐殖酸和富里酸,且DBPs的生成速率随着可溶性有机物浓度增高而加快,其生成量与腐殖酸的浓度呈现良好的数学关系[11]。但当有机物浓度增加到某一临界值(12 mg/L)后,DBPs生成量达到最大,继续增加有机物浓度DBPs生成量基本不变甚至还略有下降。从反应计量角度看,腐殖酸耗氯量大于富里酸,同等计量的腐殖酸生成THMs、HAAs的量高于富里酸生成的量。
2.2.3 pH 水体pH直接关系着水中消毒剂存在形式和前体物水解性质,对DBPs的生成产生较大影响。在氯化消毒过程中,pH值变化影响次氯酸钠电离平衡,导致HClO和OCl-的比例发生较大变化,对不同DBPs产生不同影响。pH增大(由酸性变为碱性,5~10范围内),加大THMs生成,却抑制HAAs生成[4]。仝重臣[12]则以pH=7为界,发现pH<7时THMs生成量与pH值呈负相关,pH>7时却呈正相关关系。倪先哲等[13]研究则表明,在中性环境下,THMs、HAAs的生成量最高。
此外,pH值会对水体中有机前体物水解性质产生影响。碱性条件下,羧酸基团易质子化,OH— 利于甲基酮转化为烯醇式结构从而变得更加稳定,含一个活性空位碳的前体物更容易形成THMs。

2.2.5 反应时间 在消毒过程中,氯与腐殖质的反应在初期速率较快,其后大致以恒定的速率递减[6]。研究发现,随着反应时间增加,THMs、HAAs等生成量逐渐增加,达到一定时间后,产量则趋于稳定。以上规律普遍适用于最终产物,但如果是中间副产物,反应时间延长反而会使其生成量减少。三卤丙酮、三卤乙醛等会发生水解反应,当氯或者前体物消耗完后,水解反应会导致其浓度降低[18]。
2.2.6 其他影响因素 温度越高,消毒剂副产物的生成量越大,夏季水体THMs生成量高于冬季。伍海辉等[18]监测发现黄浦江中THMs浓度变化具有季节性,7月和8月的THMs浓度明显高于其他月份;吴艳[19]测试了在5,10,20,30 ℃环境下氯化反应的速率,结果表明THMs生成量与温度呈正相关,形成THMs过程为吸热反应,随着温度的增加,反应速率增大。Gallard等[7]研究表明当温度在0~ 30 ℃ 之间时,反应温度每增加10 ℃,THMs的形成速率增加1倍。
当水中含有Br-时,氯的强氧化性使Br-转化成HBrO、BrO-等,由于Br-前体反应的优越性,易于形成毒性更高的溴代DBPs(Br-DBPs)[20]。研究表明Br-存在时,Br-DBPs生成量增加[21]。另外,Paul等[22]研究发现,氨的加入可以显著降低氯化水回灌后地下水中TTHMs和THAAs的含量。
地下水环境中胶体广泛存在,已有研究表明,在SiO2胶体存在条件下,胶体浓度由0升高至 20 mg/L,CHCl3的形成过程与无胶体条件下基本一致,但相同反应时间条件下CHCl3生成量明显低于无胶体条件,且胶体浓度越大,CHCl3生成速率及生成量越小。这是因为胶体的存在会吸附前体物,从而减少消毒剂副产物的生成量。
3 地下环境中的消毒剂副产物
3.1 污染现状及来源分析
美国开展的研究表明,氯化消毒水可以通过灌溉、泳池泄露、温泉或污水处理进入地下环境。相较于土地利用类型为农业用地以及欠发达地区来说,城市地下水中监测到THMs的频率相对较高[23]。在美国城市的405个地下水样品检测中,三氯甲烷的浓度最高达到400 μg/L,远高于乡村地下水的 74 μg/L[24]。这可能是由于这些地区普遍缺乏经过氯处理的饮用水或废水来源,而城区地下水中的三氯甲烷的存在极有可能来自氯化消毒供水、游泳池等地的泄露。另外,针对1996~2007年美国饮用水供应井中氯仿和其他三卤甲烷的来源和发生情况分析[23]研究中指出,未经处理的地下水样品测试中,三氯甲烷含量位居挥发性有机物中第一位。
此外,Mille等在野外人工回灌试验过程中首次发现回灌后地下水中THMs浓度明显高于回灌水源中的THMs浓度,这表明人工回灌过程中存在二次生成消毒剂副产物的风险。2016年,在上海市政府利用自来水进行人工回灌防治地面沉降过程中,Wu等[1]研究发现由于自来水系统中余氯的存在使得回灌后的地下水中形成多种消毒剂副产物。Breider[25]通过同位素研究地下水中三氯甲烷的来源,结果显示,城市和垃圾填埋场地下水中的三氯甲烷含量(δ13C,-43‰~-63‰)明显高于林区地下水(δ13C,-22‰~-27‰13C),且其同位素特征与天然有机物(NOM)相似。这表明人为因素造成三氯甲烷进入地下水环境中的可能性是存在的,且极有可能是消毒剂与地下水中有机物反应生成。Haselman 和Albers等[26-27]在研究中发现,土壤-空气和地下水中三氯甲烷浓度存在明显的季节性变化,且在空间上分布不均,说明在包气带存在三氯甲烷的生成作用。此外,由于沿海含水层地下水具有卤化物和溶解有机碳含量变化大的特点,故随海平面上升,地下水中的消毒剂副产物(尤其是三卤甲烷和卤乙酸)的含量显著增加,即入侵海水中的卤化物与沿海地下水中有机前体物结合,诱发消毒剂副产物的生成,增加其生物毒性[28]。
地下水环境中,以三卤甲烷为代表的消毒剂副产物的存在相对广泛,且由于地下水环境的复杂性,地下水中的消毒剂副产物种类更为复杂。在较为发达的城区,饮用水消毒残留、废水消毒处理后回灌入渗,泳池、公共设施环境等消毒水体的入渗是导致城区地下水消毒剂副产物含量较高的主要原因。当然,在出现病毒性流感、疫情的情况下,由于各场所加大消毒处理力度,使得环境中消毒剂大量残留,随水流进入地下时,与地下环境中存在的有机前体物发生反应,加剧地下水环境中三卤甲烷等的存在。而在较为落后的农村地区,地下水环境中的消毒剂副产物含量相对较低,但是由于农牧业的发展,该区地下水环境中的消毒剂副产物的种类相对更为复杂。
结合消毒剂副产物的形成机制以及地下水环境特点,不难判断,尽管将消毒剂投放量控制在目前多数国家对饮用水中消毒剂副产物的浓度限值范围内,但由于介质特征、水化学条件、水动力条件的差异,进入到地下环境中的消毒剂仍然具备二次生成消毒剂副产物的潜力,甚至可导致地下水中消毒剂副产物浓度超标。这是由于消毒剂在外源水协同进入地下环境的过程中,打破了原有的“消毒剂-外源水有机物”反应平衡体系,形成新的“消毒剂-外源水有机物-地下水有机物-溶滤作用增加有机物”复杂反应平衡体系。由于回灌水中氯的投加量大于消耗量时,多余的氯将与地下水中天然有机物发生反应,导致地下水中消毒剂副产物的二次生成。除此之外,注入的回灌水对地下水动力场和水化学场造成扰动,进而影响消毒剂副产物生成的相关要素也将随着赋存环境、接触介质的改变而发生变化。由此可见,只有准确掌握地下水中消毒剂副产物的形成机制及其影响因素,才能科学评估后续消毒剂副产物在地下水中的迁移转化过程。
3.2 迁移转化机制
大多数有机污染物在多孔介质中的迁移转化及归宿主要由一系列的物理(对流、弥散、沉积)、化学(吸附-解吸、光解)、生物(转化、降解、富集)等过程所决定。而对于消毒剂副产物来说,由于属于消毒剂的二次形成产物,其在地下水中的迁移转化过程更为复杂,可概化为“形成+对流+弥散+吸附+降解”的多机制耦合过程,主要受到其本身的理化性质、多孔介质相关参数、水化学条件、水动力学条件等因素的制约。前面关于消毒剂副产物的形成机制已进行详述,这里主要分析其在地下水环境中的对流、弥散、吸附及降解过程。
3.2.1 对流 在地下水环境中,可溶性污染物随地下水流一起运动,某些不溶于水的污染物也会随地下水一起运动,地下水流场特征决定污染物的运移方向与速度。在地下水环境中富含的,且能够携带污染物共迁移的胶体在多孔介质中的迁移就受到水力流速和胶体浓度的影响。对于有机污染物来说,在天然的非均质环境中,其运移时极易形成优先流,形成边缘尖锐的污染羽[29]。
消毒剂副产物绝大多数为可溶性物质,在地下水环境中溶于地下水随水流向前运移。课题组的野外试验结果表明,在沿地下水流方向上最大迁移距离为5.87 m,而垂直河道和平行于河道方向的最大迁移距离分别为4.55 m和3.18 m,这说明CHCl3在地下水环境中的运移受地下水流场的影响,流速较大方向上运移速度较快。
3.2.2 弥散 污染物在地下水环境中的弥散包括物理化学弥散和机械弥散,物理化学弥散由污染物浓度差异控制,由浓度高的区域向浓度低的区域运动;而机械弥散则是由于土壤孔隙的存在使得地下水环境中各位置上的流速大小和方向均不同,从而导致污染物在土壤中进行不均匀运动,在地下水中发生弥散。弥散作用受地下水流速、多孔介质特征以及污染物浓度控制。多孔介质粒径越大,孔隙度也随之增大,污染物的弥散也就越充分;同时水流流速的增大则会缩短污染物在多孔介质中的滞留时间,使得弥散越不完全[30]。因而,尤其是在含水层中夹杂的弱透水介质的界面上更易因弥散作用积累污染物,随着运移尺度的增加,弥散系数呈指数增加[31]。
实际的野外场地多以非均质介质为主,地质条件较为复杂,CHCl3等在其中的迁移受弥散作用的影响不容忽视。
3.2.3 吸附作用 在地下水环境中,胶体是指粒径在1 nm~1 μm范围内的颗粒性物质,是不同于土壤介质和水之外的第三相[32]。越来越多的研究表明,由于胶体自身粒径小、比表面积大且胶体表面带有较多自由电荷等特殊理化性质,胶体与污染物间通过吸附及络合作用,表现出与污染物更高的亲和性,直接或间接影响了污染物在地下水中的迁移能力[33-34]。
消毒剂副产物在地下水系统中的迁移扩散作用受含水介质及其中胶体存在的吸附作用影响。在多孔介质中,有机污染物易于被土壤吸附而不易迁移到地下水环境中,但地下水中的胶体增强了其迁移能力[35]。有机物在土壤介质中的吸附机理可分为传统吸附和分配理论,其中,传统吸附理论强调的是有机物通过范德华力和氢键等分子间作用力与介质颗粒表面的吸附点位结合而吸着于土壤颗粒表面;分配理论则认为有机物在水溶液和土壤有机质之间进行分配。当有机质胶体浓度较高时,其会通过物理和化学作用降低土壤介质表面有效点位,促进有机污染物释放进入地下水并随之运移[36],而胶体浓度较低时,会与有机污染物(如菲)发生共吸附,促进土壤对污染物的吸附作用。胶体促进介质中有机质的溶出,使得介质表面有效吸附点位减少,随着胶体浓度增加抑制污染物吸附作用明显。在地下环境中,若忽略了胶体对有机污染物迁移能力的影响,污染物的污染风险极可能被低估[37]。
对于地下水环境中存在的BTEX、卤代烷烃等有机污染物,CHCl3等消毒剂副产物在地下水中的迁移转化作用不仅受到场地介质的孔隙度大小、有机质含量等以及地下水化学及动力学条件、地层性质、地质构造等的影响,还受其本身的理化性质影响;介质的吸附作用与DBPs的种类有关,研究表明,其对三氯甲烷的吸附能力最强,四氯甲烷的吸附能力最弱,含溴消毒剂副产物更容易被吸附。此外,芳香烃和卤代烷烃等疏水性有机物的吸附过程受到有机物中的含碳量的影响,土壤中的TOC含量、有机污染物以及沉积物的理化性质等对三氯乙烯等在包气带土壤介质中的吸附作用造成影响[38],对于THMs,其受到介质的吸附作用强度受到砂柱的长度以及流速大小的影响,砂柱越长、流速越快,吸附作用越弱[39]。
胶体对污染物的迁移转化机制受到水化学条件的影响。pH较高条件下,胶体易进入含水层裂隙,促进污染物的运移[40];且pH通过改变胶体表面所带电荷的电性影响胶体对污染物的吸附能力,pH升高至中性或碱性时,有机胶体迁移加快,进而影响多环芳烃的迁移。此外离子强度、有机质含量、温度等环境因素也会对THMs的吸附造成影响[41-42]。
有关消毒剂副产物在地下水环境中迁移过程中受吸附作用影响的相关研究,主要集中在THMs组分上,针对近年来新增发现的含氮、溴等更具毒性的消毒剂副产物的吸附作用相关研究较为匮乏,而由于城市绿化、农用施肥等途径使得地下环境中N的存在是普遍的。后续应加强相关的吸附作用研究。
3.2.4 降解作用 地下水环境中,消毒剂副产物的降解过程包括生物和非生物降解。以THMs为例,其水解过程包括脱氢卤化作用和取代作用,仅在碱性条件下催化发生,且水解速率极慢,半衰期至少为1850年[43]。由于THMs本身为其他消毒剂副产物水解作用的产物,故相比较于因吸附作用和生物降解作用而减少的部分来说,其因水解、光解作用所衰减部分极少。
在拉斯维加斯的有氧含水层系统中,THMs不易发生生物降解作用[22,42];而在同样处于有氧条件下的奥克里克和孟菲斯试验场中却存在生物降解作用,这表明,THMs的生物降解作用需要特定的降解微生物和适宜的浓度条件[44]。在好氧条件下,表达单加氧酶的细菌会氧化三氯甲烷,生成COCl2随后通过水解生成HCl和CO2[45],在土壤中协同代谢降解三卤甲烷[46]。铁元素存在时,在产甲烷菌作用下,三氯甲烷可以发生厌氧脱氯过程[47]。一般地,高效的还原脱氯作用需要大量的电子受体,而含水层介质中溶解性有机碳含量较低,使得微生物降解作用不明显。
在有氧环境下,HAAs也存在生物降解作用,singer等研究显示,由于原位微生物的氧化作用,在地下水储存过程中,HAAs浓度降低[48],且HAAs的生物降解速率与卤素原子数量呈负相关趋势[49]。此外,有机质含量、酸碱度、温度等环境因素通过控制微生物活性进而影响DBPs的降解作用[50]。
综合上述分析可得,当利用消毒剂对周围环境和介质(如大气、土壤、水体、人畜等)进行消毒处理时,消毒剂会在地表聚集。伴随降雨或地表径流进行迁移,通过孔隙、裂隙、河底、河流-地下水水力边界、植物根系等进入地下水环境中。在包气带中,水固气多界面共存,且含有许多动植物残骸,富集大量微生物,在农业种植区还存在大量的有机肥料,提供大量的前体有机物,消毒剂与有机物的接触较地表水体更甚,极易与土壤中复含的腐殖质再次生成消毒剂副产物[41],继续向下传输,进入饱水带。消毒剂副产物进入饱水带后,通过发生对流、弥散、吸附-解吸、生物降解等反应,一部分经生物降解、自然衰减、水解等作用降解消亡,一部分不具有挥发性、难降解物质则顺着地下水开采又返回地表被人们利用。由于消毒剂副产物属微量有机污染物,较难处理去除,可通过各种途径进入人体。
4 结论与展望
综上所述,过度消毒水体中的消毒剂副产物成分复杂,生物毒性较大。目前研究主要集中于饮用水源(自来水厂)、水产养殖等地表水体中的消毒剂副产物成分研究,对于过度消毒对地下水环境所产生的影响,以及消毒剂副产物在地下水环境中的行为归宿研究鲜有报道。而消毒剂副产物在地下水环境的行为过程较为复杂,是耦合了“形成+对流+弥散+吸附+降解”的多机制作用过程,简单的控制消毒剂浓度阈值已不足以保障地下水环境质量安全。通过对目前已有相关研究的最新综述,提出以下相关结论与建议。
(1)消毒剂副产物的种类分析已有一定的研究进展,但主要还是集中于常见的氯化消毒及常见的三卤甲烷和卤乙酸。然而,消毒方式多样化,部分含量不高(不常见)消毒剂副产物的生物毒性反而较大。所以针对组合消毒,以及消毒剂副产物种类的研究有一定的必要性。
(2)现阶段,关于消毒剂副产物的生成作用研究集中在地表水体、实验室环境下。而过度消毒所产生的残余消毒剂进入地下环境后,其环境因素复杂多变,与实验室、地表水体差异性均较大。因此,开展地下水环境中消毒剂副产物的生成作用研究具有实际意义。
(3)有关消毒剂副产物在地下水环境中的迁移转化研究仍较为欠缺。研究消毒剂副产物在地下水环境中的迁移转化行为,深入考虑多种因素对消毒剂副产物在地下水环境中迁移转化的综合作用影响,结合地下水中消毒剂副产物的浓度限值,明确在不同水文地质、水文地球化学条件下的消毒剂投加阈值,为消毒剂的安全使用具有实际价值。
