泡菜母水细菌群落组成及潜在基因功能分析
2022-12-20李政强邓巍安睿张发李静超杨晓燕
李政强,邓巍,安睿,张发,李静超,杨晓燕,3,4*
(1.大理大学 东喜玛拉雅研究院,云南 大理 671003;2.云南省高校洱海流域保护与可持续发展研究重点实验室,云南 大理 671003;3.三江并流区域生物多样性保护与利用云南省创新团队,云南 大理 671003;4.中国三江并流区域生物多样性协同创新中心,云南 大理 671003)
泡菜是一种具有独特风味和口感的传统发酵食品,在中国已有三千多年的历史[1]。泡菜的营养价值极高,含有大量的维生素、矿物质、膳食纤维和其他功能成分,在满足人体营养需求的同时,还具有调节肠道菌群、降低血清胆固醇、抗氧化和减肥等功能[2-4]。研究发现,泡菜微生物来源于添加的物质及缸体本身,其中的微生物群落组成不仅影响泡菜的品质,也会影响泡菜风味[5]。母水发酵能较好地保证泡菜的原汁原味。
母水发酵是我国私房泡菜的主要制作方法之一,也是四川泡菜特色工艺[1]。将泡菜添加到母水中可增强泡菜中微生物群落稳定性并保持其原有风味,这是母水发酵制作泡菜的优势,母水中的微生物种群结构复杂,生物数量巨大,且在整个储存过程中并不是一成不变的[6]。泡菜母水的发酵环境是由微生物主导形成的高盐、高酸、缺氧的极端生境,这样的生境抑制了对这些环境因子敏感的微生物的生长繁殖,使得一些在pH值中性、氧浓度正常、无较多重金属离子的正常生境中生物量极小的微生物得以大量生长,成为泡菜母水中的优势物种,造就了泡菜独特的微生物群落[7-8]。随着人类对微生物了解的加深,人类对功能微生物的需求日益增加,因此人类开始探索各种生境中的微生物多样性,以期获得更多更高效的功能菌株,其中以特殊生境造就的特殊微生物群落及其所含特殊的功能基因最受关注。目前从特殊生境中已经分离获得了很多功能性菌株和特殊代谢物,如:Saiki等[9]从温泉中发现的广泛用于分子生物学研究的TaqDNA聚合酶;Connor等[10]从海洋中获得的有显著抗肿瘤活性的化合物;丁壮等[11]从极地中获得的有抑菌活性的代谢产物等。
细菌是泡菜母水中微生物群落的主要类群,主导着泡菜的发酵过程和货架期[12],因此,解析泡菜母水中细菌的群落结构变化及功能基因是泡菜资源开发的关键。鉴于目前可培养的微生物仅占所有微生物的1.5%[13],而泡菜母水细菌群落组成复杂,要全面了解泡菜中真实的微生物群落构成及可能的功能基因,需持续进行样品采集并借助现代分子生物学方法进行分析。扩增子测序变体(amplicon sequence variants,ASVs)是高通量测序技术的一种,利用二代测序平台,对16s功能基因等特定区段PCR产物进行高通量测序,突破传统微生物不可培养的缺点,获得环境样本中的微生物群落结构、进化关系以及微生物与环境相关性等信息。研究发现泡菜母水发酵后贮藏以第1天、第8天和第30天为节点,其中的细菌群落构成发生明显变化,包括母水的环境条件也发生阶段性的变化[14]。因此,本研究采用扩增子测序技术,探究泡菜母水在25℃的环境下,密闭储存1、8、30 d的细菌群落结构组成,了解泡菜母水中的细菌多样性和功能基因多样性,为微生物学的功能物种筛选和功能基因挖掘提供新的思路。
1 材料与方法
1.1 材料与试剂
白萝卜(Raphanus sativus)、卷心菜(Brassica oleracea L)、辣椒(Capsicum frutescens)、生姜(Zingiber officinale Roscoe)、花椒(Zanthoxylum bungeanum Maxim)、冰糖:市售;DNA抽提试剂盒:美国Omega Bio-Tek公司;2%琼脂糖:西班牙biowest公司;DNA聚合酶:中国北京全式金生物技术有限公司;DNA精确扩增试剂盒:美国Axygen公司;DNA文库制备试剂盒:美国Illumina公司。
1.2 仪器与设备
NanoDrop2000超微量分光光度计:美国Thermo Fisher Scientific公司;DYY-6C电泳仪:北京市六一仪器厂;ABI GeneAmp9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国 ABI公司;Illumina Miseq测序仪:美国Illumina公司。
1.3 方法
1.3.1 泡菜母水制备
将5kg白萝卜、5kg卷心菜、0.5kg辣椒、0.5kg生姜、0.5 kg花椒、1.5 kg冰糖、20 kg冷开水(含有 6%NaCl)装入陶制泡菜坛中。18℃~22℃自然发酵7 d后,用无菌纱布滤去泡菜,混匀后获得20 kg泡菜母水,室温静置24 h。将泡菜母水分装至1 000 mL玻璃瓶中密封,25℃下进行培养。在培养的第1天、第8天及第30天进行取样,每次取3个平行,分别标记为PC1.1、PC1.2、PC1.3、PC8.1、PC8.2、PC8.3、PC30.1、PC30.2、PC30.3。
1.3.2 样品处理与采集
取样时,将每个培养瓶混匀后用无菌注射器吸取50 mL泡菜母水于离心管中,8 000 r/min离心10 min,弃上清,沉淀置于-80℃冰箱储存。
1.3.3 DNA的提取和PCR扩增
根据DNA提取试剂盒说明书进行总DNA抽提。DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量[15];用338F(5'-ACTCCTACGGGAGGCAGCAG-3') 和 806R(5'-GGACTACHVGGGTWTCTAAT-3')引物对16s的V3-V4可变区进行PCR扩增。扩增程序为:95℃预变性3min,27个循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),最后 72 ℃延伸 10 min[16]。
1.3.4 生物信息学分析
采用QIIME2[17]进行序列的质控,修剪,去噪,拼接,以及去除嵌合体;使用GREENGENES[18]数据库得到物种的分类信息表;用QIIME2 core-diversity[19]插件计算多样性矩阵、特征序列水平alpha多样性指数,包括Richness指数、Shannon指数、Gini-Simpson指数。应用PICRUSt[20]软件进行基因功能的预测。稀释曲线的绘制、群落物种丰度堆积图均使用R语言绘制。
2 结果与分析
2.1 高通量测序文库评价
对样品采用Illumina NovaSeq高通量测序后共获得627 866条有效序列,对原始数据进行整理、去噪、去除嵌合体、抽平后,获得405 990条优化序列。泡菜母水样品稀释曲线见图1。
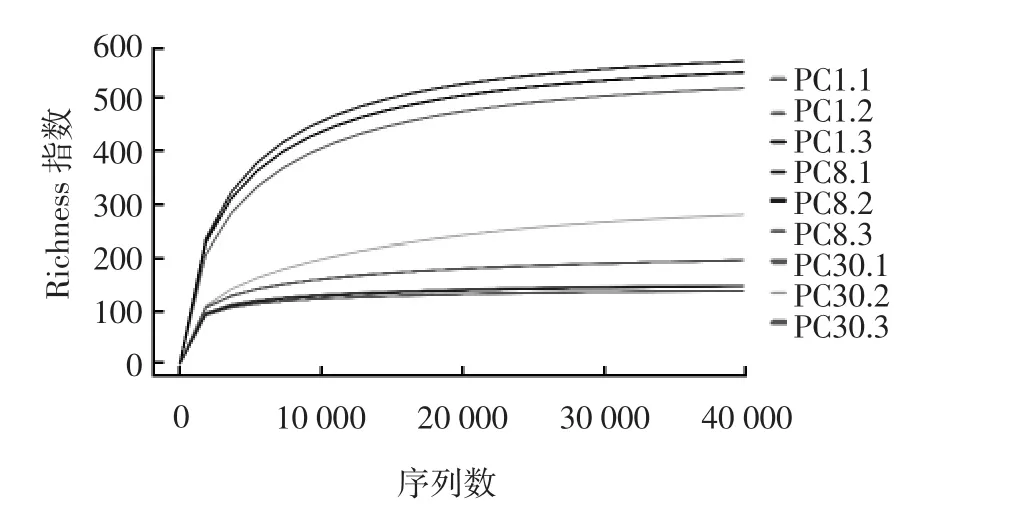
图1 稀释曲线Fig.1 Rarefaction curve
由图1可知,泡菜母水样品PC1.1、PC1.2、PC1.3、PC8.1、PC8.2、PC8.3、PC30.1、PC30.2、PC30.3 的稀释曲线较为平坦,更深的测序几乎不会检出更多新的物种,测序结果较为合理可用于后续分析。
2.2 细菌alpha多样性
泡菜母水中细菌alpha多样性见表1。
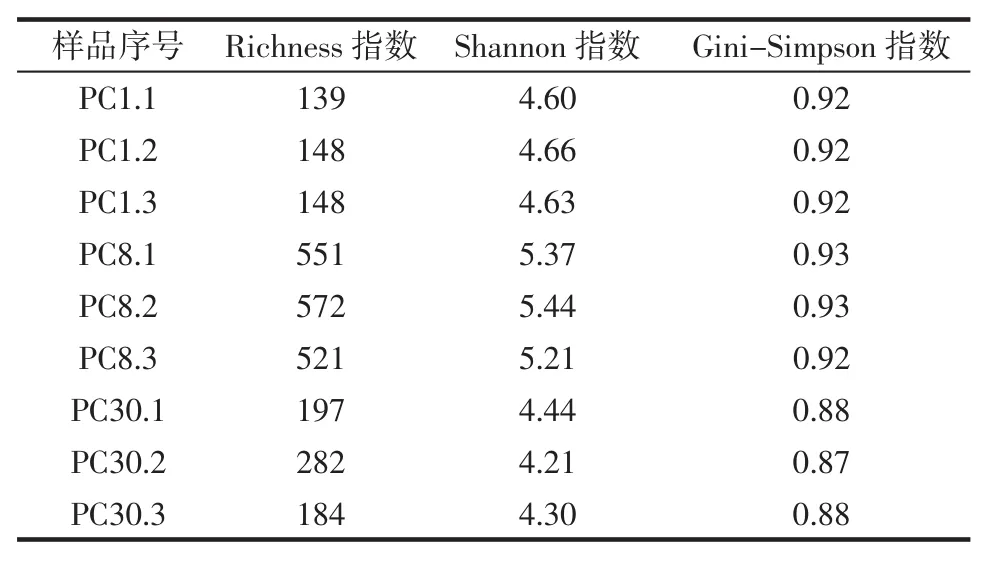
表1 泡菜母水中细菌Alpha多样性Table 1 Alpha-diversity of bacterial in Paocai brine
Alpha多样性反映样品内部微生物群落的物种丰富度。由表1可知,Richness指数第8天最高,第30天次之、第1天最低;Shannon指数、Gini-Simpson指数均为第8天最高,第1天次之,第30天最低。这说明在25℃的环境下,密闭储存1、8、30 d的细菌群落结构复杂,发生持续性的变化,其中第8天的细菌多样性最高且组成最复杂。
2.3 细菌门和属水平群落结构动态变化
不同发酵时间泡菜母水中细菌群落在门和属水平上的组成见图2。
由图2可知,经过有效序列进行质控、拼接和优化,总共获得细菌20门、33纲、79目、92科、320属、388种。在门水平上,泡菜母水中细菌群落以厚壁菌门(Firmicutes,47.55%~52.96%)和变形菌门(Proteobacteria,45.68%~52.17%)为优势门,且在不同时间点的含量无明显差异;其余菌门占比较小(总含量<1%)。
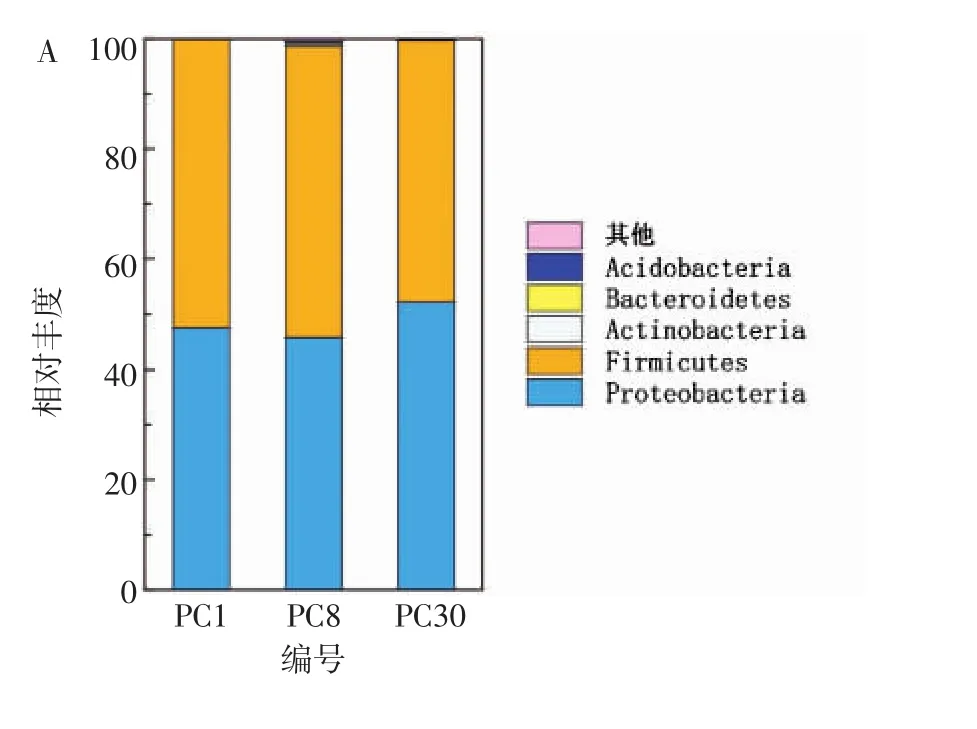
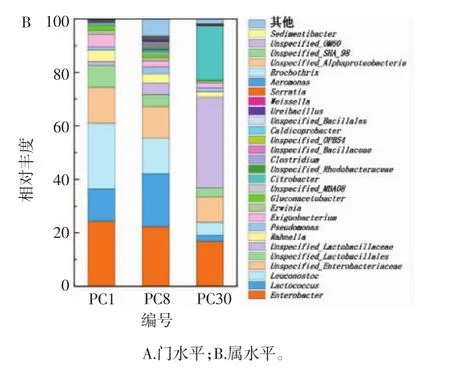
图2 不同发酵时间泡菜母水中细菌群落在门和属水平上的组成Fig.2 Composition of bacterial community at phylum and genus level in Paocai brine at different fermentation time
在属水平上的菌群组成:肠杆菌属(Enterobacter)在第1天、第8天、第30天的含量分别为23.77%~25.23%、19.80%~23.63%、14.06%~18.29%;乳球菌属(Lactococcus)含量分别为 10.39%~13.64%、18.30%~20.86%、2.14%~2.61%;明串珠菌属(Leuconostoc)含量分别为22.53%~25.85%、9.67%~16.51%、4.22%~5.42%;未分类的肠杆菌属(Unspecified_Enterobacteriaceae)含量分别为 13.20%~13.83%、10.47%~12.45%、8.75%~9.95%;未分类的乳杆菌属(Unspecified_Lactobacillales)含量分别为7.25%~9.58%、3.79%~5.27%、2.98%~4.20%;未分类的乳酸杆菌属(Unspecified_Lactobacillaceae)含量分别为1.14%~1.66%、3.45%~5.99%、31.52%~38.10%。随着发酵时间的延长,泡菜母水中细菌的群落组成随之发生改变。
不同发酵时间泡菜母水中细菌群落在属分类水平上的组成见图3。

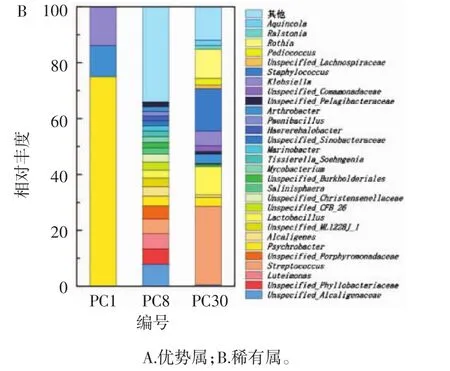
图3 不同发酵时间泡菜母水中细菌群落在属分类水平上的组成Fig.3 Composition of bacterial community in Paocai brine of different fermentation time at genus classification level
由图3可知,泡菜母水中细菌群落的优势属(在体系中含量>1%)为肠杆菌属(Enterobacter)、明串珠菌属(Leuconostoc)、未分类的肠杆菌属(Unspecified_Enterobacteriaceae)、乳球菌属(Lactococcus)、柠檬酸杆菌属(Citrobacter)、未分类的乳杆菌属(Unspecified_Lactobacillales)、未分类的乳杆菌属(Unspecified_Lactobacillaceae)、拉恩氏菌属(Rahnella)。但在不同储存时间的含量存在差异,虽然不同储存时长的泡菜母水中的细菌群落结构不同,但优势细菌属的组成却是基本一致的,这与朱琳等[21]和李恒等[1]的研究结果相似。说明尽管不同地区的泡菜发酵方式不同、原料不同,但泡菜母水中的细菌优势群落构成却是相似的,主导泡菜发酵的优势细菌也相似。目前对泡菜中细菌群落组成的研究报道不少,对泡菜资源的开发也有较多研究[22-23],但关注点主要在优势菌群的变化及其功能上,而优势菌群的变化往往会掩盖稀有类群的动态变化[24]。本研究发现稀有属细菌(在体系中含量<0.01%)在不同储存时间的变化剧烈,无统一规律,其在泡菜母水群落变化中可能发挥着非常重要的功能,这或许意味着低丰度群落在维持生态系统健康方面具有重要作用和意义[25-26]。
未分类的细菌占比见图4。
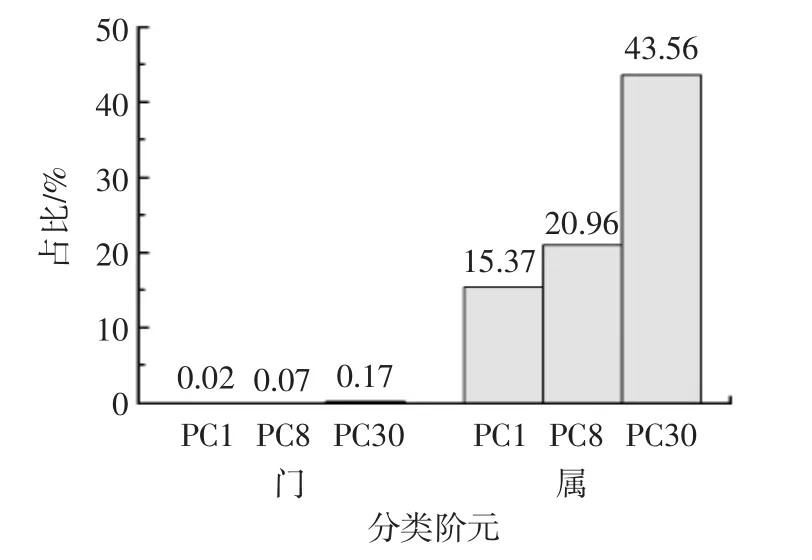
图4 未分类出的细菌占比Fig.4 Proportion of bacteria unspecified
由图4可知,有1门89属细菌未分类。其中,第1天未能分类的有1门2属,在其所处水平上所占比例分别为门水平0.02%、属水平15.37%;第8天未能分类的有1门89属,在其所处水平上占比为门水平0.07%、属水平20.96%;第30天未能分类的有1门23属,在其所处水平上占比为门水平0.17%、属水平43.56%。说明随着发酵时间的延长,对泡菜母水中细菌的认知度越低,潜藏的未开发资源也越多,其中未开发资源更多地集中于长时间发酵的泡菜母水中。
2.4 细菌基因功能预测
微生物资源开发的关注点多在于功能菌株的挖掘,目前关注较多的是温泉等特殊生境[27]中分布的微生物。泡菜体系中存在极其多样且特殊的微生物类群[28],其中必然蕴藏了独特的功能基因,通过高通量测序可以实现免培养下的功能基因预测。本研究发现泡菜母水中细菌的功能基因类型在L1级(即在PICRUSt分析时选择L1级别即对基因序列对应功能大类的分析)可初步划分为6种类型,结果见图5。
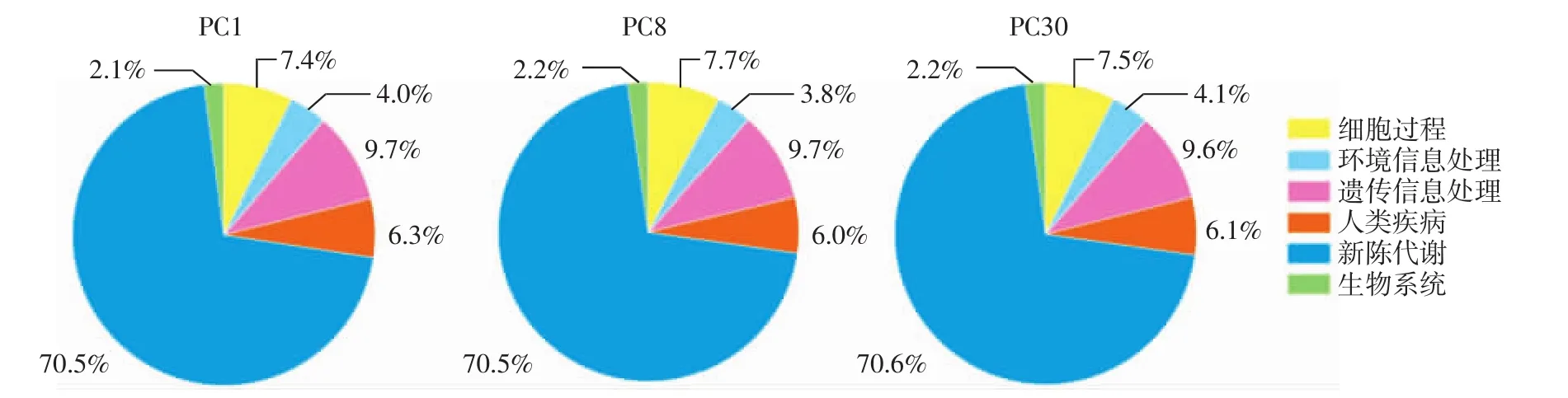
图5 L1级水平上不同发酵时间泡菜母水中细菌群落功能预测Fig.5 Prediction of bacterial community function in Paocai brine of different fermentation time at L1 level
由图5可知,新陈代谢相关的基因含量最多(70.43%~70.74%),其次是与遗传信息(9.39%~9.97%)、细胞转化(7.00%~7.87%)、致病(5.97%~6.27%)、环境信息处理(3.75%~4.27%)和有机系统(2.09%~2.24%)等相关的基因。
在L3级(即在PICRUSt分析时选择L3级别即基因序列对应具体功能的分析)进行功能预测,共分析出364种不同的功能基因,且不同发酵时间的泡菜母水中所蕴含的细菌基因功能类型均相同,仅含量出现波动,结果见图6。
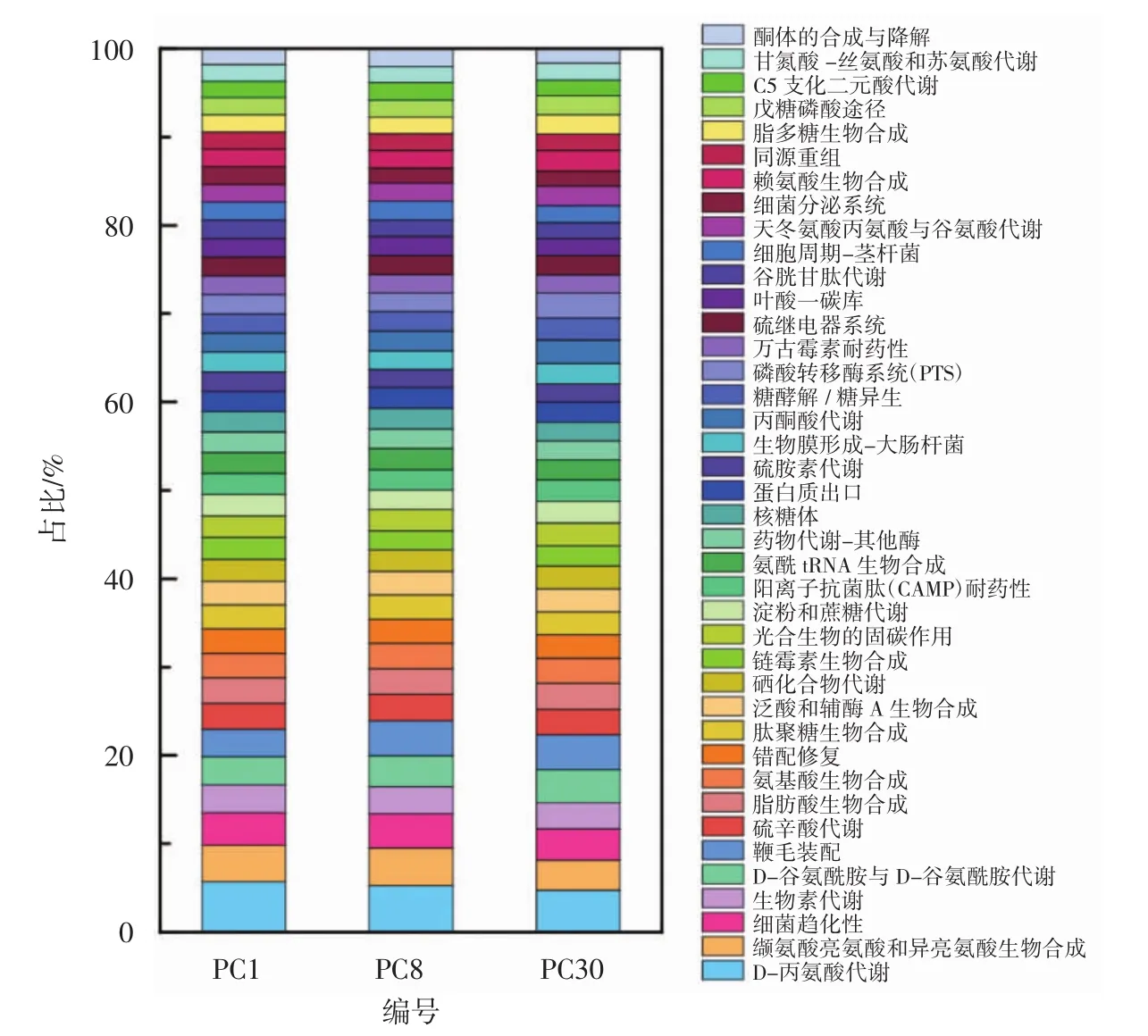
图6 L3级水平上不同发酵时间泡菜母水中细菌群落功能预测(TOP 40)Fig.6 Prediction of bacterial community function in Paocai brine of different fermentation time at L3 Level(TOP 40)
由图6可知,泡菜母水所蕴含的基因中除已知的有关促消化、维持肠道菌群平衡等功能基因外,还有与新陈代谢相关的基因,其次为与遗传信息的处理、细胞转化、致病等相关的基因。致病基因主要与癌症、食物毒素相关,蔡炯等[29]也发现正常发酵泡菜中都含有一定量的致病微生物,虽然致病基因在体系中存在不一定就能引起疾病,但仍然需要关注这些微生物可能引起的食品安全问题。同时,泡菜母水中细菌含有较多的与产维生素、产抗生素、促细胞吸收、癌症的胆碱代谢等相关的基因。有关泡菜体系中细菌的研究不仅需要关注与人类疾病的治疗、预防相关的功能基因,与此有关联的功能菌株的开发也是非常有必要的。
3 结论
泡菜母水是一个高盐、高酸、厌氧、寡营养的特殊生境,特殊生境孕育了独特的微生物群落[30],且会随储存、发酵过程的变化而发生改变[31]。本研究发现,肠杆菌属、明串珠菌属、未分类的肠杆菌属、乳球菌属、柠檬酸杆菌属、未分类的乳杆菌属、未分类的乳酸杆菌属、拉恩氏菌属是泡菜母水中的优势菌属。在整个泡菜母水的菌群构成中,稀有菌属在泡菜母水群落变化中可能发挥着非常重要的功能。未分类的细菌的占比较大,基因功能划分与预测也说明了泡菜微生物体系中仍有较多未被开发的细菌种质资源,在新型代谢产物研发、人类疾病预防、益生菌菌株开发等方面具有较大的开发潜力,是一个很好的微生物资源库。因此,未来应当重视对泡菜母水中未开发的微生物资源尤其是稀有类群的研究。但即使应用有较高分辨率的高通量测序技术,其存在的局限性仍然非常大。未来对泡菜可开发资源的探究需要结合宏基因组、宏代谢组和宏蛋白组学,进一步探究泡菜微生物可能蕴藏的功能基因,获取到这些基因的功能,或许就能为泡菜功能的开发提供线索。同时,对功能基因进行开发需要结合纯培养技术,因此,需要加强对泡菜微生物的分离培养技术研究,丰富泡菜微生物菌种资源库及基因库,以支持泡菜微生物的开发和应用研究。