多模态MRI在脑胶质瘤术前鉴别诊断中的应用价值分析
2022-12-19侯振华
侯振华
阜新市中心医院放射科 (辽宁 阜新 123000)
据统计,胶质瘤占原发颅内肿瘤的30~40%左右[1]。胶质瘤浸润生长,不易与正常组织区分开,手术后也难以彻底切除,早期诊断是患者预后改善的关键所在。磁共振成像检查在颅内胶质瘤的诊断和术前分级中具有重要作用,具有多参数、多序列成像特征,然而以往主要根据磁共振成像(MRI)特征来诊断,但有些胶质瘤与其他肿瘤类型影像表现较为相似,且肿瘤的范围、边界、内部情况评价较为困难[2-3]。近年来,大量新兴技术出现,使得颅内胶质瘤磁MRI评估敏感性、特异性大幅度增加,通过多模态综合分析和交叉验证,准确揭示脑胶质瘤病理过程[4]。本研究分析多模态MRI在脑胶质瘤术前鉴别诊断价值,旨在为临床疾病诊断和治疗提供参考,报告如下。
1 资料与方法
1.1 一般资料回顾性分析本院2017年2月至2019年9月本院55例手术及病理学证实为脑胶质瘤的患者临床资料,其中男31例,女24例;年龄41~77岁,平均(56.88±9.35)岁,按中枢神经系统肿瘤分类标准,分为低级别组27 例(Ⅰ级3例,Ⅱ级24例),高级别组28例(Ⅲ 级21 例,Ⅳ级7例)。
纳入标准:经手术及病理检查确诊为脑胶质瘤;接受多模态MRI扫描检查;术前为进行化疗、放疗以及其它抗肿瘤性治疗;图像质量佳;临床资料完整。排除标准:合并严重脑外伤史;既往脑部手术史;存在血管畸形或合并颅内占位疾病;颅内压严重升高或脑疝;合并严重精神疾病患者;脑胶质瘤治疗后复发患者;合并幽闭恐惧症者;造影剂过敏者。
1.2 检查方法
1.2.1 常规MRI检查 仰卧位,上肢置身侧制动,头先进,应用 GE Signa HD 3.0T磁共振全身扫描仪进行扫描,头颅8通道相控阵线圈。T1FLAIR参数:TR、TE分别为2000ms、21ms,矩阵312×197;FSE-T2WI参数:TE分别为4400ms、90ms,矩阵256×256;T2FLAIR参数:TR、TE分别为9000ms、140ms,FOV22cm×22cm。增强扫描经肘静脉注射Gd-DTPA(0.1mmol/kg),之后加注生理盐水15mL,扫描层厚为5.0mm,层距为1.5mm,层数为20,激励次数为1次(NEX=1)。
1.2.2 功能MRI成像相关方法及参数 采用动脉自旋标记技术(Arterial spin labeling,ASL),TR、TE、TI分别为4748ms、14.6ms、1525ms,采集两次,扫描5min。扩散张量成像(Diffusion tensor imaging,DTI)采用单次激发自旋回波-回波平面成像,不同方向施加扩散敏感梯度,TR、TE分别为9000ms、102ms矩阵128×128,FOV:22cm×22cm,NEX=1,b值=1000s/mm2,层厚4mm。
1.3 图像处理与数据分析将DTI图像传至 ADW4.2,每个部位选择3个感兴趣区,计算肿瘤瘤体部分FA值、ADC值。数据导入GE AW 4.2,选取实性部分最大层面,绘制感兴趣区,得到瘤体血流量、正常白质血流量(TBF、BFWM)。
1.4 脑白质纤维束评价标准[5](1)推移:与对侧正常纤维束相比,纤维束只存在移位;(2)浸润:与对侧正常纤维束相比,部分纤维束出现中断,且较为稀疏;(3)破坏:纤维束出现连续性的中断。
1.5 手术病理学检查标本以福尔马林固定,石蜡包埋,切片,HE染色光镜观察,确定脑胶质瘤的低级别和高级别。
1.6 统计学方法利用 SPSS 20.0 ,计量资料组间比较行t检验;等级资料采用例数表示,行秩和检验;绘制受试者工作特征曲线确定诊断价值,P<0.05表示差异有统计学意义。
2 结 果
2.1 MRI-ASL扫描技术在脑胶质瘤中的应用低级别病变区域为低灌注,高级别多为高灌注,高级别组TBF、rTBF值高于低级别组(P<0.05),见表1。

表1 MRI-ASL扫描技术在脑胶质瘤中的血流灌注值比较
2.2 MRI-DTI扫描技术在脑胶质瘤中的应用低级别瘤实性部分ADC图高信号,FA图低信号;高级别瘤实性部分ADC图等或高信号,FA图低信号。高级别瘤实质部分rMDt、rADt、rRDt、λ1t、λ2t、λ3t低于低级别瘤(P<0.05),见表2。
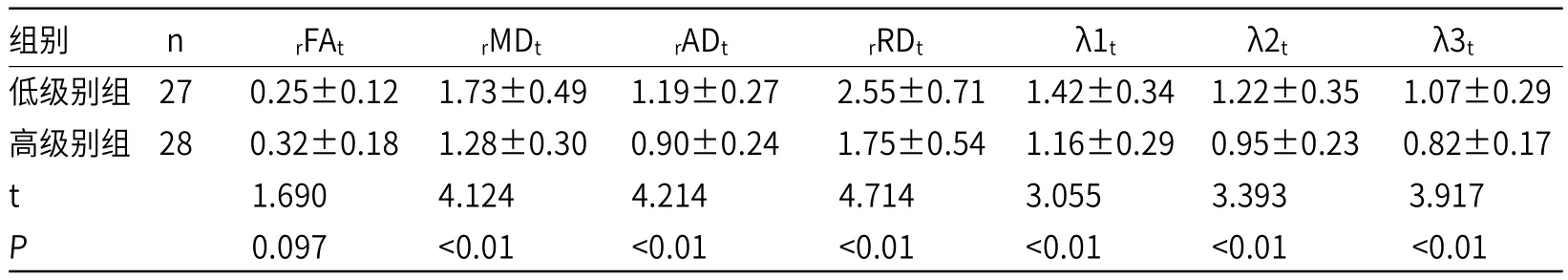
表2 MRI-DTI扫描技术在脑胶质瘤中肿瘤实质区DTI参数比较
2.3 胶质瘤白质纤维束(DTT)特征低级别组中DTT表现推移10例,浸润14例,破坏3例;高级别组DTT表现推移0例,浸润17例,破坏11例。胶质瘤级别越高,纤维束侵润和破坏的程度则越严重,低级别与高级别胶质瘤纤维束形态比较差异有统计学意义(P<0.05),见表3。

表3 高级别与低级别胶质瘤DTT状态差异
2.4 MRI-ASL与MRI-DTI扫描技术诊断价值MRI-ASL与MRI-DTI扫描技术ROC联合诊断下AUC=0.944高于各参数TBF、rTBF、rMDt、rADt、rRDt、λ1t、λ2t、λ3t,ROC诊断下AUC=0.771、0.770、0.778、0.758、0.767、0.685、0.778、0.788(P<0.05),见表4,图1~图3。

图1 MRI-ASL扫描技术。图2 MRI-DTI扫描技术。图3 联合检测价值。
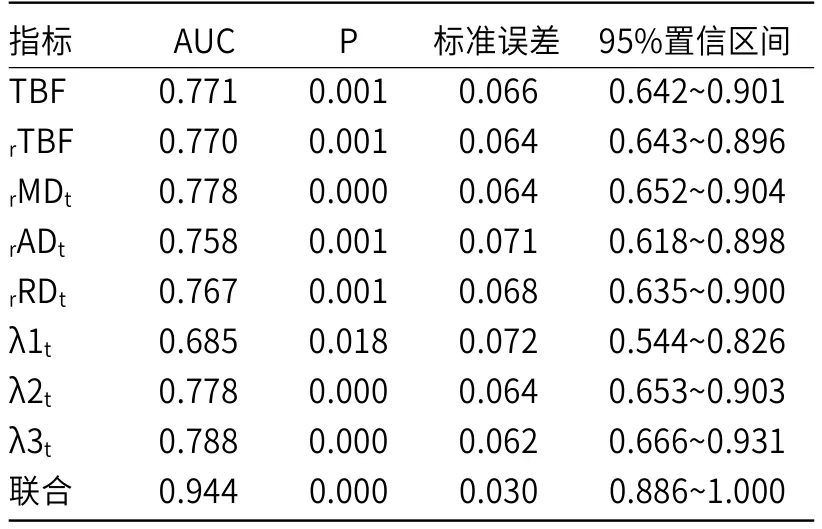
表4 MRI-ASL与MRI-DTI扫描技术诊断价值
3 讨 论
临床上,对于胶质瘤通常采用手术为主,结合化放疗等综合治疗[6]。手术的根本目的和原则在于最大程度和范围将肿瘤切除,并有效明确肿瘤病理性质,有效缓解临床症状的同时,为后续放化疗提供条件,延长患者生存时间[7]。
作为颅内最常见肿瘤病变类型,脑胶质瘤早期诊断并确定病理分级,对选择治疗方案,改善患者预后具有重要价值[8]。临床上多以常规MRI检查作为颅内肿瘤评估手段,依照肿瘤形态、强化程度、信号特点等进行判断,但其对于胶质瘤分级评估的敏感度并不高。任彦等[9]研究表明,常规MRI扫描诊断脑胶质瘤的敏感性仅为55.1%~83.3%,且尤其是对于分级相近胶质瘤的区分较为困难,如Ⅱ级、Ⅲ级胶质瘤。肿瘤生长和新生血管形成息息相关,血管形成对于肿瘤营养物质供应具有重要价值,因为周围新生微血管评估也是肿瘤检测重点之一。ASL通过氢质子标记,使其弛豫翻转,以标记、非标记像差值得到灌注信息[10]。DTI反映白质水分子扩散方向,相关的指标主要有ADC和FA,ADC反映细胞外间隙;FA反映神经纤维结构完整度[11]。颅内肿瘤发生时,瘤细胞浸润、水肿等均可改变脑组织、白质纤维束中水分子的扩散能力。
本研究中,低、高级别胶质瘤灌注存在明显差异,高级别组TBF、rTBF值高于低级别组,ASL诊断敏感度、特异度较高,与林坤等[12]研究结果一致。ASL可定量评估肿瘤血管生成并反映其血流动力学,评估其恶性级别。DTI常用 FA评估白质改变,λ1、λ2、λ3反映扩散幅度,反映肿瘤内部的不均质性,在胶质瘤分级中具有重要价值[13]。本研究中高级别瘤实质部分rMDt、rADt、rRDt以及λ1t、λ2t、λ3t低于低级别瘤,这可能是由于胶质瘤分级与肿瘤细胞数目和密度呈现正相关,肿瘤级别增加时,多核、巨核细胞比例随之增加,瘤体水分子扩散能力进一步加强,在这其中高级别瘤受到的影响往往更大[14]。本研究分析TBF、rTBF、rMDt、rADt和λ1t、λ2t、λ3tROC诊断对比低级别和高级别瘤下AUC=0.771、0.770、0.778、0.758、0.767、0.685、0.778、0.788,且上述参数联合诊断下AUC达到了0.944。DTI在一定程度上反映脑白质纤维束方向,显示病变对其产生的影响。本研究显示,低级别瘤周围纤维束多较为稀疏,且呈现推移状态,表现为轻度侵润,破坏较少;高级别瘤多表现为侵润状态且被破坏中断,恶性程度越高,纤维束破坏越严重,查昳琳等[15]研究结果支持本结论。
综上所述,多模态MRI脑胶质瘤诊断和分级的有效影像学技术,多模态、多参数的MRI技术可从分子影像学角度进行临床诊断,在血流动力学水平指导临床诊断和治疗。
