新生儿缺氧缺血性脑病超声、MRI表现及诊断价值研究
2022-12-19张梦华王光珍
张梦华 王光珍 许 涛
1.廊坊市人民医院超声科(河北 廊坊 065000)
2.廊坊市人民医院放射诊断科(河北 廊坊 065000)
新生儿缺氧缺血性脑病(HIE)指围产期新生儿缺氧窒息所致的脑缺氧缺血性损害,可引起一系列脑神经病理改变,部分患儿常遗留有神经系统后遗症[1]。在国内,HIE发病率约占活产儿的6/1000,其中将近20%可导致新生儿死亡,而由此所致的神经系统伤残,在所有新生儿神经伤残中约占25%~28%[2]。因此,早期诊断、干预及预后评估尤为重要。影像学检查是反映脑病理改变的最直接手段。磁共振成像(MRI)、彩色多普勒超声能够很好地显示脑室形态及脑血流动力学参数等改变,且相比CT有着无辐射的优点,成为新生儿HIE检查的主要手段。本研究旨在探讨MRI、超声在新生儿HIE中的诊断价值,现报告如下。
1 资料与方法
1.1 一般资料选取2017年1月至2018年12月在我院临床确诊的HIE患儿62例,其中男37例,女25例;早产儿20例,足月儿42例;平均胎龄(38.6±1.7)周。入组患儿临床诊断均参照2005年全国新生儿会议制定的新生儿HIE诊断标准及分度标准[3],均排除先天代谢性疾病、胆红素脑病、先天性心脏病及有明显宫内感染病史者等。并同期选取健康新生儿30例作为对照组,其中男18例,女12例;胎龄(38.1±2.2)周,均不存在新生儿窒息、胎儿窘迫等相关疾病。所有患儿均于出生后24h内完成MRI及超声检查。本研究经伦理委员会批准,所有患儿监护人均对研究知情并签署知情同意书。
1.2 检查方法超声检查:采用飞利浦CX50彩色多普勒超声诊断仪及线阵探头(3.5~7.0MHz)。新生儿安静状态下,取仰卧位,经前囟依次行冠状、矢状位动态扫描,扫描范围由额叶至枕叶,行序列实时二维成像,储存图像。检测新生儿大脑前动脉(ACA)的收缩期峰值血流速度(Vs)、舒张末期血流速度(Vd)及阻力指数(RI)。
MRI检查:采用西门子Skyra 3.0T MRI扫描仪。检查前30min常规予以0.5mL/Kg 10%水合氯醛口服液镇静,于新生儿熟睡状态下进行检查。新生儿取仰卧位,头部先进,均行常规平扫及弥散加权成像(DWI)扫描。扫描序列及扫描参数:横断位及矢状位SE-T1WI(TR=642ms,TE=22ms)、横轴位FSE-T2WI(TR=6000ms,TE=108ms)、横轴位-扫描仪液体衰减翻转恢复序列(FLAIR)(TR=9000ms,TE=92ms)及横轴面DWI(TR=3200ms,TE=110ms,b=0.500s/mm2)。于ADC图上进行ROI勾画,分别将ROI置于豆状核、丘脑、额叶白质,测定各ROI的ADC值。
1.3 统计学处理使用SPSS 20.0进行数据处理。计量资料描述为(±s),多组间比较用F检验,两两比较用LSD-t检验;以双侧P<0.05为差异有统计学意义。
2 结 果
2.1 HIE组与对照组超声血流参数比较HIE组相比于对照组,Vs、Vd明显降低(P<0.05),RI明显升高(P<0.05);且随着HIE临床分度提高,Vs、Vd逐渐降低,RI逐渐升高,差异有统计学意义(P<0.05)。
2.2 HIE组与对照组各ROI的ADC值比较HIE组豆状核、丘脑、额叶白质的ADC值均明显低于对照组(P<0.05),且随着HIE临床分度提高,各ROI的ADC值均逐渐降低(P<0.05),见表2。
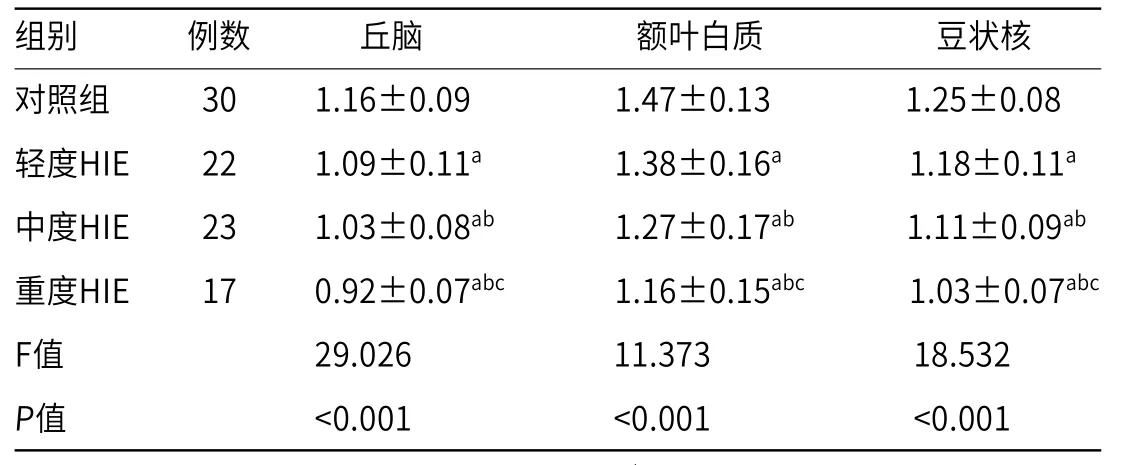
表2 HIE组与对照组各ROI的ADC值比较(×10-3mm2/s)
2.3 相关性分析Pearson相关分析显示,HIE组Vs、Vd及ADC值(以丘脑进行分析)均与临床分度呈负相关(r=-0.385,P<0.05),RI与临床分度呈正相关(r=0.412,P<0.05);同时HIE组Vs、Vd与丘脑ADC值呈正相关(r=0.376,P<0.05),RI与丘脑ADC值呈负相关(r=-0.393,P<0.05)。
2.4 HIE颅脑超声表现早期HIE主要表现为脑水肿及脉络丛出血,晚期则可有脑实质呈囊腔样改变、脑萎缩等表现。本组患儿,脑水肿25例,超声表现为脑实质弥漫性回声增强,回声不均匀(见图1A),CDFI显示24h内脑血流速度降低,频谱多普勒呈现低速高阻型(见图1B)。脉络丛出血12例,超声表现为脑室出现增宽,脉络丛形态不规则,两侧不对称,患侧增粗,并可伴随着强回声团。脑实质呈囊腔样改变12例,超声表现为脑室周边强白质回声,内部有多个大小不一的小囊腔;脑萎缩3例,特征表现为脑回皱缩、脑沟加深。
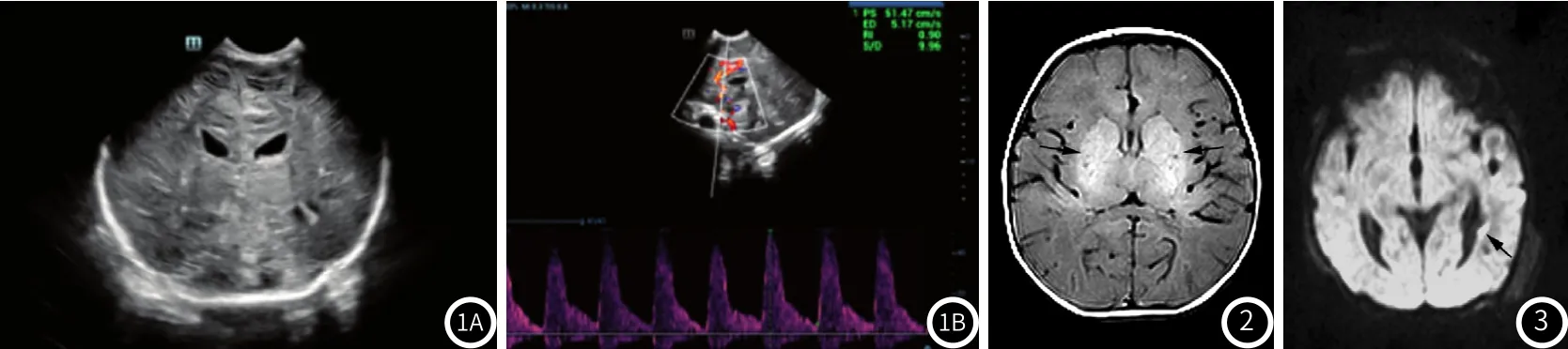
图1 患儿,男,重度HIE,超声检查显示脑实质弥漫性回声增强,回声不均匀,部分脑室质呈脑实质呈囊腔样改变(A);CDFI显示ACA血流减低,RI升高。图2 患儿,男,重度 HIE SE-T1WI显示双侧基底核区信号增强(如箭头所示),双额颞枕叶白质信号减低。图3 患儿,女,中度HIE DWI显示皮层下及脑室旁出血灶呈高低混合信号(如箭头所示)。

表1 HIE组与对照组超声参数比较
2.5 HIE的MRI表现轻中度HIE病变累及较局限,表现为局部脑沟变窄,病变区域灰白质分界模糊,多伴脑出血(见图2);重度HIE病变累及广泛,多表现为弥漫性脑肿胀、脑水肿(见图3),脑白质呈长T1长T2信号改变,脑沟变浅,灰白质分界消失。
3 讨 论
HIE是新生儿常见疾病,多由胎儿窒息或窘迫所致,以脑水肿、萎缩、坏死及脑出血等为主要病理改变[4]。新生儿因脑血流调节能力不健全,随着窒息时间延长,脑血流自我调节功能会逐渐丧失,HIE发生时,患儿脑血流会随着血压变化而出现被动调节,血压增高可引起脑血流过度灌注,从而导致脑水肿加重,甚至造成脑出血;而血压降低,则脑缺血缺氧加重,酸性代谢产物、自由基等产生增多,将导致缺氧缺血性脑损害,缺血缺氧会严重影响新生儿神经系统发育[5]。
HIE病变是一个渐进的演变过程,血流变化是其重要的病理生理基础,病变早期血管高度痉挛,脑血流调节以血管阻力改变为基础,收缩峰高尖时RI增高,血管阻力加大,这是由血管水肿、管腔狭窄闭塞所致。研究发现[6],HIE患儿脑血流量出现不同程度减低,认为这对于脑损伤发生有着关键作用,RI增高,脑血流降低,是重度缺氧缺血性脑损伤的重要标志。研究表明[7],RI>0.9时,HIE患儿病死率明显增高。本研究显示,HIE组相比对照组Vs、Vd均明显降低,RI明显增高,且随着临床分度提高,Vs、Vd逐渐降低,RI逐渐升高,表明超声脑血流参数对于HIE患儿脑损伤程度有重要评估价值。新生儿脑血管未发育完善,脑血流易出现较大波动,ACA对缺氧缺血损伤有着明显易感性,血流动力学微小改变可引起脑血流速度改变,因此通过超声获取血流参数能够很好反映脑血流变化,从而指导临床治疗及疗效评价。
MR-DWI能够从微观水平呈现水分子扩散情况,并以ADC值进行量化,ADC值越大,则说明水分子扩散度越高[8]。HIE脑血流改变及氧供减少,可引起一系列级联生化反应,导致脑细胞损伤,诱发细胞毒性水肿,使得细胞内水分子扩散受限。脑组织水分子扩散出现改变,DWI信号也会随之改变,扩散速度越快,DWI信号越低,相应的ADC值也越大;而扩散受限制时,DWI信号越高,相应的ADC值也越小[9]。本研究显示,HIE组豆状核、丘脑、额叶白质的ADC值均明显低于对照组,且随着HIE临床分度提高,各ROI的ADC值均逐渐降低;提示ADC值能够反映HIE的病理改变。进一步相关性分析显示,HIE组Vs、Vd与丘脑ADC值呈正相关,超声血流参数联合ADC值或许能够更好地反映缺氧缺血的病理改变;并且各超声血流参数及ADC值均于临床分期呈正相关,表明超声及MR-DWI均对于HIE患儿脑损伤程度及病变分期评估有重要价值。
综上所述,HIE患儿脑组织血流明显减低,脑组织水分子扩散受限。应用超声及MR-DWI技术能够很好地反映脑组织灌注情况及水分子弥散状态,对于HIE诊断、临床分度及疗效评价均有重要价值。
