涠洲岛海域球形棕囊藻藻华过程中营养盐及浮游植物群落组成分析
2022-12-17苏芯莹陈波牙韩争朱冬琳张荣灿覃仙玲
苏芯莹,陈波,牙韩争,朱冬琳,张荣灿,覃仙玲
(广西近海海洋环境科学重点实验室,广西科学院,南宁530007)
球形棕囊藻(Phaeocystis globosa)是近年来我国沿岸海域常见的藻华原因种,适温适盐范围广,在全球海域均有广泛分布[1]。球形棕囊藻存在群体与游离单细胞互相交替的异形生活史[2]。在发生藻华时,球形棕囊藻细胞以形成球状囊体为主。球形棕囊藻的生长及囊体的形成受到环境因素(营养盐,温度、盐度、光照等)的影响[3–6],浮游生物群落组成也可以影响棕囊藻的生长和囊体形成[7–10]。棕囊藻藻华的发生不仅会严重危害水体生态,其产生的溶血毒素及细胞毒素会导致鱼类等水产经济动物死亡,造成严重的经济损失,还会产生二甲基硫化物等有毒有害物质,严重危害沿岸海洋环境。此外,球形棕囊藻形成的巨大囊体可堵塞沿海核电厂冷却水过滤系统,从而对核电厂的安全运行构成威胁[7,11]。因此棕囊藻囊体的形成与调控机制,以及藻华暴发的原因是近年来的重要研究方向之一[2]。
自2010年以来,广西北部湾海域连续10 a 都发生以球形棕囊藻为主的藻华[12–13]。从报道中可见,球形棕囊藻藻华发生的范围几乎遍布整个湾区,对北部湾海域生态环境的影响不可轻视,严重时发生囊体堵塞防城港核电站冷却水水源口,造成严重的生态安全隐患事件[11],因此,研究和治理球形棕囊藻藻华也得到了相关部门的重视和大力支持。目前针对该区域球形棕囊藻藻华的研究包括藻华种的鉴定[14–15]、治理[16–17]及影响藻华生消影响因素等的探索[18–22]。关于营养盐调控的研究中,研究表明球形棕囊藻的生消过程与氮磷营养盐密切相关[22–24]。有学者提出在北部湾海域水体中溶解无机氮的增加是造成藻华多发的重要因素之一,而水体中溶解无机磷的缺乏,是藻华消亡的关键限制因素[23–25]。但是这些研究主要集中于中大尺度的走航调查和实验室室内的培养研究。而具有针对性的小尺度区域研究至今仍旧未见相关研究报道。北部湾三面环海,海岸线较长,不同区域营养盐含量存在差异[26],球形棕囊藻藻华生消过程的影响因素是否一致仍不清楚,因此提高研究区域精度可为区域化针对性治理球形棕囊藻藻华提供重要的基础依据。
在北部湾海域“盛行”球形棕囊藻藻华期间,涠洲岛也未能幸免。涠洲岛位于北部湾海域,距离北海市约有50 km,与雷州半岛直线距离约260 km,岛总面积24.74 km2,年均气温23 ℃[27],是我国最年轻的火山岛,岛周遍布珊瑚礁,怡人的气候和独特的风景成为广西壮族自治区重要的旅游景点。但是远离大陆的涠洲岛海域却也是广西沿海赤潮发生的高发区之一[28–29],为了进一步了解球形棕囊藻藻华过程在远岸区域及小尺度范围所受的影响因素,浮游植物群落组成对藻华过程是否存在一定关联性,本文将根据2017年3月下旬,涠洲岛周边海域发生的球形棕囊藻藻华事件,对其过程中浮游植物种群组成和温度、盐度、营养盐等理化因素进行分析研究,探讨球形棕囊藻藻华过程中,浮游植物的营养状况及该藻华对浮游植物群落结构的影响,为预防及治理该类藻华补充小尺度数据。
1 材料和方法
1.1 站点的设置
本次调查于2017年3月23日展开,根据此次球形棕囊藻藻华发生的范围和分布特征,共设置13个站点(图1)。现场水样的温度、盐度、溶解氧(DO)和pH 等使用AAQ-RINKO 直读式多项目水质分析仪测定(JFE,日本)。

图1 涠洲岛海域调查站点分布图Fig.1 Maps showing sampling stations in the sea area near Weizhou Island
1.2 样品的采集及处理
水样只采集表层海水,适量体积的水样采集后立即用0.45μm 孔径的醋酸纤维滤膜过滤,并保存于500 mL 聚乙烯瓶中用于测定营养盐。取1 000 mL水样过滤于GF/F 膜上,用90%丙酮在4 ℃黑暗下提取24 h 后由荧光分光光度计测定叶绿素a (Chl a)含量。各项营养盐[NO3–、NO2–、NH4+、溶解无机磷(dissolved inorganic phosphate,DIP)和硅酸盐(silicate,SiO32–)]检测均按照国家《海洋监测规范》(GB 17378.3—2007)进行,其中溶解无机氮(dissolved inorganic nitrogen,DIN)=NO3–+NO2–+NH4+,溶解有机磷(dissolved organic phosphorus,DOP)=总溶解磷(total dissolved phosphorus,TDP)-DIP。
取1 000 mL 水样用鲁哥试剂固定于聚乙烯瓶中,用于检测浮游植物的种类组成和密度。其中,球形棕囊藻的细胞密度为水样中游离单细胞密度和囊体及囊体碎片上细胞密度的总和。
球形棕囊藻囊体密度检测方法为现场肉眼观察计数,取适量海水根据密度采取浓缩或者不浓缩处理,将一定体积水样倒在白色瓷盘中,在灯光下进行囊体计数。用浮游植物优势度(y)计算群落种类中的优势种[30],采用Shannon-Wiener 指数(H′)描述群落种类多样性。
优势度y=Pi×fi,式中:Pi为第i个物种个数占总数的比例,fi为第i种在各样点中出现的频率;当y>0.02 时定义为优势种。
1.3 数据处理和分析
文中通过冗余分析(RDA)环境因子对球形棕囊藻藻华特征及浮游植物群落组成及分布的影响,由R 语言vegan 包完成。通过统计学软件SPSS 19.0 分析检验环境因子与球形棕囊藻藻华特征及浮游植物群落组成的相关性。
2 结果和分析
2.1 环境因子分布特征及营养盐状况
表1和图2为环境因子的分布特征。调查区域的温度平均为(22.5±0.5) ℃,岛西南和东北两侧较高,在南湾东部温度较低(图2: A)。盐度平均为32.6±0.2,呈现西北向东南递增的分布趋势(图2:B)。pH 与溶解氧(DO)平均值分别为(8.26±0.10)和(10.92±0.36) mg/L (表1)。

表1 调查海域的环境理化因子Table 1 Environmental physical and chemical factors in the study area
采样期间DIN 平均为(4.62±2.28)μmol/L,南湾附近含量相对较高,由南湾向周边递减(图2: E)。DIP 含量平均为(0.44±0.24)μmol/L,最大值出现在南湾西侧(图2: F)。硅酸盐(SiO32–)平均为(5.80±1.74)μmol/L,离岸越近,含量越高(图2: G)。DOP平均为(0.49±0.20)μmol/L,在调查海域西北侧及南湾偏东侧相对较高(图2: H)。DIN/DIP 整体较低(表2),平均为13.03±8.74,调查区域多个站点小于10。SiO32–/DIN 平均为1.75±1.58,除个别区域外均大于1。SiO32–/DIP 平均为16.76±9.18。

图2 环境因子分布特征 A: 温度(℃); B: 盐度; C: pH; D: DO; E: DIN (μmol/L); F: DIP (μmol/L); G : SiO32– (μmol/L); H: DOP (μmol/L)。Fig.2 Distribution characteristics of environmental factors.A: Temperature (℃); B: Salinity; C: pH; D: Dissolved oxygen; E: DIN (μmol/L); F: DIP (μmol/L);G: SiO32– (μmol/L); H: DOP (μmol/L).
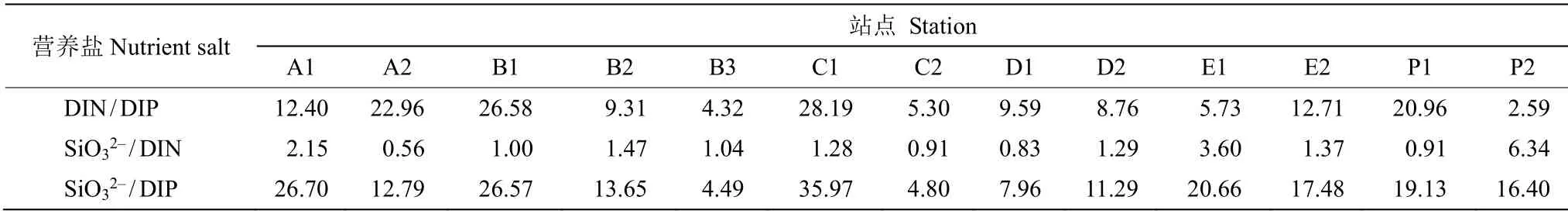
表2 站点的无机营养盐比值Table 2 Inorganic nutrient ratio of stations
2.2 球形棕囊藻分布及浮游植物群落组成
本次调查中,各调查区域水面可见明显球形棕囊藻囊体,采集表层水样并通过光学显微镜镜检共鉴定出金藻门、硅藻门、甲藻门、蓝藻门共4 门58种浮游植物(表3)。球形棕囊藻为本次调查的唯一优势种,优势度(y)为0.98,囊体密度为4×103~1.78×105cells/L,细胞总密度为2.34×106~1.04×108cells/L,球形棕囊藻细胞密度占浮游植物总细胞密度的98.28%。叶绿素a 为1.29~19.71μg/L,平均4.63μg/L(表1),各站点浮游植物物种多样性指数为0.01~1.29(表4),整体上球形棕囊藻藻细胞密度及囊体密度与叶绿素a 呈显著正相关关系(t=0.94,P<0.01),与物种多样性指数呈显著负相关关系(t=–0.97,P<0.01)。

表3 浮游植物种类及分布Table 3 Phytoplankton species and distribution
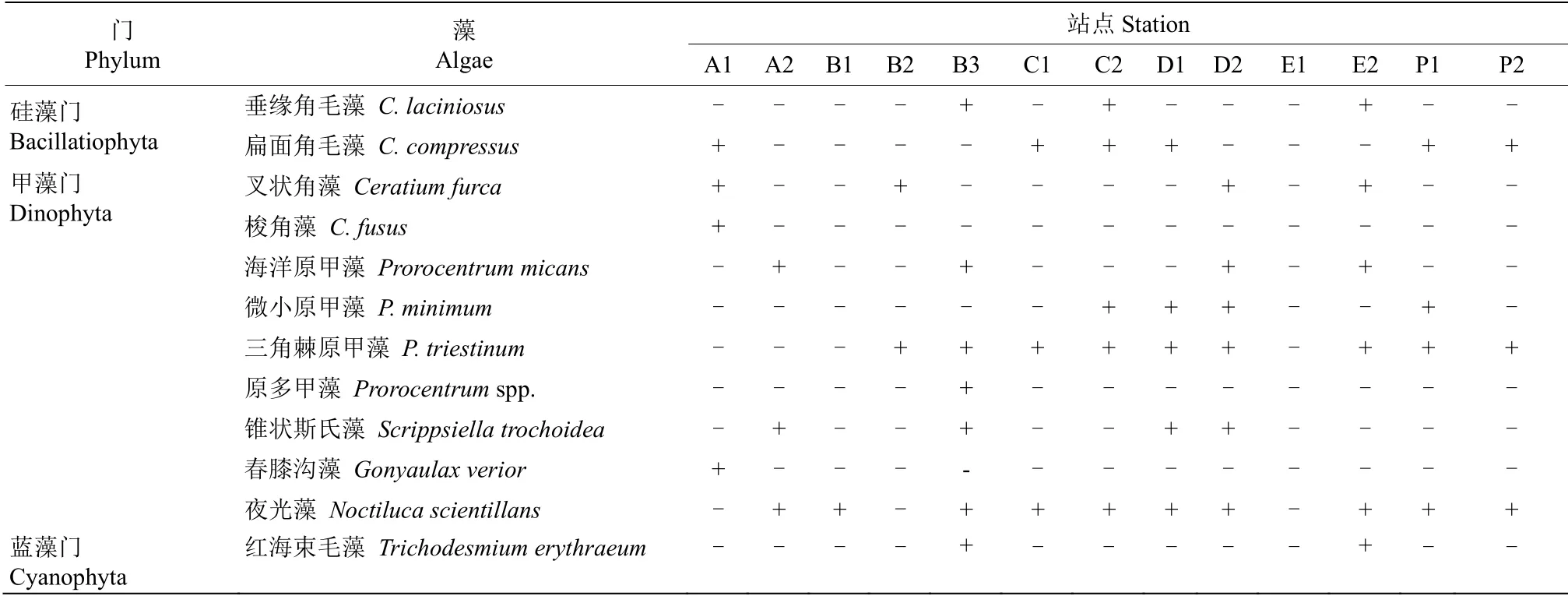
续表(Continued)

表4 浮游植物群落的物种丰度(cells /L)和物种多样性指数(H′)Table 4 Species abundance (cells /L) of phytoplankton community and species diversity index (H′)
本次调查除球形棕囊藻外,硅藻细胞密度较大,占总细胞密度的1.59%,尤其是聚生角毛藻(Chaetoceros socialis)、柔弱拟菱形藻(Pseudonitzschia delicatissima)及环纹娄氏藻(Lauderia annulata)。
2.3 冗余分析结果
将球形棕囊藻、环纹娄氏藻、柔弱拟菱形藻、聚生角毛藻细胞密度进行排序,根据第一轴值为0.30,选择冗余分析(RDA)。根据分值可分为4 个区域(图3),Ⅰ区:RDA1<0,RDA2>0;Ⅱ区:RDA1>0,RDA2>0;Ⅲ区:RDA1<0,RDA2<0;Ⅳ区:RDA1>0,RDA2<0。其中Ⅰ和Ⅲ区的球形棕囊藻细胞密度及囊体个数较高,除DOP、SiO32–外,其余因素值较低。Ⅱ和Ⅳ区的DIN 均高于Ⅰ和Ⅲ区,另外,Ⅰ和Ⅱ区的DIN/DIP 及聚生角毛藻的细胞密度和囊体个数较Ⅲ和Ⅳ区高,但SiO32–小,表明位于这2 个区域的站点DIN/DIP比值均较高,且含有较多的聚生角毛藻,但SiO32–含量较低。

图3 RDA 分析图Fig.3 Map of RDA analysis
统计学检验表明,DOP、SiO32–与球形棕囊藻细胞密度(tDOP=0.81,P<0.01;tSiO32–=0.69,P<0.05)囊体密度(tDOP=0.8156,P<0.05)呈正相关,与温度(Temp)、盐度(Sal)、pH、DIN 及DIP 呈负相关。3类主要硅藻(环纹娄氏藻、柔弱拟菱形藻及聚生角毛藻)与球形棕囊藻囊体密度的相关性大于与球形棕囊藻藻细胞密度的相关性,均存在负相关关系,其中环纹娄氏藻与囊体个数呈显著负相关(t=–0.63,P<0.05)。物种多样性指数(H′)与球形棕囊藻细胞密度(t=–0.97,P<0.01)、囊体密度(t=–0.79,P<0.01)呈负相关关系。
3 结论和讨论
3.1 环境因子对球形棕囊藻藻华的影响分析
在采样前期,涠洲岛周边区域因为出现连续降雨且以东风为主,使温度有骤降现象,以致水体温度相对较低(平均水温22.46 ℃),相对较低的温度有利于球形棕囊藻生长[23]。同时降雨促进营养物质从陆源及大气向海水中输入,适宜的温度和较高营养的环境对球形棕囊藻的生长都极其有利,并且东风利于营养物质在岛周的聚集尤其是在南湾周围,可为本次球形棕囊藻藻华的暴发奠定物质基础[31]。
结合当地渔民发现赤潮的时间以及现场水体中球形棕囊藻囊体的完整度及囊体密度,推测在进行本次调查时已为藻华后期阶段,并且部分站点存在消亡过程。受囊体破裂和藻细胞死亡氧化分解释放大量的CO2和有机物影响,球形棕囊藻藻细胞密度与pH 值及DOP 相关性较高。这与李波[24]等对涠洲岛邻近水域北海市铁山港及廉州湾区域暴发的球形棕囊藻赤潮监测研究得到的结论一致。藻华发生过程中大量的藻细胞繁殖生长会消耗大量DIN以及DIP,所以在本次调查结果中各区域水体中的DIN、DIP 含量较低,与前人[23–24]的研究结论一致。但与他们提出的磷限制是球形棕囊藻消亡的主要原因的结论不同。根据Justic 等[32]和Dortch 等[33]建立的营养盐化学计量限制标准,当DIN/DIP<10,DSiO/DIN>1 时海域为氮限制,本次球形棕囊藻藻华消亡过程更多考虑是由氮限制造成的。
球形棕囊藻生长和囊体的形成与氮、磷营养盐息息相关,DIN 和DIP 可影响细胞密度及囊体的形成与大小。球形棕囊藻生长繁殖会大量消耗水体中的无机氮磷营养,造成此处的无机氮磷(DIN、DIP)含量相对较低,但在囊体破裂和细胞消亡过程中,又会产生大量的DOP[5,9,34]。而浮游植物赤潮发生达到高峰时,碱性磷酸酶的活性在浮游植物的生长中可达到最大值,而与DIN 代谢相关的硝酸还原酶活性则会随着环境中NO3–浓度减少而下降,因此在自然水体中棕囊藻藻华形成及维持,DOP 可发挥重要作用[25,35]。在磷缺乏情况下,球形棕囊藻北部湾株通过高亲和力来竞争磷源,以维持生长[36],而对DIN 的依赖性更强[37]。前人的研究监测范围主要分布在北海沿岸区域,陆源输入对无机营养盐的补充效率更快,影响更大[38],且DIN 补充速率大于DIP,因而DIN/DIP 呈升高的趋势,磷成为藻华消亡的限制因素。而涠洲岛周边水域与沿岸区域不同,涠洲岛受陆源的影响较小,涠洲岛周边易形成众多的小型涡旋及上升流,水体交换弱,营养物质的补给主要受其周围的风场及流场影响[38],涠洲岛周边水体的氮磷比值在北部湾海域中相对较低,春季及夏季平均约为30[38–39]。本次调查中DIN/DIP 和SiO32–/DIN 值均主要受DIN 影响,整体比值较低,DIN/DIP与球形棕囊藻细胞密度及囊体密度均存在负相关关系。以分析对比藻细胞密度最大的两个区域(A1、E1)的营养盐成分含量及球形棕囊藻形成囊体的完整度差异为例来进一步阐述氮限制观点:首先,E1处出现大量的囊体碎片,A1 处囊体形态较好,研究发现球形棕囊藻囊体形成依赖于硝酸盐的浓度,在氮限制时,球形棕囊藻囊体的形成受到严重抑制[5,9,34]。结合两个站点位置差异可以发现,A1 靠近南湾口,南湾沿岸是涠洲岛居民及游客的主要生活聚集地,人类活动排放的生活废水等对水体营养盐含量的影响更大;其次,受外海及通过琼州海峡进入北部湾的珠江口及粤西沿岸富营养水体影响,在流场和风场作用下污染物更易滞留在南湾处[31,40]。这2 个因素都有利于外界对A1 处水体中DIN 的补给,所以两处DIP 含量差异较小,但E1 处DIN/DIP(5.72)远低于A1 处(12.41),而DIN 的补给在一定程度上也可以缓解A1 处球形棕囊藻的氮胁迫程度,使球形棕囊藻生长得到维持。
3.2 球形棕囊藻藻华的发生对浮游植物群落结构的影响
本次涠洲岛周边水体球形棕囊藻藻华期间,浮游植物的物种多样性指数与球形棕囊藻细胞密度及囊体个数呈显著负相关,与学者在北部湾海域球形棕囊藻藻华期间发现球形棕囊藻囊体丰度与群落多样性指数变化趋势相反[23]结果一致。且通过相关性分析可以发现,球形棕囊藻囊体密度与环纹娄氏藻、柔弱拟菱形藻及聚生角毛藻等这3 种硅藻均存在一定的负相关关系。这3 种硅藻与球形棕囊藻囊体一样主要受温度及DIN/DIP 值影响,因此温度及营养盐较低的环境下,竞争的弱势使得其余类群的藻类生长繁殖受到限制,也造成球形棕囊藻囊体个数较大时,物种多样性下降。但是与一些硅藻及甲藻相比,硅藻中的聚生角毛藻、柔弱拟菱形藻及环纹娄氏藻,密度相对较高,且这3 种藻类在各站点中均有分布,意味着棕囊藻囊体的形成可能与这些硅藻有着密切的联系。
多项研究表明,不同种类的硅藻对于球形棕囊藻囊体形成的影响存在种类差异性,在棕囊藻多个生活史阶段,都不同程度地发现硅藻的参与[1]。在涠洲岛及其邻近海域角毛藻、拟菱形藻、骨条藻和海线藻(Thalassionema)等硅藻在温度较高的春、夏季占优势[41–43],这些种类多为具有棘、刺或链状结构的硅藻,可以为球形棕囊藻前期的成囊提供附着的基质。本研究发现在调查期间角毛藻属和柔弱拟菱形藻数量较大,且在采样区域均有分布,而这2类硅藻都是有利于球形棕囊藻生存发展的硅藻种类,尤其是角毛藻,其角毛被认为是棕囊藻常见的附着位置之一[44]。而环毛藻(Corethron)等此类藻细胞不仅可以为棕囊藻提供可附着的基质,其硅质细胞壁可保护棕囊藻不被小的捕食者所摄食,从而促进棕囊藻形成更多的囊体,提高棕囊藻的生存机率。不仅如此,硅藻与棕囊藻间还是一种兼性共生的生态类型,硅藻为棕囊藻提供防御摄食的环境,而棕囊藻囊体可作为硅藻栖息地和生长底物[1,5]。因此与其他硅藻及甲藻相比,聚生角毛藻、柔弱拟菱形藻及环纹娄氏藻等链状硅藻在球形棕囊藻藻华过程中,营养物质相对缺乏的条件下,仍可维持一定数量细胞密度。
综上所述,本次调查期中涠洲岛周边水体球形棕囊藻藻华暴发使水体中无机氮磷以及硅酸盐含量相对较低,在藻华明显发生消亡的区域中存在氮限制的现象。因此,本次涠洲岛周边水体球形棕囊藻藻华的消亡主要受氮限制影响。涠洲岛周边水体发生球形棕囊藻藻华时,球形棕囊藻生长处于优势,消耗水体中大量营养物质,导致其他藻类的生长受到一定程度的抑制,因此球形棕囊藻藻细胞、囊体密度皆与物种多样性指数呈显著的负相关。但在营养受限条件下,仍有一部分具有链状结构的硅藻维持相对较高的密度,而这一类硅藻都具有与球形棕囊藻共生的自身优势。
