粗糙脉孢菌丝切蛋白的纯化及微丝解聚活性分析
2022-12-17陈菁秋孙海涛李艳红陈志玲
黄 璐, 陈菁秋, 孙海涛, 李艳红, 陈志玲
(首都师范大学 生命科学学院, 北京 100048)
微丝骨架作为细胞骨架的重要成员,最显著的特征是其动力学性质,通过众多肌动蛋白结合蛋白的调控,完成微丝的解聚、聚合、重排、成束等,进而调控生物体内许多极为重要的生命活动,如细胞极性的建立和维持、细胞生长、细胞分裂、细胞迁移、信号传导等[1]。
丝切蛋白(cofilin)/肌动蛋白解聚因子(actin depolymerizing factor,ADF)普遍存在于真核生物中,是一类含量丰富、分子质量较小的肌动蛋白结合蛋白,它既能够与单体肌动蛋白(G-actin)结合,使G-actin从微丝(F-actin)上解离下来,也能够切割F-actin,加速F-actin的踏车行为,进而在actin动态周转中发挥重要作用。从20世纪80年代首次利用DEAE纤维素层析柱从鸡胚的脑组织中分离纯化得到cofilin后,至今陆陆续续从其他物种中分离得到160余种编码cofilin/ADF家族成员的基因。cofilin/ADF家族包括:cofilin、脊椎动物ADF或destrin、植物ADF、depactin和actophorin。目前已知所有真核生物中至少含有1种cofilin/ADF异型体,如酿酒酵母、线虫、苔藓的基因组中均含有1个编码cofilin/ADF的基因,拟南芥基因组中含有11个编码ADF的基因[2-3]。有研究报道,利用siRNA技术下调肾COS-7成纤维细胞系中内源cofilin的表达水平后,抑制了细胞凋亡;腺苷酸环化酶1在小鼠卵母细胞成熟过程中通过调节actin的组装发挥作用,下调其表达水平纺锤体的迁移明显减慢,胞质分裂异常,而同时上调cofilin表达水平后,可部分挽救腺苷酸环化酶1下调引起的表型缺陷[4-5]。突变导致的cofilin功能失活对线虫、果蝇和酿酒酵母来说是致死的[6],由此可见,cofilin对真核生物的生命活动是至关重要的。
通过结构生物学等手段对cofilin家族成员与actin的相互结合研究发现,位于cofilin N端的几个氨基酸残基和α-3螺旋对其与actin的结合和F-actin解聚的活性是必须的,cofilin N端序列相似性不高,但是其中的丝氨酸残基高度保守。当将丝氨酸突变后,其F-actin解聚能力受到影响[6-7]。
粗糙脉孢菌是低等真核生物,其菌丝形态发生表现为典型的极性生长模式,在快速生长的菌丝细胞中,微丝骨架发挥着重要的作用。Virag等[8]通过对粗糙脉孢菌进行紫外线照射,并结合细胞松弛素A筛选获得了第一个actin突变株actin1,此突变株在F-actin的分布、菌丝的分枝模式和形态等方面均表现出与野生型明显的差异。利用GFP-lifeact报告基因观察到粗糙脉孢菌菌丝细胞内存在肌动蛋白环(actin rings)、微丝(F-actin)和肌动蛋白斑点(actin patches),并且F-actin介导菌丝细胞顶端区域物质的运输[9]。作为肌动蛋白结合蛋白家族中重要成员的粗糙脉孢菌cofilin(NcCof),可能通过调节actin的动态组装过程来控制菌丝的形态发生。通过对NcCof进行生物信息学分析,利用大肠杆菌原核系统诱导表达,纯化获得NcCof、NcCof(S4A)和NcCof(S4D) 蛋白,并对其F-actin解聚活性进行分析,为后续阐明NcCof调控actin动态特性的分子机制以及NcCof在菌丝生长发育中的作用奠定基础。
1 材料与方法
1.1 材料
蛋白表达载体pGEX-KG-NcCof、pGEX-KG-NcCof (S4A)、pGEX-KG-NcCof (S4D)、大肠杆菌(Escherichiacoli)菌株BL21(DE3)由本课题组保存;Glutathione-Sepharose beads和Thormbin购自Sigma公司, IPTG购自Merck公司; 其他试剂均购自北京江晨文轩生物科技有限责任公司。
溶液配方:PBS pH 7.4、10×ME pH 8.0、10×KMEI pH 8.0、G-buffer pH 8.0参考Jiang等[10]方法。
1.2 方法
1.2.1 NcCof蛋白理化特性、序列保守性及结构预测
利用在线软件ProtParam (http:∥web.expasy.org/protparam/)预测NcCof蛋白的氨基酸数量、分子质量和理论等电点等理化性质。从Uniprot(https:∥www.uniprot.org/)网站检索和下载酵母(Saccharomycescerevisiae)、小鼠(Musmusculus)、拟南芥(Arabidopsisthaliana)、人(Homosapiens) 的cofilin序列,利用Clustal X软件和ESPript进行不同物种cofilin氨基酸序列比对和二级结构预测。利用SWISSMODEI (http:∥swissmo del.expasy.org/)在线预测蛋白三级结构。
1.2.2 NcCof、NcCof(S4A)和NcCof(S4D)蛋白的诱导表达
将pGEX-KG-NcCof、pGEX-KG-NcCof(S4A)、pGEX-KG-NcCof (S4D)质粒分别通过热击转化大肠杆菌BL21(DE3),37 ℃,200 r/min过夜培养。第二天按1∶100接种扩大培养,待OD600=0.6~0.8时,加入0.4 mmol/L IPTG 16 ℃诱导16 h。
1.2.3 NcCof、NcCof(S4A)和NcCof(S4D)蛋白的纯化
诱导完成后,4 ℃、4 000 r/min离心10 min,收集菌体,然后用25 mL PBS重悬菌体,超声破碎仪破碎细胞,细胞悬浊液4 ℃、10 000 r/min离心30 min,收集上清液。将上清液与用PBS处理后的Glutathione-Sepharose beads 4 ℃结合1 h,之后转移至亲和层析柱,控制流速0.6 mL/min。50 mL PBS冲洗层析柱,洗去未结合的非特异性杂蛋白,在层析柱中保留2 mL PBS 溶液。
向层析柱中加入50 U的Thormbin,封住层析柱两端,4 ℃摇床消化过夜。次日收集流出液,即为切掉GST标签的目的蛋白溶液。将目的蛋白溶液于4 ℃ 1 mmol/L Tris-HCl pH 7.5缓冲液中透析,超滤管浓缩。留取样品10 μL待15% SDS-PAGE检测。其余蛋白分装至Ep管,液氮速冻后保存在-80 ℃冰箱。

5种不同来源的cofilin/ADF序列比对(Uniprot ID分别为NcCof: V5IPJ8;ScCof: Q03048;Mm:P18760;AtADF1: Q39250;HuCof: P23528 )。#为预测活性位点。 图1 不同来源Cofilin的氨基酸序列比对和二级结构预测 Figure 1 Structural sequence alignments of NcCof and representative examples of cofilins
1.2.4 兔肌动蛋白的提取与纯化
首先制备兔骨骼肌丙酮粉,然后利用离心、盐析、分子筛和透析等方法进行肌动蛋白纯化[10]。
1.2.5 高速共沉淀实验分析NcCof蛋白的微丝解聚活性
参考Jiang等[10]方法进行高速共沉淀。所有蛋白及所用溶液4 ℃、75 000 r/min,离心35 min,取上清液,Bradford测定蛋白浓度。室温条件下聚合10 μmol/L的F-actin,然后将F-actin 30 μL与NcCof蛋白加入Ep管中,再加入10×KMEI 10 μL,用G-buffer补足至总体积为100 μL。反应体系中的蛋白以只加入F-actin或只加入NcCof蛋白为对照。F-actin和NcCof工作浓度分别为3、20 μmol/L。30 ℃孵育0.5 h。4 ℃,75 000 r/min,离心30 min。分别吸取上清液和沉淀进行15% SDS-PAGE检测。
1.2.6 高速共沉淀实验分析NcCof、NcCof(S4A)和NcCof(S4D)蛋白的微丝解聚活性
参考1.2.5节方法,只是反应体系中NcCof、NcCof (S4A)和NcCof (S4D)蛋白分别设置一系列浓度梯度:0、5、10、15 μmol/L。SDS-PAGE检测后,Image J软件分析蛋白条带丰度。
1.3 数据分析
实验重复3次,利用软件SPSS 19.0进行统计学分析。
2 结果与分析
2.1 NcCof的理化特性、序列保守性及结构预测分析
对NcCof蛋白理化性质进行分析表明,其理论等电点为5.36,预测分子质量为17.180 7 ku,富含丝氨酸(S)、丙氨酸(A)、谷氨酸(E)和赖氨酸(K),154个氨基酸中含酸性氨基酸(D+E)24个,碱性氨基酸(R+K)21个。对cofilin氨基酸序列比对和二级结构预测发现,不同来源的cofilin氨基酸序列一致性并不高,NcCof与ScCof氨基酸一致性为39%,与AtCof氨基酸一致性为34%,N末端丝氨酸残基(NcCof S4)高度保守。它们的二级结构元件非常相似,均由6个β-折叠和5个α-螺旋组成(图1)。 对三级结构进行预测结果表明,组成NcCof的6个β-折叠中,β-2、β-3、β-4和β-5折叠片处于反平行状态,β-1和β-3为平行β折叠片,β-5和β-6为平行β折叠片,5个α-螺旋围绕在β折叠片周围(图2),这些特征属于典型的cofilin/ADF折叠模式。
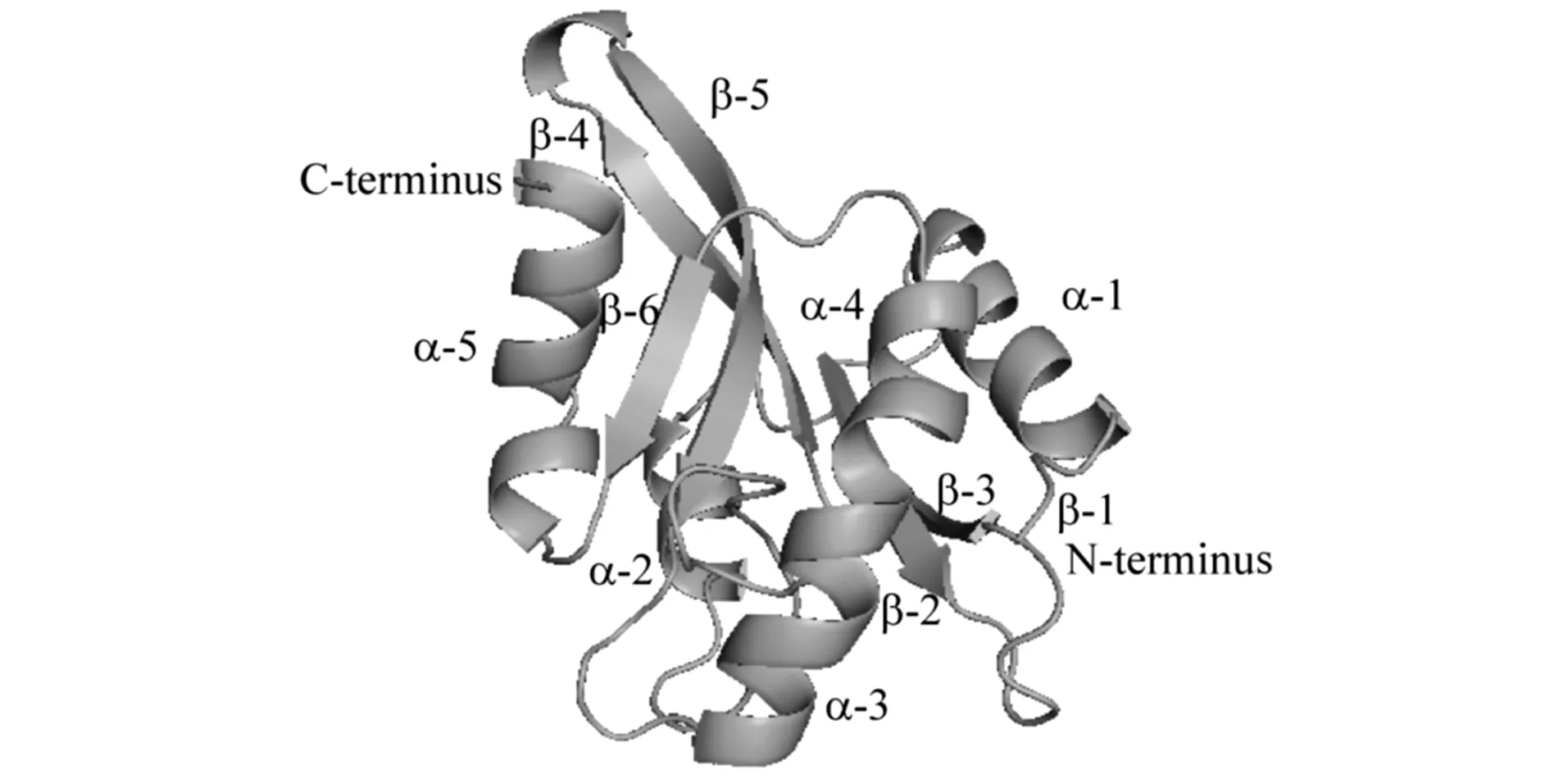
图2 NcCof的三级结构Figure 2 Ribbon diagram of the NcCof structure
2.2 NcCof、NcCof(S4A)和NcCof(S4D)蛋白的纯化
为了分析NcCof是否具有解聚F-actin的活性,在原核细胞中诱导表达,亲和层析纯化,Thormbin切掉GST标签后获得NcCof、NcCof(S4A)和NcCof (S4D)蛋白,SDS-PAGE结果表明,在17 ku处有清晰的目的条带,与预测蛋白分子质量大小一致(图3)。
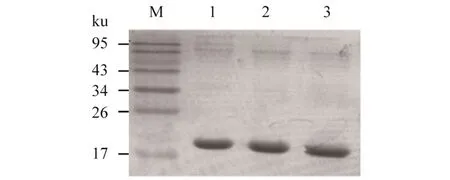
M:Marker;1:NcCof; 2:NcCof (S4A);3:NcCof (S4D)。图3 NcCof、NcCof(S4A)和NcCof(S4D)蛋白的SDS-PAGE结果Figure 3 SDS-PAGE analysis of purified NcCof and mutantproteins (S4A,S4D)
2.3 高速共沉淀分析NcCof蛋白的F-actin解聚活性
高速共沉淀技术是研究肌动蛋白及其结合蛋白相互作用的一种常用经典手段,在高速离心力作用下,F-actin分子质量大,以沉淀形式存在,而G-actin分子质量小,存在于上清液中,通过比较沉淀和上清液中肌动蛋白的比例检测肌动蛋白结合蛋白在actin聚合/解聚中的功能。
在只加F-actin的对照中,G-actin几乎只出现在沉淀中,只加NcCof的对照中,NcCof只出现在上清液中,而在加入F-actin和NcCof的实验组中,沉淀和上清液中均有两种蛋白存在(图4),表明NcCof既能够与F-actin结合,也能够与G-actin结合,并且具有解聚F-actin的活性。

1、2:对照组(只加actin,1为上清液;2为沉淀)。3、4:实验组,加actin和NcCof(3为上清液;4为沉淀)。5、6:对照组,只加NcCof(5为上清液;6为沉淀)。图4 NcCof与F-actin的高速共沉淀结果Figure 4 F-actin depolymerizing activity of NcCof detected by high-speed co-sedimentation
2.4 NcCof、NcCof(S4A)和NcCof(S4D)蛋白的F-actin解聚活性分析
为进一步分析NcCof对微丝解聚活性的影响是否与浓度有关,同时也为了研究NcCof N端丝氨酸(S4)对其活性影响,通过高速共沉淀实验对NcCof、NcCof(S4A)和NcCof(S4D) 3种蛋白的微丝解聚活性进行分析,在F-actin量完全相同的情况下,分别加入不同浓度的NcCof、NcCof(S4A)和NcCof(S4D)蛋白,SDS-PAGE检测结果如图5(a)所示,上清液中G-actin的含量随着体系内NcCof、NcCof(S4A)和NcCof(S4D)蛋白浓度的增加而增加,沉淀中G-actin的含量则相应减少,进一步用Image J定量分析,发现NcCof(S4A)与NcCof解聚F-actin的活性差别不明显,而NcCof (S4D)解聚F-actin的活性随着浓度的升高(10 μmol/L和15 μmol/L)明显弱于NcCof[图5(b)]。数据表明,NcCof、NcCof(S4A)和NcCof(S4D)这3种蛋白均具有使F-actin解聚的活性,而且具有浓度梯度效应。

(a)高速共沉淀检测不同浓度NcCof、NcCof(S4A)和NcCof(S4D)的F-actin解聚活性,上清液(S,supertnatant)和沉淀(P,pellet)中G-actin的SDS-PAGE;(b)定量分析不同浓度NcCof、NcCof(S4A)和NcCof(S4D)的F-actin解聚活性。实验3次重复,图中给出的是平均值±标准误,经t检验,* 为P<0.05,** 为P<0.01。图5 高速共沉淀分析NcCof及突变蛋白的F-actin解聚活性Figure 5 Comparison of F-actin depolymerizing activity of NcCof and mutant proteins by high-speed co-sedimentation assay
3 讨论与结论
肌动蛋白解聚因子的同源结构域(actin-depolymerizing factor homology domains,ADF-H)广泛存在于真核生物细胞中,目前发现ADF/cofilin、GMF(glia maturation factor)、coactosin 、Anp1/drebrin和twifilin这5个家族的蛋白中包含此结构域[11-12]。Goroncy等[12]对小鼠的GMF β、GMF γ、coactosin、twifilin和人的HIP-55(类drebrin蛋白) 的ADF-H结构域分析发现,它们在一级结构上氨基酸的序列相似性仅有约20%,但是高级结构却非常相似。中间有5个β-折叠,其中的4个反平行,第5个与第4个平行排列,并被至少4个α-螺旋围绕。研究对粗糙脉孢菌NcCof的高级结构预测后发现,它含有6个β-折叠和5个α-螺旋二级结构元件,5个α-螺旋围绕在β-折叠片层周围,具有已报道的ADF-H结构域的典型特征。不同物种Cofilin/ADF的功能位点比较保守,对cofilin/ADF家族成员的序列分析发现,它们在N末端存在一未形成有序结构的区段,并且N末端5个氨基酸残基组成的短肽片段对和G-actin的结合非常重要,在这一短肽片段中,其中高度保守的丝氨酸残基(动物中为S3,植物中为S6,酵母中为S4)对cofilin/ADF发挥活性尤为关键[13-15]。定点突变技术是研究蛋白质相互作用位点及活性氨基酸位点功能的有力手段,对重组表达的鸡cofilin进行体外活性分析时,发现cofilin(S3A)保持切割微丝能力,而cofilin(S3D)则几乎失去了与肌动蛋白结合的能力和切割活性,并且S3可被磷酸化[14]。Huehn[7]和Elam等[16]分别利用冷冻电镜等技术对人cofilin S3D与actin复合体的研究表明,cofilin S3D的结合使肌动蛋白发生了空间上轻微的倾斜,并且cofilin S3D 的N末端与肌动蛋白脱离,推测是cofilin S3D的微丝解聚活性改变的原因。烟草NtADF S6突变为D后,在花粉管细胞中,可看到GFP-NtADF与F-actin共分布,而NtADF(S6D)则不能,并且体外生化实验也发现NtADF(S6D)与F-actin的结合能力明显下降[15],Lappalainen 等[6]的研究则表明,与哺乳动物和植物不同,酵母cofilin S4不发生磷酸化,但是S4是cofilin和actin结合和发挥解聚活性的重要位点。NcCof的第4位氨基酸(S4)高度保守,对NcCof(S4)点突变后,通过亲和层析纯化得到NcCof、NcCof(S4A)和NcCof(S4D)蛋白,进一步分析发现,三者均具有解聚F-actin的活性,只是NcCof(S4D) 解聚活性明显减弱,但并未丧失解聚能力,表明NcCof具有传统的cofilin/ADF解聚F-actin活性,而且其中S4可能是NcCof发挥活性的重要位点,并且存在其独特的调节机制。动物细胞中,LIM激酶和TES激酶可磷酸化cofilin,植物细胞中,钙调蛋白激酶CDPK调控ADF的磷酸化[4,17],粗糙脉孢菌中是否存在与动物或植物相似的机制目前还不清楚,后续可通过定点突变对NcCof的其他保守位点以及磷酸化调控进行研究,还可通过环境pH、PIP2以及氧化胁迫对NcCof的调控研究,从而进一步探讨NcCof调控actin动态特性的分子机制,为阐明粗糙脉孢菌的生长发育机制提供依据。
致谢:感谢清华大学黄善金教授在实验过程中给予指导。
